Содержание
- 2. Что такое волновая функция – Ψ ? Волновая функция (функция состояния, пси-функция, амплитуда вероятности) — комплексная
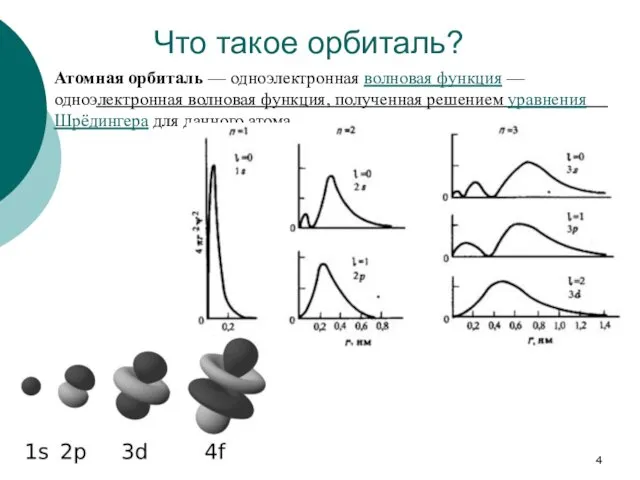
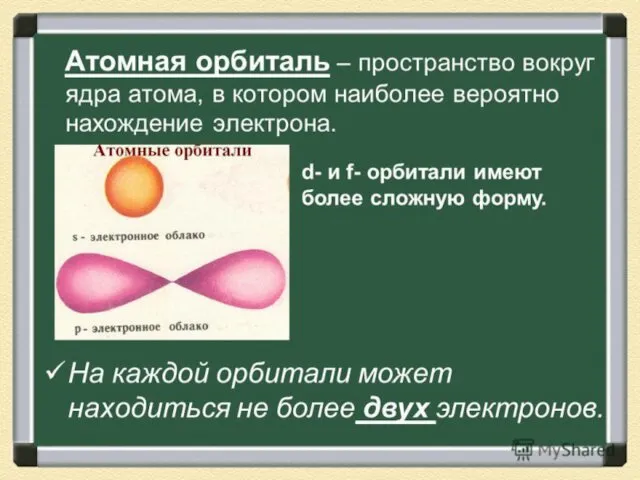
- 4. Что такое орбиталь? Атомная орбиталь — одноэлектронная волновая функция — одноэлектронная волновая функция, полученная решением уравнения
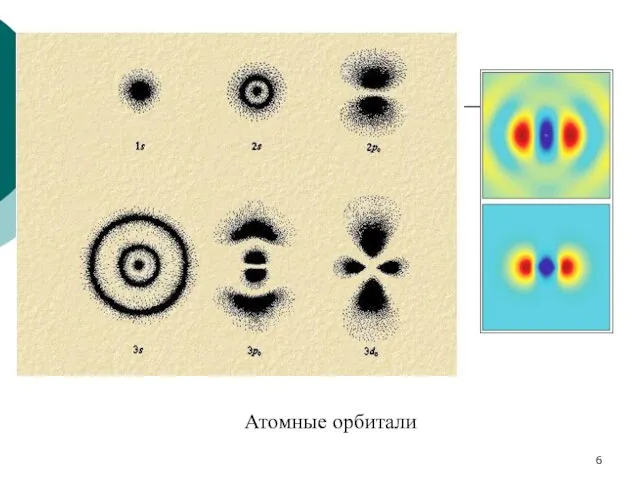
- 6. Атомные орбитали
- 7. Метод валентных связей Метод валентных связей основывается на положении, что каждая пара атомов в химической частице
- 8. Основные положения метода валентных связей 1. Ковалентную химическую связь образуют два электрона с противоположными спинами, принадлежащие
- 10. Химическая ковалентная связь Американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с
- 11. Только о небольшой части всех химических связей можно сказать, что они являются чисто ковалентными. В таких
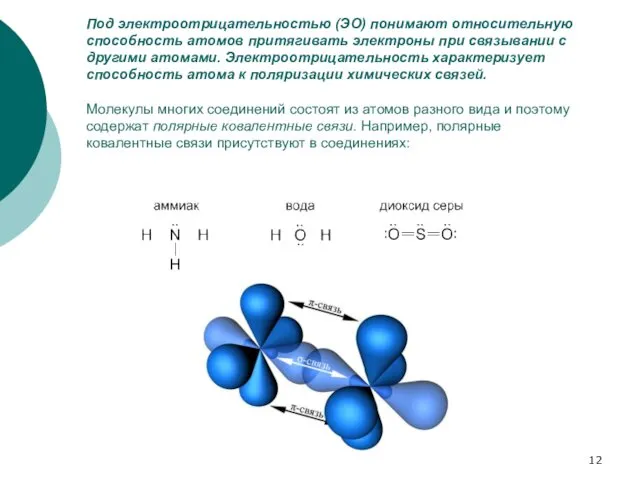
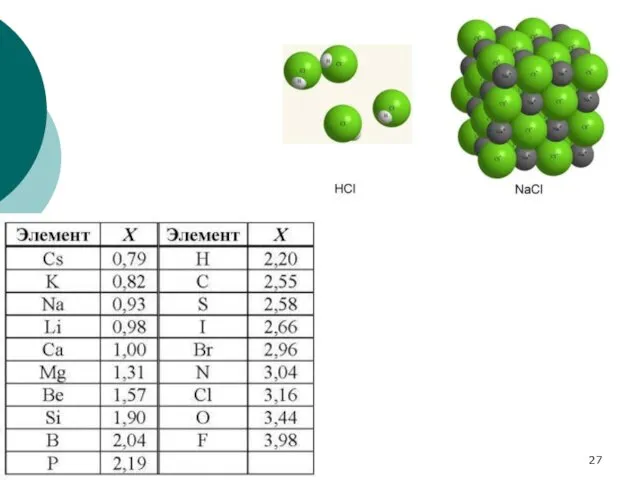
- 12. Под электроотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует
- 13. Для примера рассмотрим диоксид серы SO2. Кислород и сера имеют похожие валентные оболочки (...2s2 2p4) и
- 14. Льюис: атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную
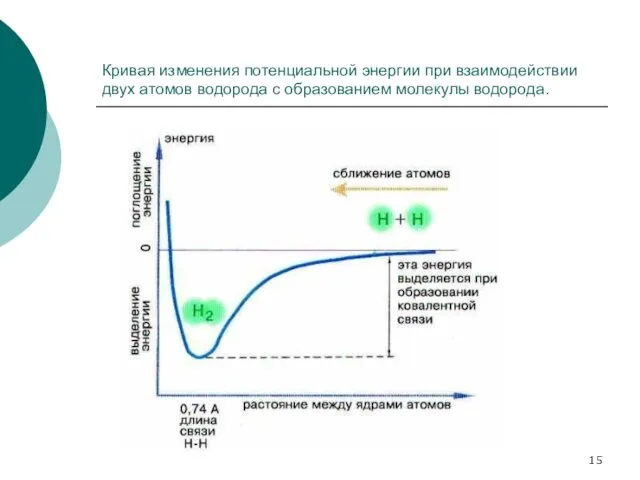
- 15. Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с образованием молекулы водорода.
- 16. Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар. Рассмотрим связывание двух
- 17. Ионная связь Na: 1s2 2s2 2p6 3s1 F: 1s2 2s2 2p5 Ne: 1s2 2s2 2p6 В
- 18. Полярная ковалентная связь Этот вид связи занимает промежуточное положение между чисто ковалентной связью и ионной связью.
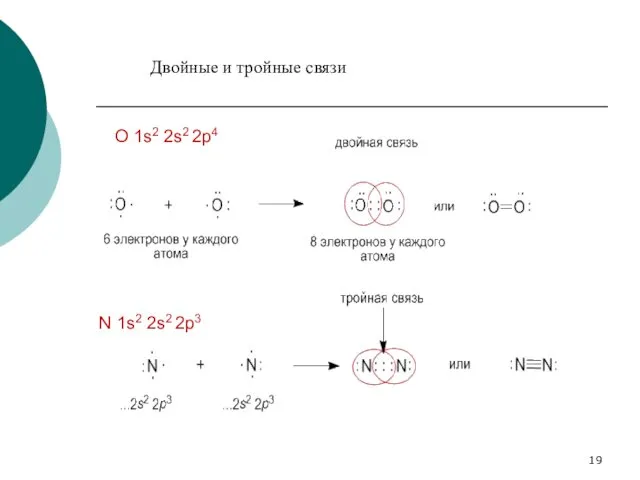
- 19. N 1s2 2s2 2p3 O 1s2 2s2 2p4 Двойные и тройные связи
- 20. Правило Джиллеспи: геометрическая структура молекулы определяется взаимным расталкиванием валентных электронных пар (связывающих и неподеленных), причем они
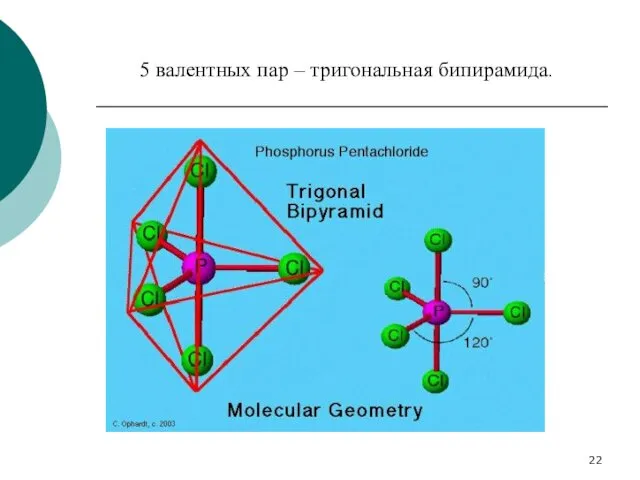
- 22. 5 валентных пар – тригональная бипирамида.
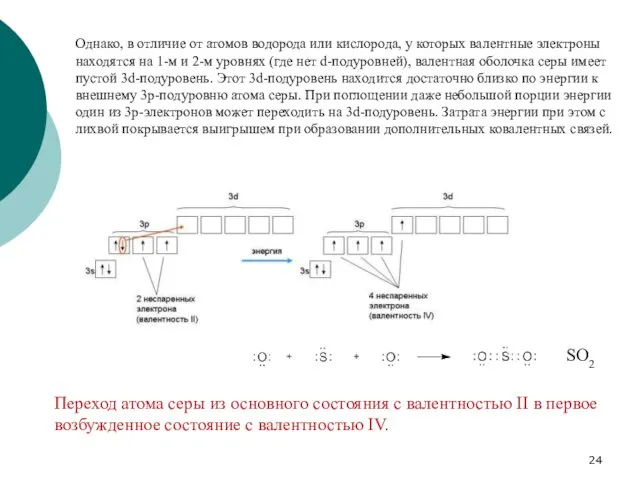
- 23. Элементы с переменной валентностью. Сера располагает свои 16 электронов на 1-м, 2-м и 3-м уровнях: 1s2
- 24. Однако, в отличие от атомов водорода или кислорода, у которых валентные электроны находятся на 1-м и
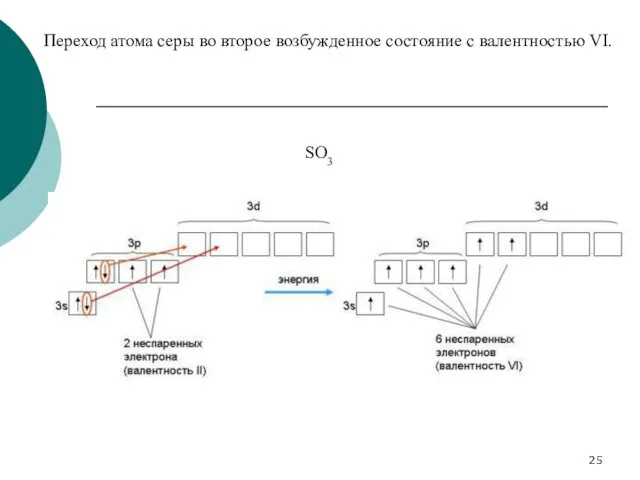
- 25. Переход атома серы во второе возбужденное состояние с валентностью VI. SO3
- 26. Ионная связь Na: 1s2 2s2 2p6 3s1 F: 1s2 2s2 2p5 Ne: 1s2 2s2 2p6 В
- 28. Для чисто ковалентной связи такая разница всегда равна нулю, например: а) связь F—F в молекуле фтора
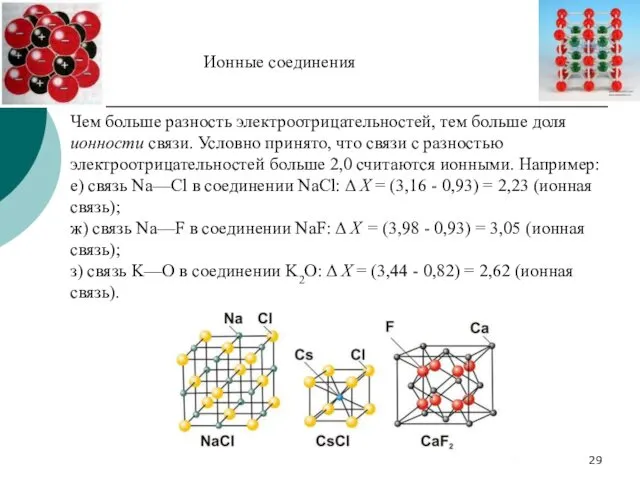
- 29. Чем больше разность электроотрицательностей, тем больше доля ионности связи. Условно принято, что связи с разностью электроотрицательностей
- 32. 1. В этой теории квантовомеханические зависимости для атома распространены на более сложную систему - молекулу. Молекула
- 33. 3. По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначают греческими буквами σ-,
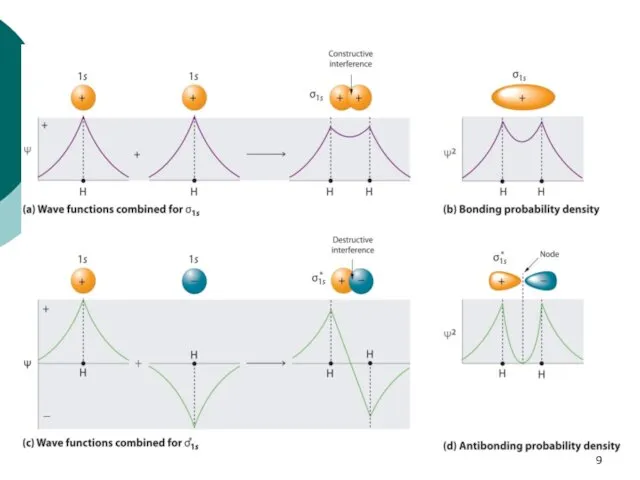
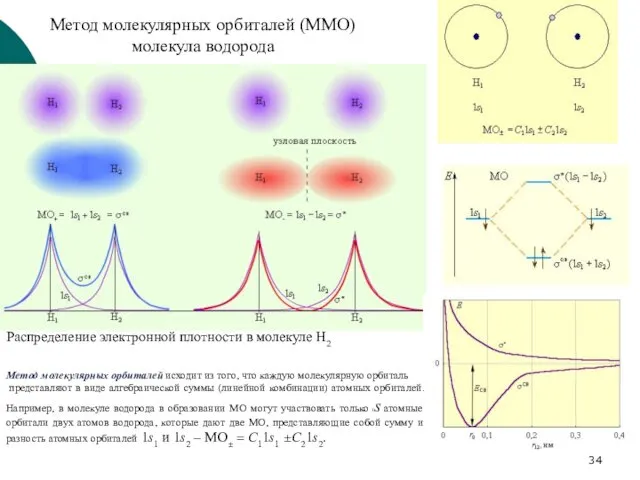
- 34. Метод молекулярных орбиталей (ММО) молекула водорода Распределение электронной плотности в молекуле H2 Метод молекулярных орбиталей исходит
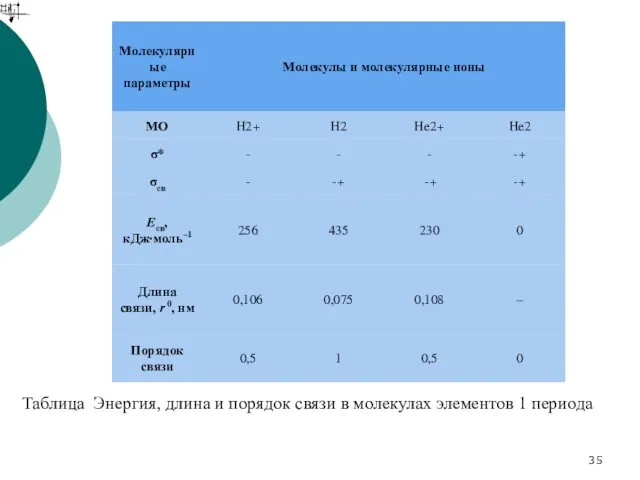
- 35. Таблица Энергия, длина и порядок связи в молекулах элементов 1 периода
- 36. Перекрывание одинаковых 1s-орбиталей атомов лития даст две молекулярные орбитали (связывающую и разрыхляющую), которые согласно принципу минимума
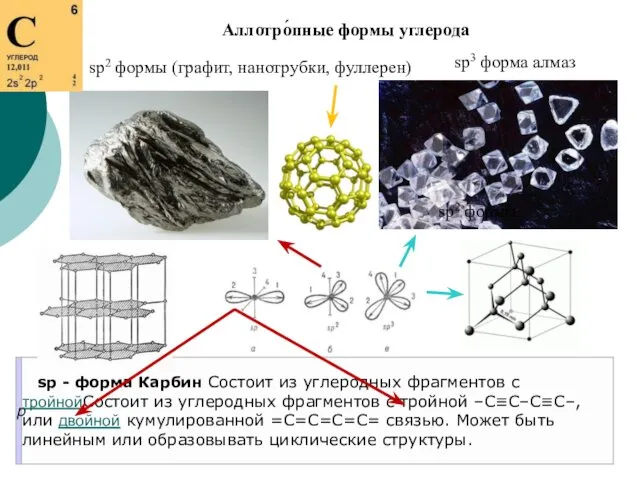
- 37. sp3 форма алмаз Аллотро́пные формы углерода sp2 формы sp2 формы (графит, нанотрубки, фуллерен)
- 39. Лекция 4 Химическая связь в кристаллах. Основы зонной теории. Связь в металлах, полупроводниках и ионных кристаллах
- 40. ДИЭЛЕКТРИКИ
- 41. CaF2 флюорит
- 42. МЕТАЛЛЫ
- 43. ПОЛУПРОВОДНИКИ
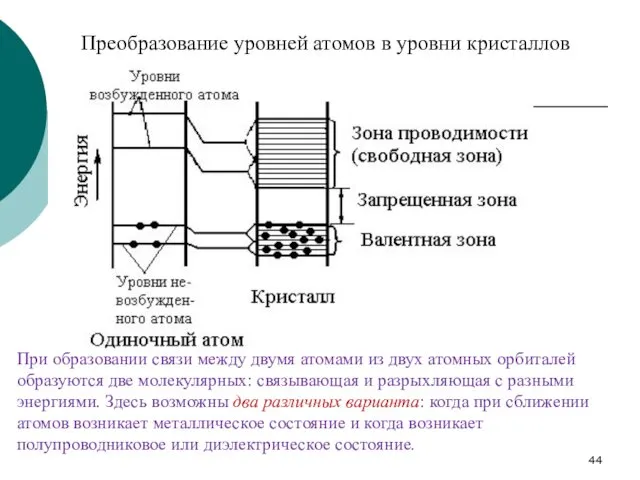
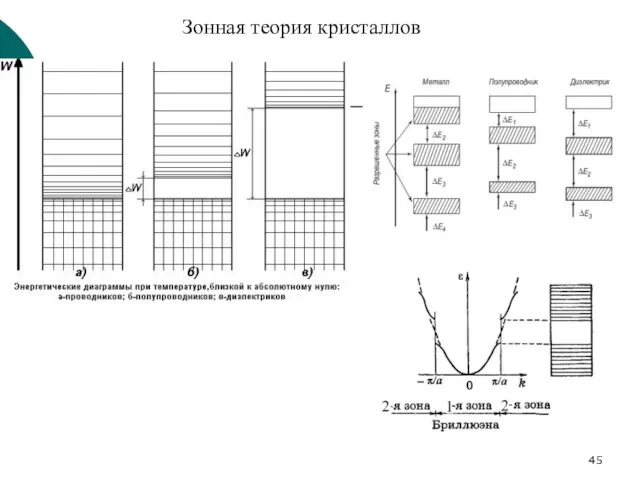
- 44. Преобразование уровней атомов в уровни кристаллов При образовании связи между двумя атомами из двух атомных орбиталей
- 45. Зонная теория кристаллов
- 46. Полупроводниковое (и диэлектрическое) состояние обеспечивается направленными ковалентными связями. Практически все атомарные полупроводники имеют решетку типа алмаза,
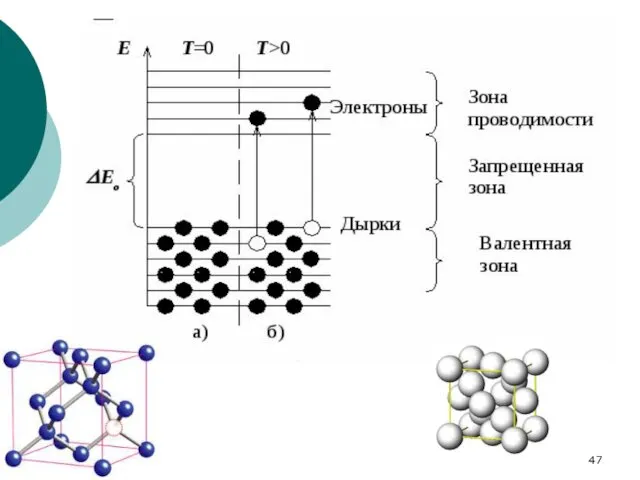
- 48. При отличных от нуля температурах под действием энергии теплового движения атомов ковалентные связи могут разрываться, и
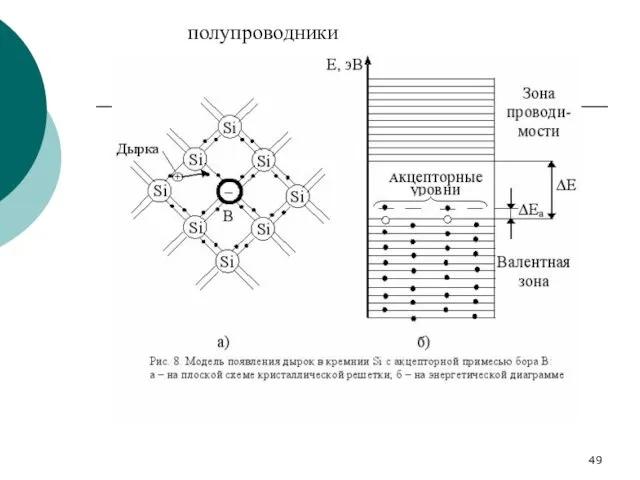
- 49. полупроводники
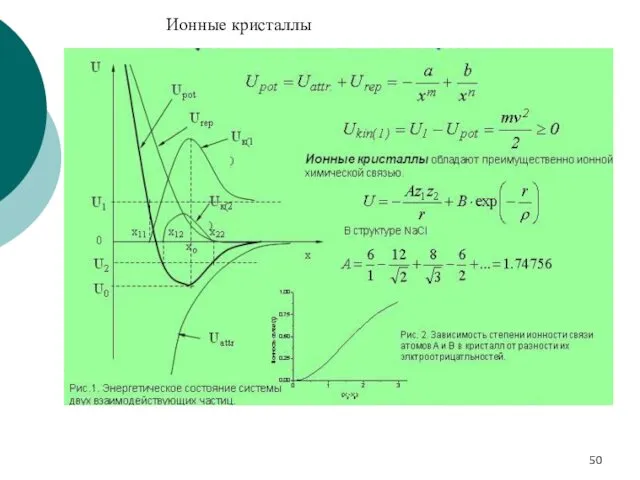
- 50. Ионные кристаллы
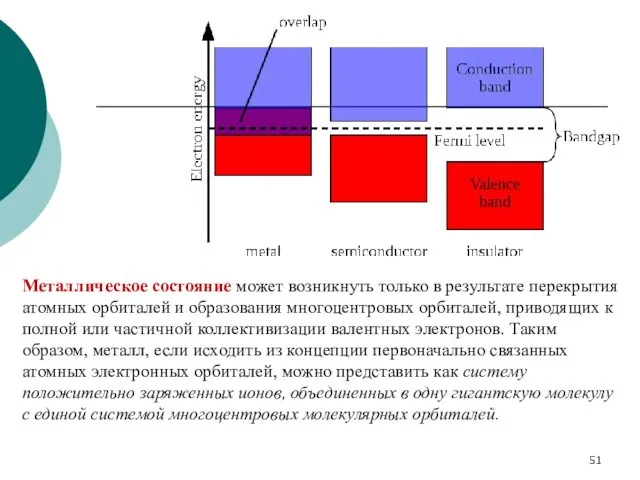
- 51. Металлическое состояние может возникнуть только в результате перекрытия атомных орбиталей и образования многоцентровых орбиталей, приводящих к
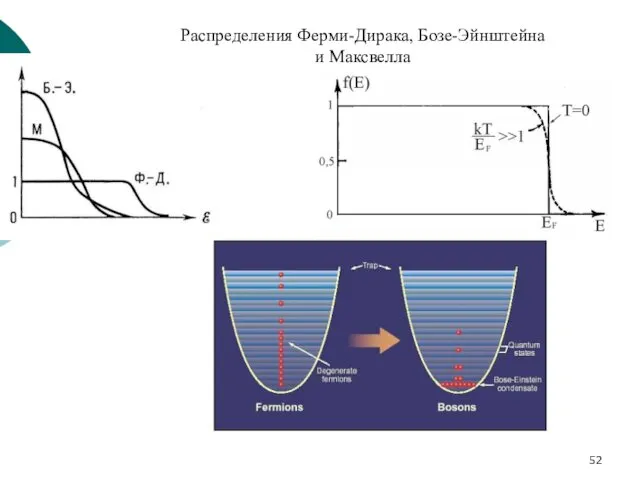
- 52. Распределения Ферми-Дирака, Бозе-Эйнштейна и Максвелла
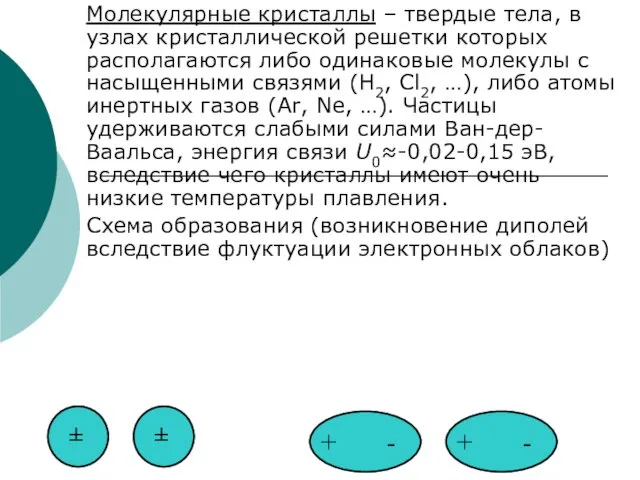
- 53. Молекулярные кристаллы – твердые тела, в узлах кристаллической решетки которых располагаются либо одинаковые молекулы с насыщенными
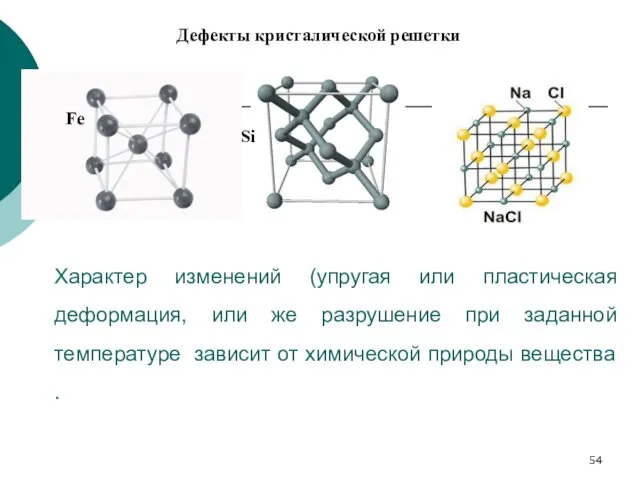
- 54. Характер изменений (упругая или пластическая деформация, или же разрушение при заданной температуре зависит от химической природы
- 55. Дефекты в кристаллах
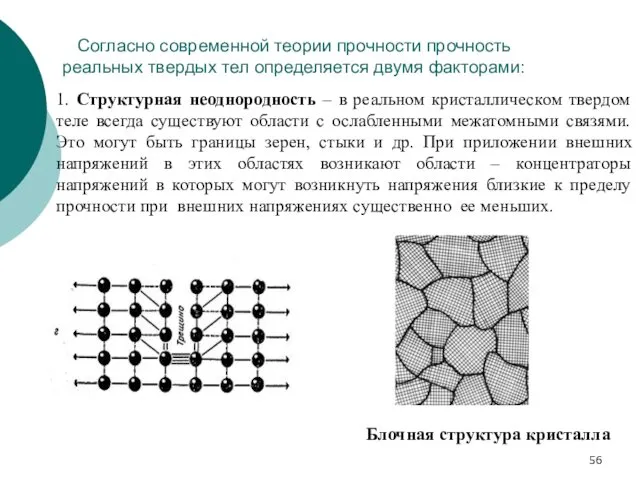
- 56. Согласно современной теории прочности прочность реальных твердых тел определяется двумя факторами: 1. Структурная неоднородность – в
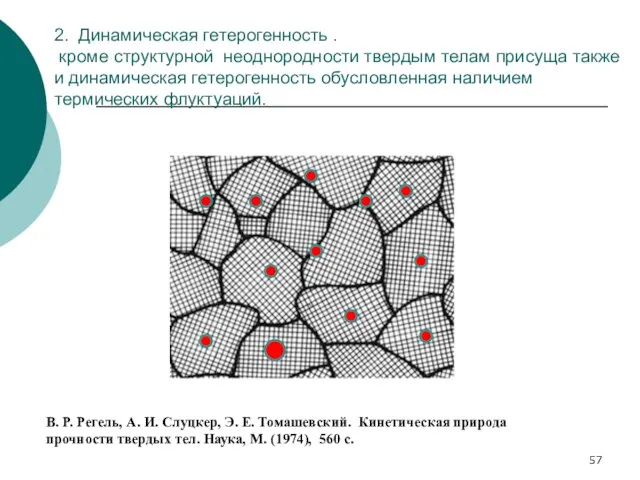
- 57. 2. Динамическая гетерогенность . кроме структурной неоднородности твердым телам присуща также и динамическая гетерогенность обусловленная наличием
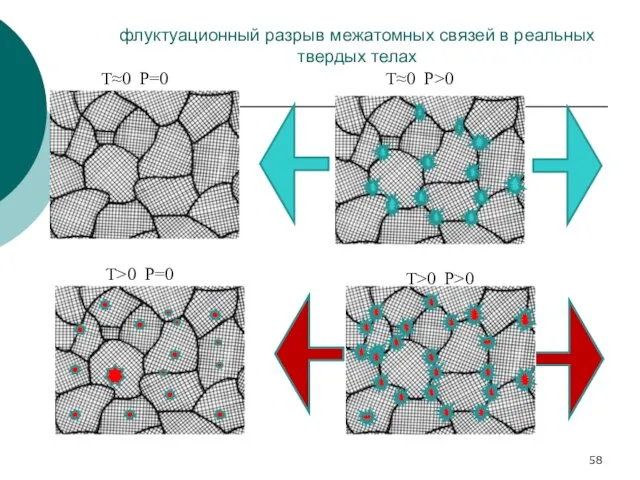
- 58. флуктуационный разрыв межатомных связей в реальных твердых телах Т≈0 Р=0 Т>0 Р=0 Т>0 Р>0 Т≈0 Р>0
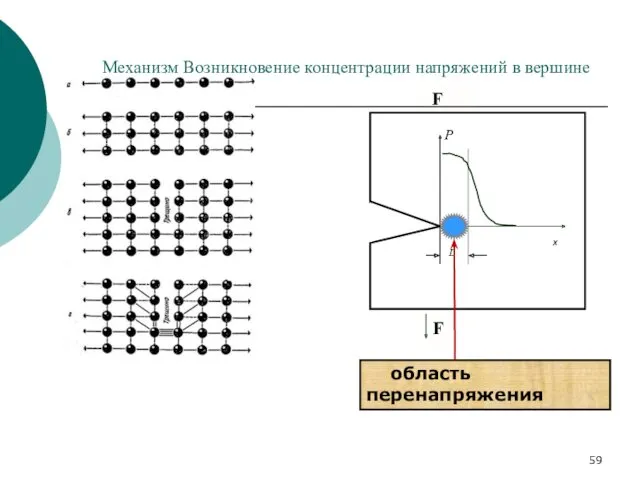
- 59. Механизм Возникновение концентрации напряжений в вершине трещины. область перенапряжения
- 60. Дефекты решетки Искажения кристаллической решетки в твердых растворах замещения: а – атом растворенного компонента больше атома
- 62. Скачать презентацию



























 Процессы проявления и фиксирования
Процессы проявления и фиксирования Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Валентность химических элементов
Валентность химических элементов Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Атомы, молекулы и ионы
Атомы, молекулы и ионы Химия нефти и газа
Химия нефти и газа Кислород
Кислород Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Поліметилметакрилат
Поліметилметакрилат Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Хімія у побуті
Хімія у побуті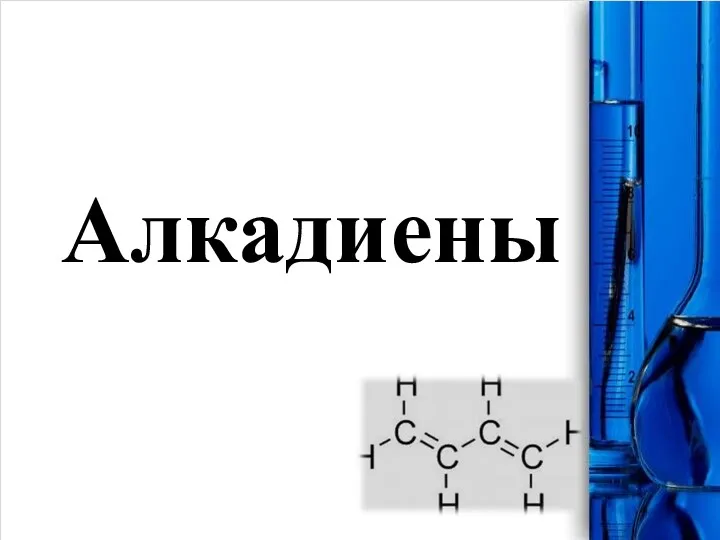 Алкадиены
Алкадиены Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё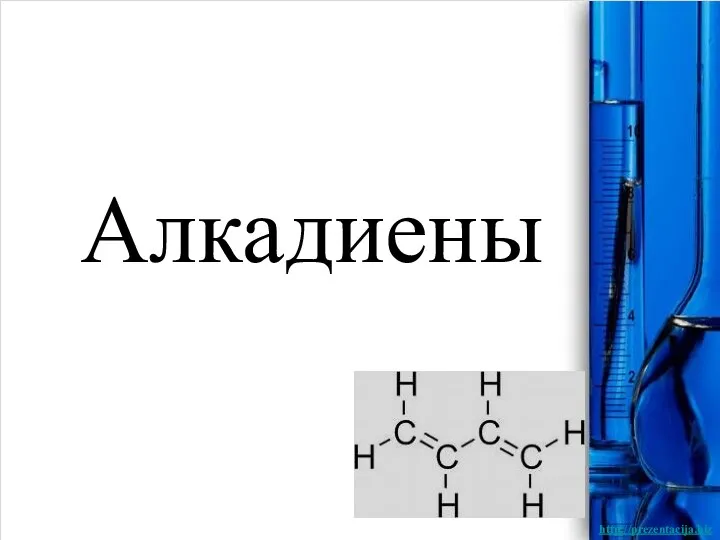 Алкадиены
Алкадиены Закон сохранения массы веществ
Закон сохранения массы веществ Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Vitaminele
Vitaminele Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1