Содержание
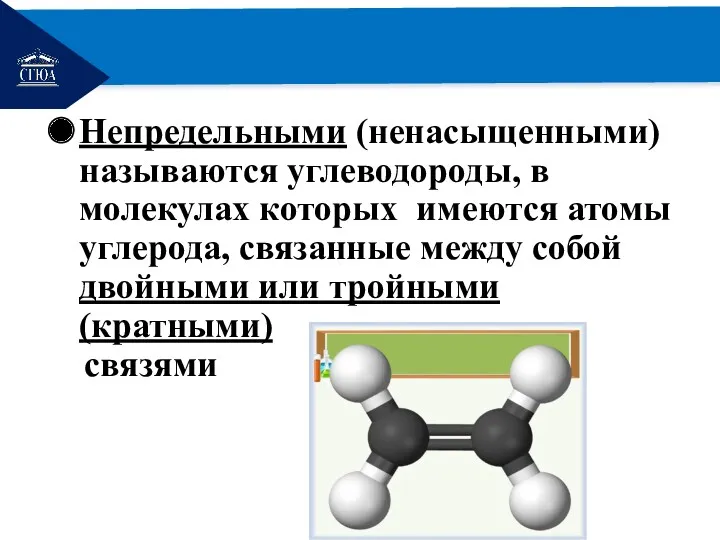
- 2. РЕМОНТ Непредельными (ненасыщенными) называются углеводороды, в молекулах которых имеются атомы углерода, связанные между собой двойными или
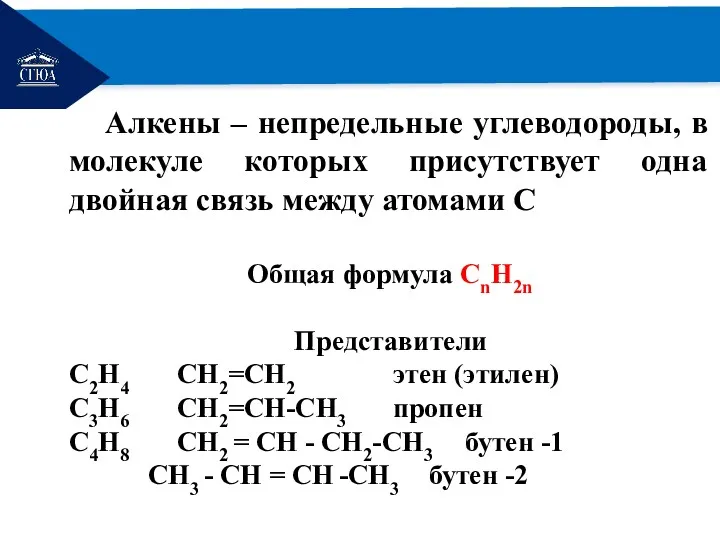
- 3. РЕМОНТ Алкены – непредельные углеводороды, в молекуле которых присутствует одна двойная связь между атомами C Общая
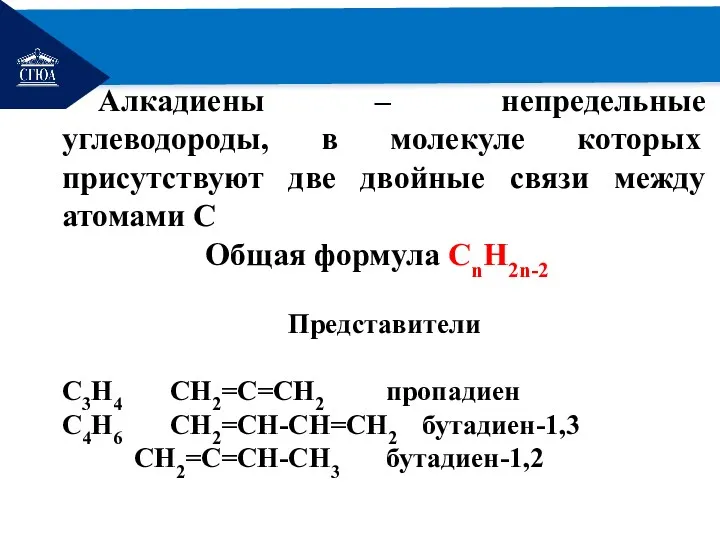
- 4. РЕМОНТ Алкадиены – непредельные углеводороды, в молекуле которых присутствуют две двойные связи между атомами C Общая
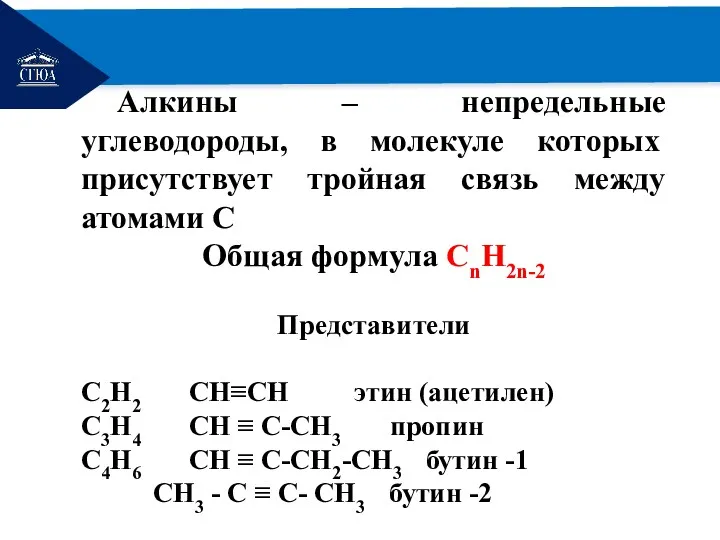
- 5. РЕМОНТ Алкины – непредельные углеводороды, в молекуле которых присутствует тройная связь между атомами C Общая формула
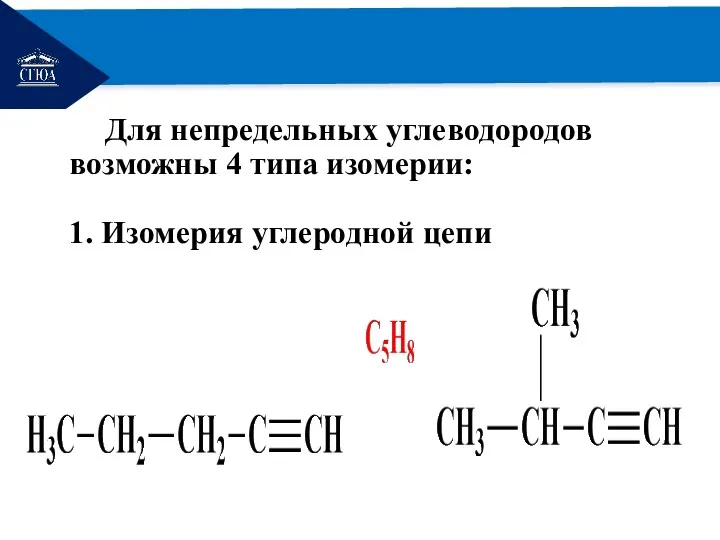
- 6. РЕМОНТ Для непредельных углеводородов возможны 4 типа изомерии: 1. Изомерия углеродной цепи
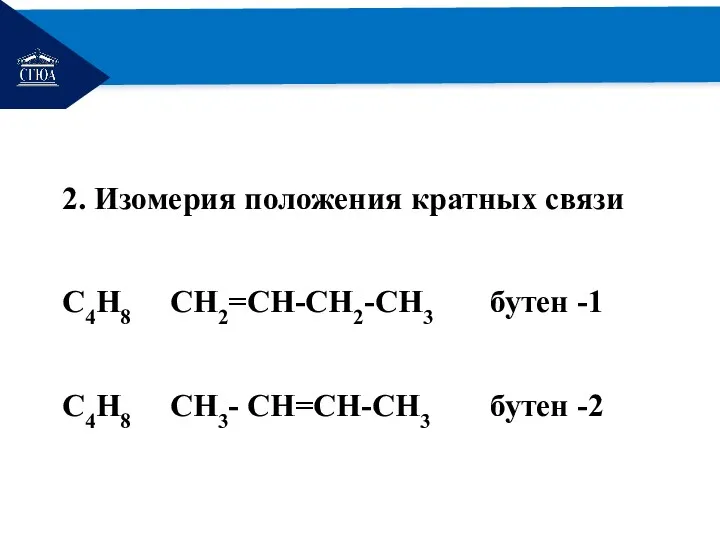
- 7. РЕМОНТ 2. Изомерия положения кратных связи С4H8 СH2=СH-СH2-СH3 бутен -1 С4H8 СH3- СH=СH-СH3 бутен -2
- 8. РЕМОНТ 3. Межклассовая изомерия С4H6 СH2=СH-СH = СH2 бутадиен -1,3 С4H6 СH ≡ С -СH2-СH3 бутин
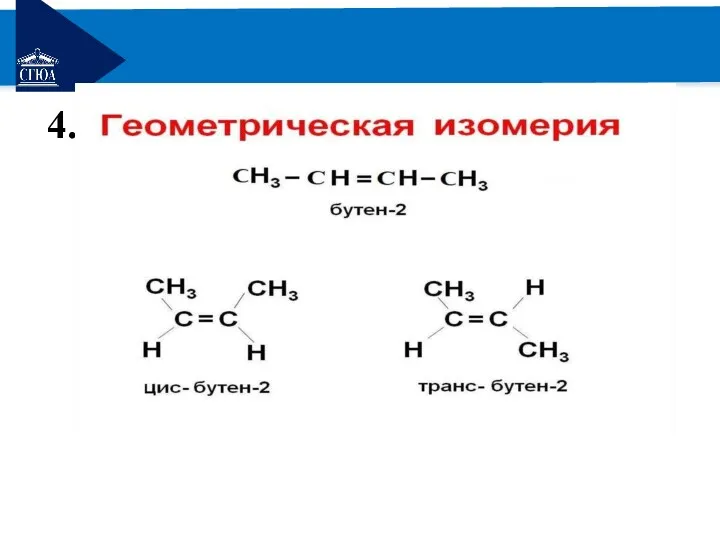
- 9. РЕМОНТ 4.
- 10. РЕМОНТ Номенклатура непредельных углеводородов 1. Выбираем цепь, включающую кратные связи. 2. Нумеруем с того конца, к
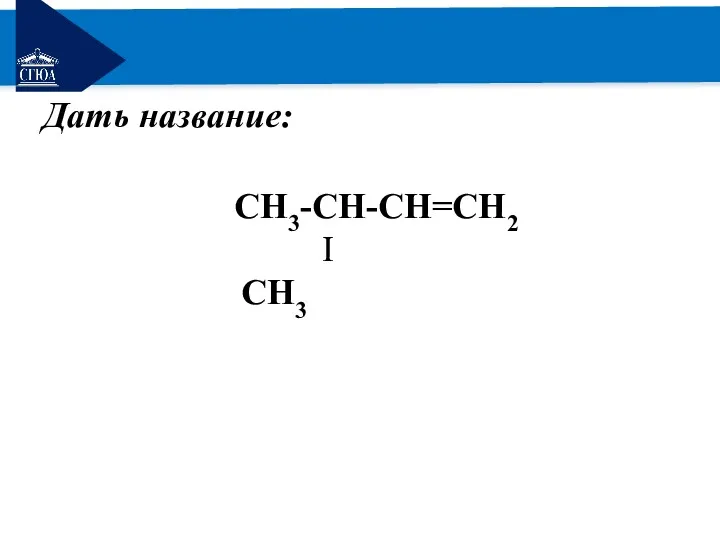
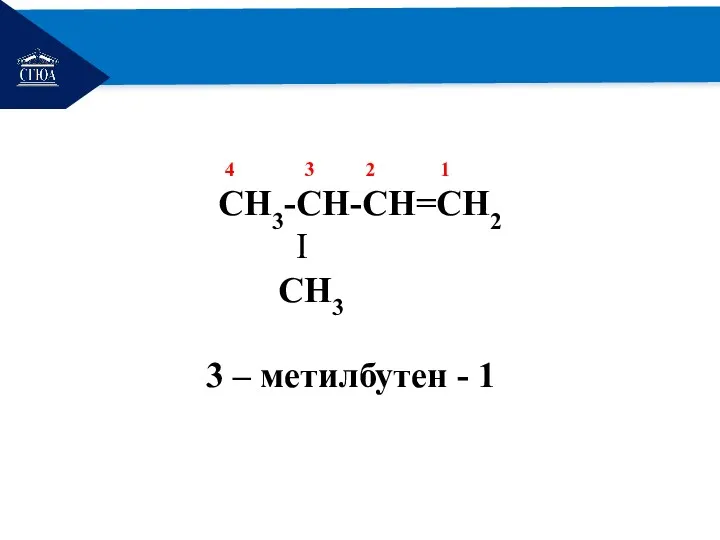
- 11. РЕМОНТ Дать название: СH3-СH-СН=СH2 Ι СH3
- 12. РЕМОНТ 4 3 2 1 СH3-СH-СН=СH2 Ι СH3 3 – метилбутен - 1
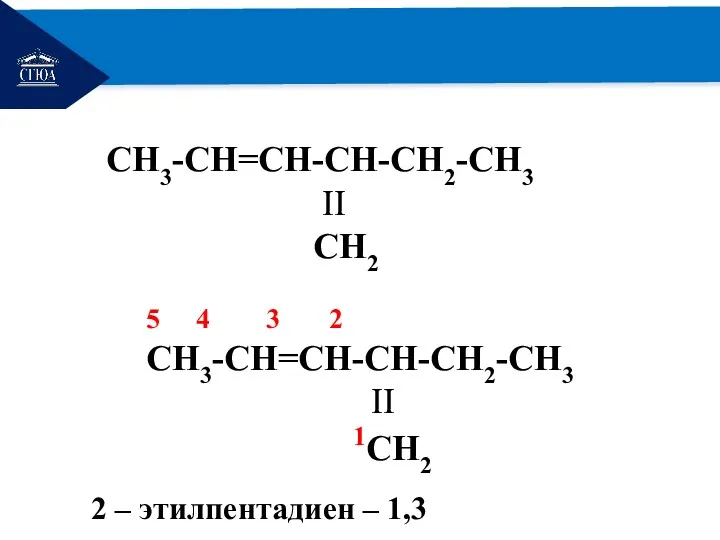
- 13. РЕМОНТ СH3-СH=СH-СH-СН2-СH3 ΙΙ СH2 5 4 3 2 СH3-СH=СH-СH-СН2-СH3 ΙΙ 1СH2 2 – этилпентадиен – 1,3
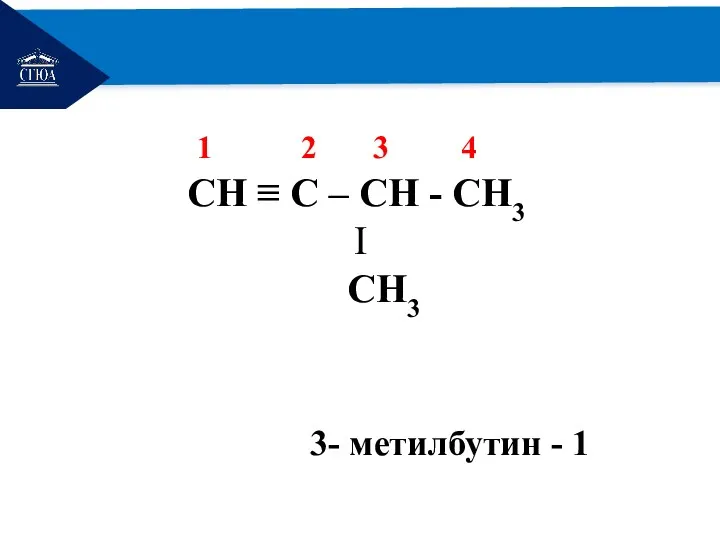
- 14. РЕМОНТ 1 2 3 4 СH ≡ С – СH - СH3 Ι СH3 3- метилбутин
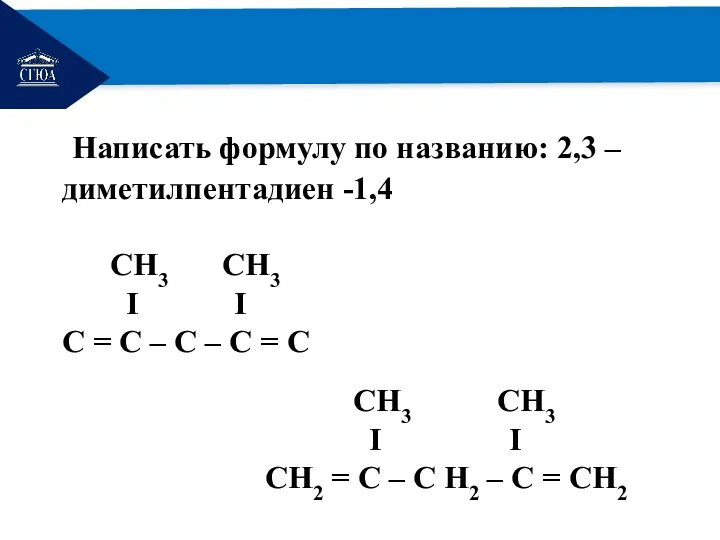
- 15. РЕМОНТ Написать формулу по названию: 2,3 – диметилпентадиен -1,4 CH3 CH3 I I С = С
- 16. РЕМОНТ Задание Написать формулу по названию: 2,4 –диметил 3- этилгексен -2
- 17. РЕМОНТ Физические свойства Низшие представители - газы, более сложные - жидкости, затем - твёрдые вещества с
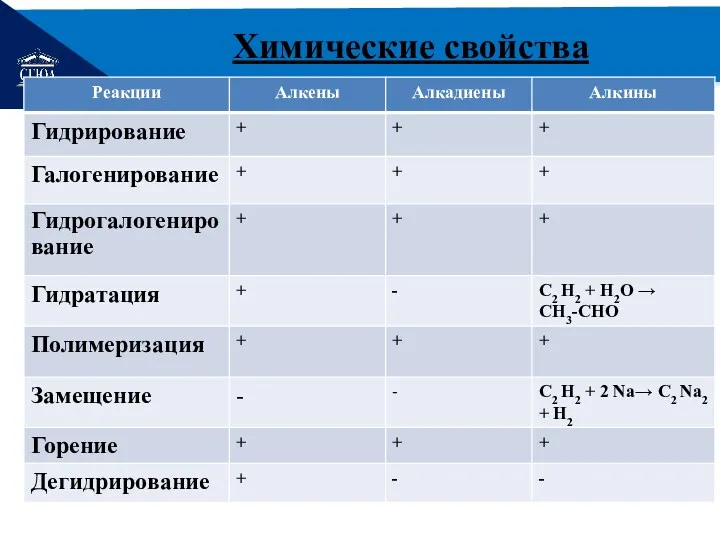
- 18. РЕМОНТ Химические свойства
- 19. РЕМОНТ Химические свойства на примере этилена
- 20. РЕМОНТ Ι. Реакции присоединения 1. Гидрирование CH2=CH2 +Н2→ CH3-CH3(кат.Ni) этилен этан 2. Галогенирование СН2=СН2 +Br2 →
- 21. РЕМОНТ 5. Полимеризация - процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с
- 22. РЕМОНТ II. Горение: С2Н4 +3О2 → 2СО2 +2Н2О III. Дегидрирование ( t, p) CH2=CH2 → CH≡CH
- 23. РЕМОНТ Качественная реакция на непредельные углеводороды: обесцвечивание бромной воды и раствора перманганата калия. С помощью этой
- 24. РЕМОНТ Получение алкенов: 1)Крекинг нефтепродуктов 2) Каталитическое дегидрирование алканов 3) Каталитическое гидрирование алкинов 4) Дегидратация спиртов
- 25. РЕМОНТ Получение алкадиенов: 1)Каталитическое дегидрирование алканов и алкенов 2) Способ Лебедева (дегидрирование и дегидратация) 2С2Н5ОН →СН2=СН-СН=СН2+2Н2О+Н2
- 26. РЕМОНТ Получение алкинов 1. Пиролиз метана – способ Бертло 2СН4 →С2Н2 + 3Н2 метан этин 2.
- 27. РЕМОНТ Применение алкенов Производство пластмасс. В качестве моторного топлива Растворители В с/х для обеззараживания зернохранилищ. Производство
- 28. РЕМОНТ Применение алкадиенов В промышленности диены используют для получения синтетического каучука. Терпены обладают приятным запахом используются
- 29. РЕМОНТ Применение алкинов Ацетилен - сварка и резка металлов Растворители Производство поливинилхлорида (кожзаменитель и т.п) Получение
- 30. РЕМОНТ Выполнить реакции цепочки превращений: CaC2→C2H2 → C2H4 → C2H5ОН → C4H6 ↓ C2H5Cl →C4H10 Назвать
- 32. Скачать презентацию
















 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)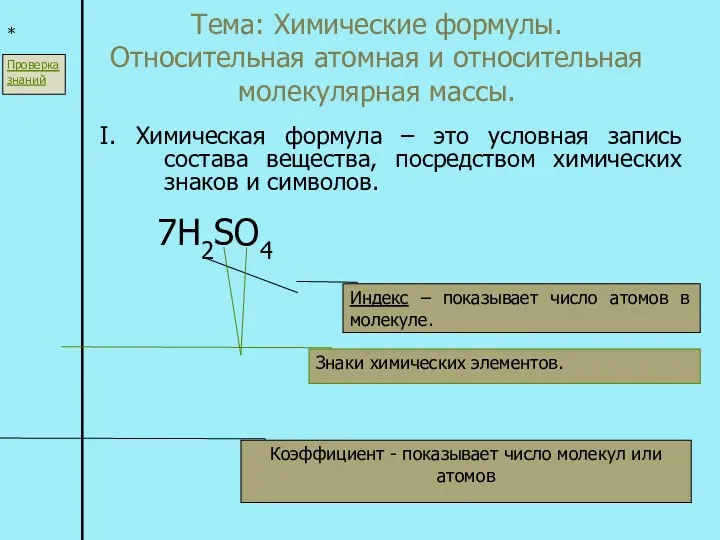 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны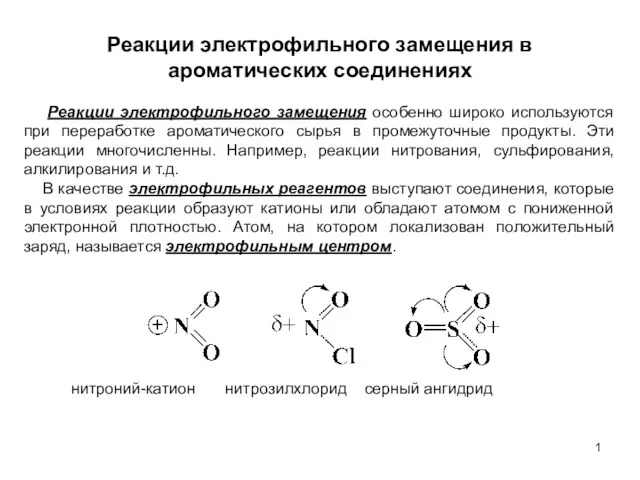 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования