Содержание
- 2. 4. В земной коре его 49% по массе, в гидросфере – 89% по массе. 5. В
- 3. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar =
- 4. Кислород в природе Атмосфера – 21 % Гидросфера – 89% Земная кора – 49% Живые организмы
- 5. У кислорода интересная история открытия. Он,можно сказать был открыт трижды. Задержке его открытия способствовали свойства кислорода,
- 6. Ученые предполагали о существовании данного вещества.Интересным фактом является то, что впервые кислород выделили не химики. Это
- 7. Открыт же был кислород практически одновременно, независимо друг от друга, великими химиками XVIII века шведом Карлом
- 8. Главной же фигурой в открытии кислорода является великий фраццузский химик Антуан Лоран Лавуазье.
- 9. Джозеф Пристли Карл Вильгельм Шееле
- 10. Антуан Лоран Лавуазье
- 11. Получение кислорода в лаборатории
- 12. перманганата калия при нагревании: 2KMnO4 –t°→ K2MnO4 + MnO2 + O2↑ Разложение этой соли идёт при
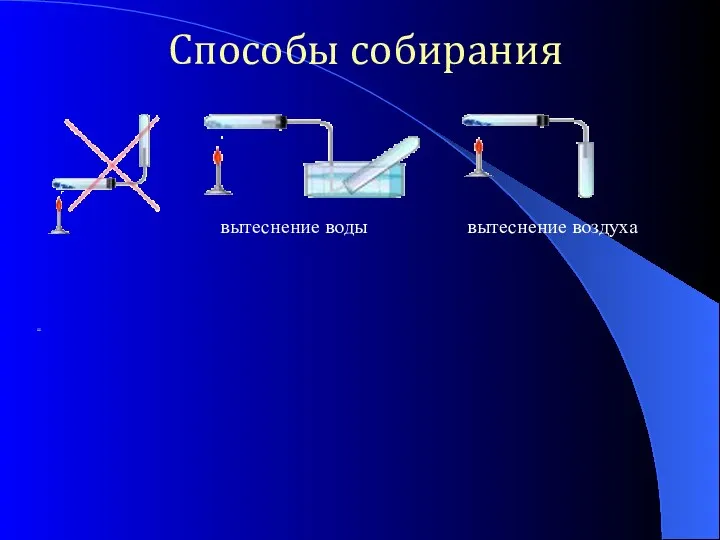
- 13. Способы собирания вытеснение воды вытеснение воздуха =
- 14. Химические свойства
- 15. Применение кислорода:
- 16. Но главными потребителями кислорода являются энергетика, металлургия и химическая промышленность
- 17. В машиностроении, в строительстве кислород используют для сварки и резки металлов.
- 18. Знаете ли вы, что… За сутки здоровый человек в спокойном состоянии прокачивает через легкие 7200л воздуха,
- 19. Упрощенно фотосинтез можно изобразить уравнением: 6CO2 + 6H2O + 2920 кДж свет C6H12O6 + 6O2
- 21. Скачать презентацию

















 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)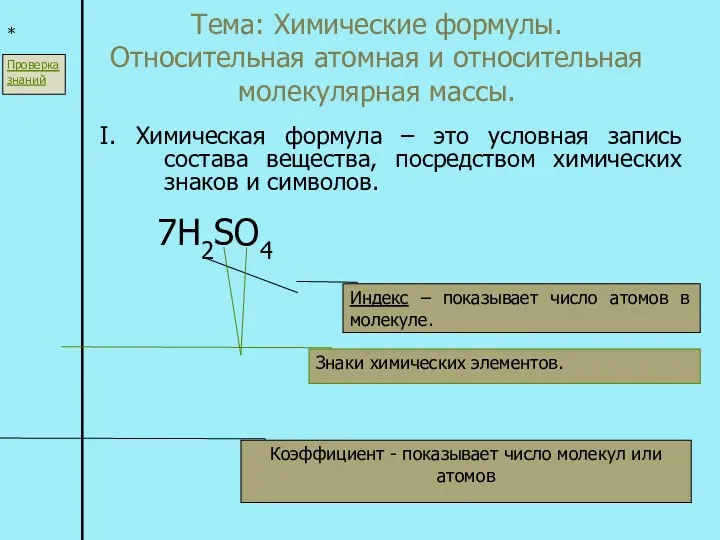 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны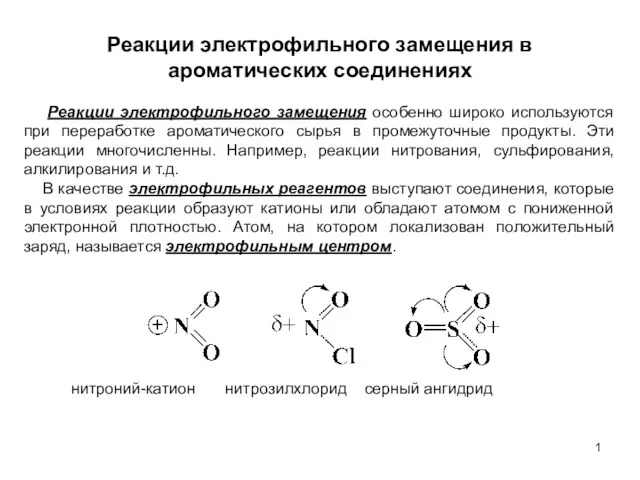 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования