Слайд 2
Цель урока:
Обобщить, систематизировать, развить знания о строении металлов, свойствах металлов и
их важнейших соединений, рассмотреть их взаимообусловленность
Слайд 3

Третий лишний
Щелочные металлы
Ca
Na
Li
Слайд 4

Третий лишний
Щелочноземельные металлы
Ва
Ra
К
Слайд 5

Мои соседи
Be
Na Mg Al
Ca
Слайд 6
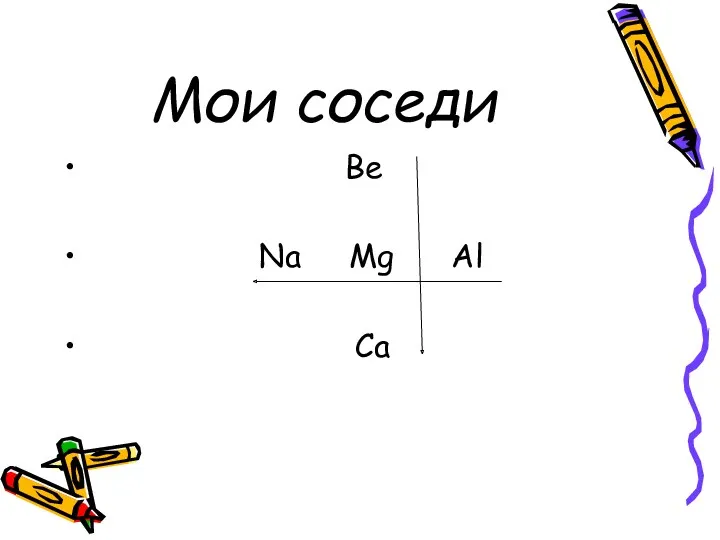
Мои соседи
Be
Na Mg Al
Ca
Слайд 7

Слайд 8
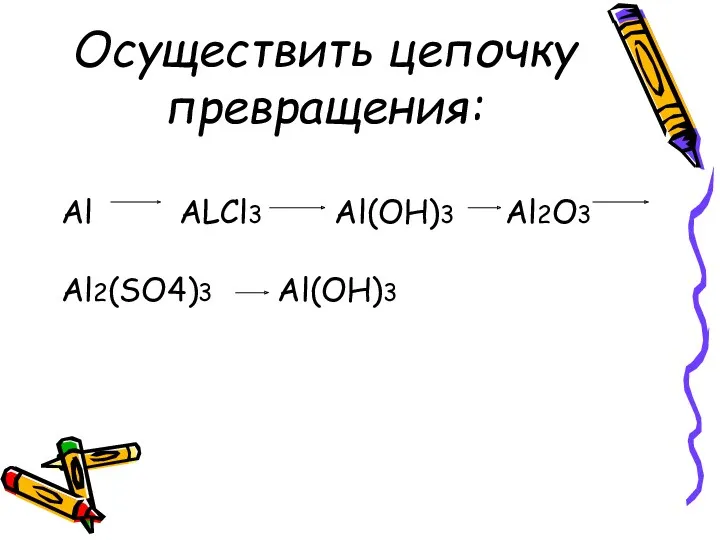
Осуществить цепочку превращения:
Al ALCl3 Al(OH)3 Al2O3
Al2(SO4)3 Al(OH)3
Слайд 9

Проверка:
2Al + 6HCl 2AlCl3 + 3H2
AlCl3 + 3NaOH 3NaCl + Al(OH)3
2Al(OH)3
Al2O3 + 3H2O
Al2O3 +3H2SO4 Al2(SO4)3 + 3H2O
Al2(SO4)3 + 6NaOH 2Al(OH)3 + 3Na2SO4
Слайд 10

План изучения нового материала:
1. Строение атома
2. Нахождение железа в природе
3. Физические
свойства железа
4. Химические свойства железа
Слайд 11

1. Строение атома железа:
Fe + 26 2)8)14)2
Степени окисления:
0 Fe
+2 FeО
+3
Fe2О3
Слайд 12

Слайд 13
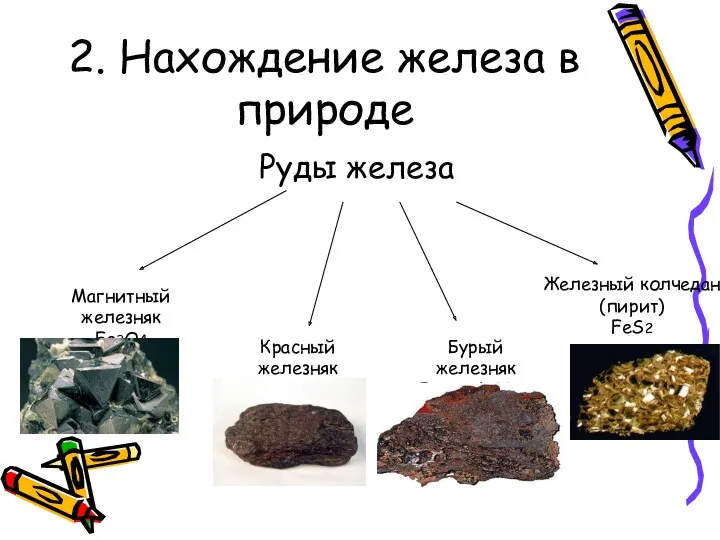
2. Нахождение железа в природе
Руды железа
Магнитный железняк
Fe3O4
Красный железняк
Fe2O3
Бурый железняк
Fe2O3 *nH2O
Железный колчедан
(пирит)
FeS2
Слайд 14

3. Физические свойства железа
1. Серебристо-белый блестящий металл
2. Температура плавления 1538ºС
3. Пластичность
7,87 г/см3
4. Пластичный (куется, прокатывается, штампуется)
5. Намагничивается и размагничивается
Слайд 15

4. Химические свойства железа
1. Взаимодействие с простыми веществами
Опыт 1 Горение железа
3Fe + 2O2 Fe3O4
(железная окалина)
Слайд 16

4. Химические свойства железа
1. Взаимодействие с простыми веществами
Опыт 2 Взаимодействие железа
с серой
Fe + S FeS
(сульфид железа II)
Слайд 17

4. Химические свойства железа
2. Взаимодействие со сложными веществами
Опыт 3 Взаимодействие
железа с соляной кислотой
Fe + 2HCl FeCl2 + H2
(хлорид железа II)
Слайд 18

4. Химические свойства железа
2. Взаимодействие со сложными веществами
Опыт 4 Взаимодействие железа
с солями
Fe + CuSO4 Cu + FeSO4
(сульфат железа II)
Слайд 19

4. Химические свойства железа
2. Взаимодействие со сложными веществами
Ржавление железа
4Fe +
6H2O + 3O2 4Fe(OH)3
(ржавчина)
Слайд 20

Закрепление
Найди ошибку в рассуждении незадачливого химика?
Слайд 21

Закрепление
В результате какого взаимодействия получится сульфат железа (II)?
SO2 + Fe(OH)2
Fe +
ZnSO4
FeO + H2SO4
Fe2O3 + H2SO4
Слайд 22

Закрепление
Найди ошибку
В каких уравнениях реакции коэффициенты расставлены верно?
3CO + Fe2O3 2Fe
+ 3CO2
3Fe + 3Cl2 3FeCl3
Fe2O3 + 4CO 2Fe + 3CO2
Слайд 23

Домашнее задание:
«5» Почему не допустимо одновременное введение в внутрь больному сульфата
железа (II) и нитрита натрия, учитывая, что среда в желудке кислая? Рассмотреть данную реакцию как окислительно-восстановительную
FeSO4 + NaNO2 + H2SO4
Fe2(SO4)3 + Na2SO4 + NO + H2O
Слайд 24

Домашнее задание:
«4» В настоящее время всем известно о содержании железа в
составе гемоглобина крови человека. Но в XIX веке открытие этого факта французским ученым Мери стало сенсацией, вызвало небывалый интерес общественности и стало причиной трагических случаев. Один студент-химик решил подарить своей возлюбленной кольцо, сделанное из железа собственной крови. Выпуская время от времени кровь, он получал соединение, из которого химическим путем выделял железо. Однако юноша погиб, так и не собрав нужного для изготовления кольца количества железа. Что стало причиной смерти юного возлюбленного?
Слайд 25

Домашнее задание:
«3» К раствору, содержащему 16 грамм сульфата меди (II), прибавили
12 грамм железных опилок. Какая масса меди выделится при этом?
Слайд 26
2. Нахождение железа в природе

























 Шкідливі хімічні речовини, забруднювачі атмосфери
Шкідливі хімічні речовини, забруднювачі атмосфери Свойства идеального газа на примере воздуха
Свойства идеального газа на примере воздуха Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды Methods for processing of liquid waste
Methods for processing of liquid waste Оксиды серы. Сернистая кислота
Оксиды серы. Сернистая кислота Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Альдегиды и кетоны
Альдегиды и кетоны Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления
Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления Развитие теории восстановления металлов
Развитие теории восстановления металлов Азотная кислота
Азотная кислота Уравнения химических реакций. Алгоритм расстановки коэффициентов
Уравнения химических реакций. Алгоритм расстановки коэффициентов Альдегидтер
Альдегидтер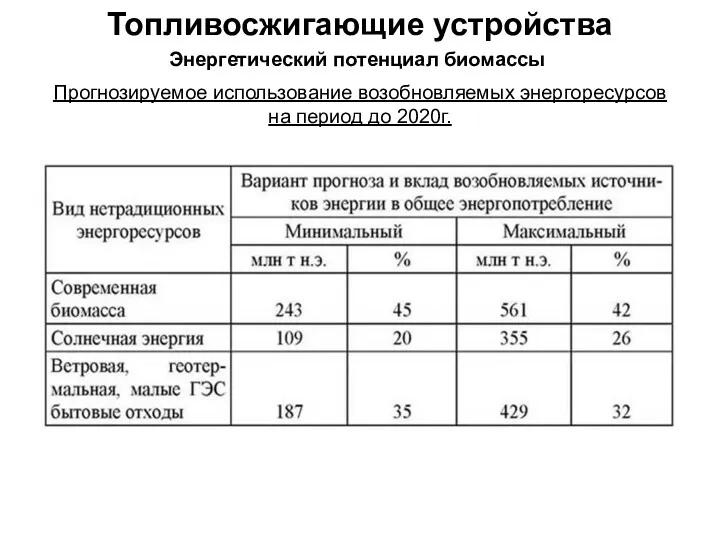 Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо
Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Энергетикалық деңгейлер
Энергетикалық деңгейлер Кислоты. 8 класс
Кислоты. 8 класс Окислительно-восстановительные реакции. Готовимся к ЕГЭ
Окислительно-восстановительные реакции. Готовимся к ЕГЭ Жёсткость воды
Жёсткость воды Физические и химические свойства алканов
Физические и химические свойства алканов Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Окислительно-восстановительные реакции. Генетический ряд кальция
Окислительно-восстановительные реакции. Генетический ряд кальция альдегиды, свойства, получение
альдегиды, свойства, получение Сера. Аллотропные модификации
Сера. Аллотропные модификации Химическая промышленность и химическая технология
Химическая промышленность и химическая технология Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування