Содержание
- 2. Физические свойства алканов tпл и t кип алканов увеличиваются с ростом молекулярной массы. Все алканы легче
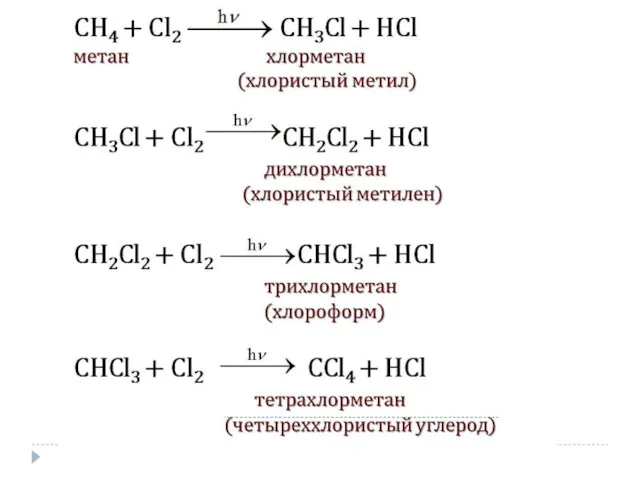
- 3. Химические свойства алканов 1. Реакции замещения SR Связи между атомами углерода – сигма (прочные ковалентные, малополярные)
- 5. Радикальные реакции имеют цепной механизм, включающий стадии: зарождение, развитие и обрыв цепи (свободнорадикальные цепные реакции) Зарождение
- 6. Семёнов Николай Николаевич Лауреат Нобелевской премии по химии за разработку теории цепных реакций.
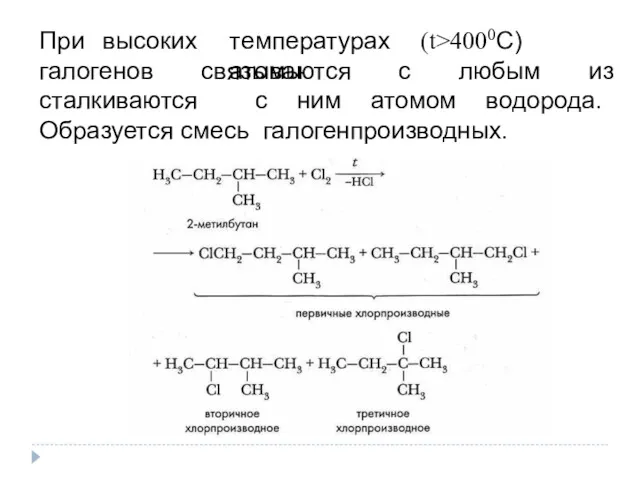
- 7. При высоких температурах (t>4000С) атомы галогенов связываются с любым из сталкиваются с ним атомом водорода. Образуется
- 8. При низких температурах галогенирование протекает избирательно. В реакциях замещения алканов легче всего замещаются атомы водорода у
- 9. 1. Реакции замещения SR б) Нитрование (реакция Коновалова) При нагревании вступают в реакцию с раствором азотной
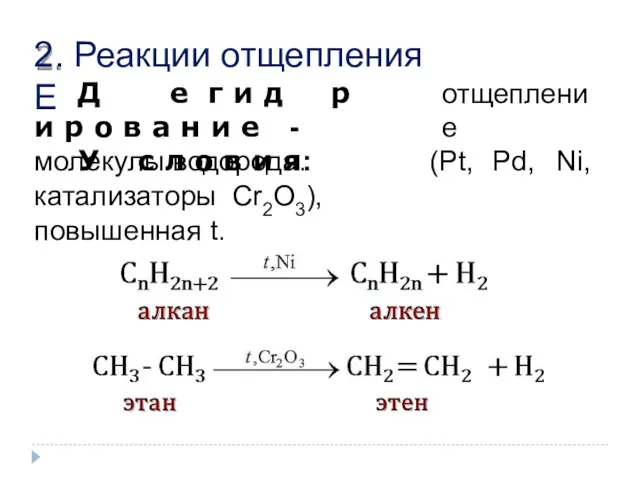
- 10. 2. Реакции отщепления Е отщепление Д е г и д р и р о в а
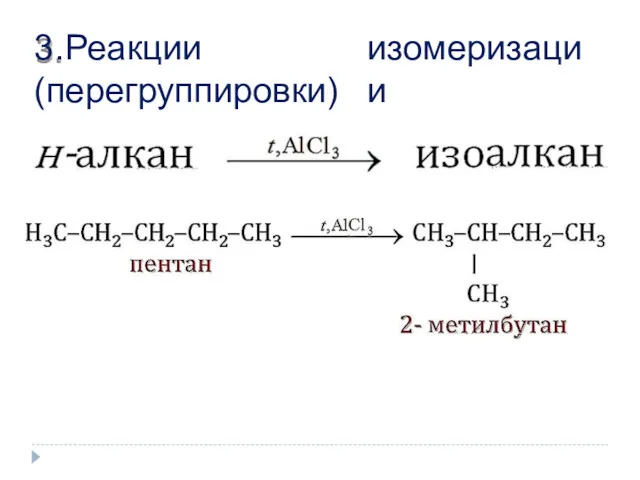
- 11. изомеризации 3. Реакции (перегруппировки)
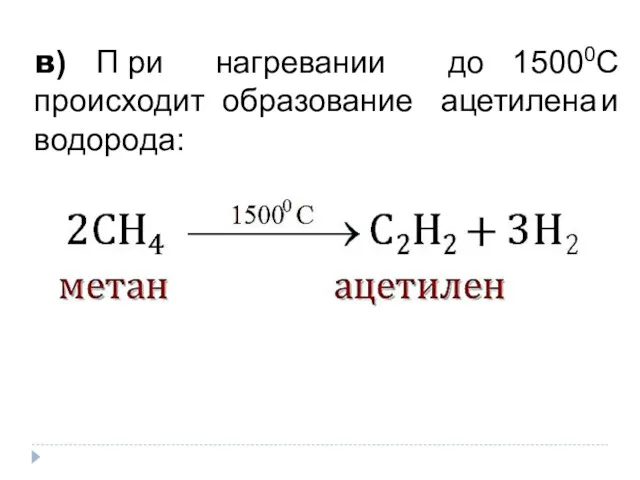
- 12. 4. Реакции разложения а) К р е к и н г - разложение алканов при высокой
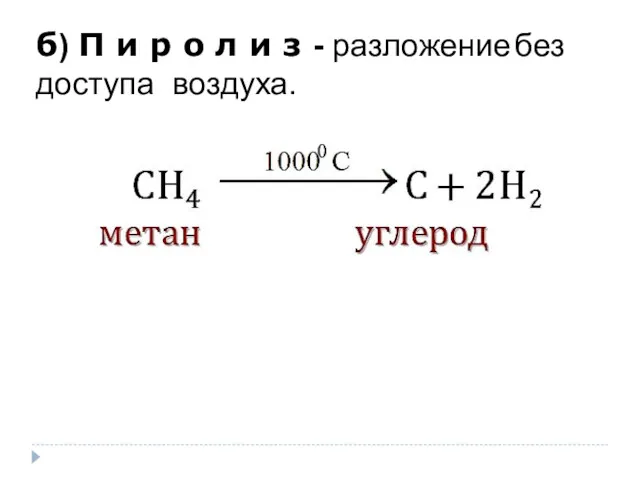
- 13. б) П и р о л и з - разложение без доступа воздуха.
- 15. г) К о н в е р с и я м е т а н а
- 16. 5. Реакции горения - при горении алканов выделяется большое количество теплоты, многие алканы используются в качестве
- 17. Помните! Смесь метана с воздухом и кислородом взрывоопасна V(CH4) : V(O2) = 1: 2 V(CH4) :
- 18. Взаимное влияние атомов в молекулах галогенпроизводных алканов I. Индуктивный эффект (I)- смещение электронной плотности по σ-связям
- 19. –I (отрицательный индуктивный эффект) - обладают атомы или группы атомов, которые смещают электронную плотность от атома
- 20. +I (положительный индуктивный эффект) - обладают атомы или группы атомов, которые смещают электронную плотность в сторону
- 22. Скачать презентацию













 Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Аминокислоты
Аминокислоты Открытие Периодического закона
Открытие Периодического закона Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини Строение атома, изотопы
Строение атома, изотопы 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Analytical methods in modern research. Chromatography
Analytical methods in modern research. Chromatography Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Железо, его физические и химические свойства
Железо, его физические и химические свойства Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Тепловой эффект химических реакций
Тепловой эффект химических реакций Спирти. Феноли. Етери
Спирти. Феноли. Етери Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Свойства воды
Свойства воды Коллигативные свойства растворов
Коллигативные свойства растворов Валентность и степень окисления
Валентность и степень окисления Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Каталитический риформинг бензинов
Каталитический риформинг бензинов Вплив хімічних сполук на довкілля
Вплив хімічних сполук на довкілля Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Волшебница - вода
Волшебница - вода