Содержание
- 2. Закон триад В 1817 году немецкий химик Иоганн Вольфганг Доберейнер на основе сходства химической природы некоторых
- 3. «Теллуровый винт» Французский геолог и химик Александр Эмиль Бегуйе де Шанкуртуа в 1862 году предложил систематизацию
- 4. Интересно, что из его «винта» впервые выявилась аналогия между водородом и галогенами. Однако подмеченная Шанкуртуа периодическая
- 6. Закон октав 18 августа 1865 года Джон Александр Рейна Ньюлендс опубликовал таблицу элементов, назвав её «законом
- 7. 1 марта 1866 года Ньюлендс сделал доклад «Закон октав и причины химических соотношений среди атомных весов»
- 8. Таблица Лотара Мейера В 1864 году Юлиус Лотар Мейер опубликовал работу "Современные теории химии", в которой
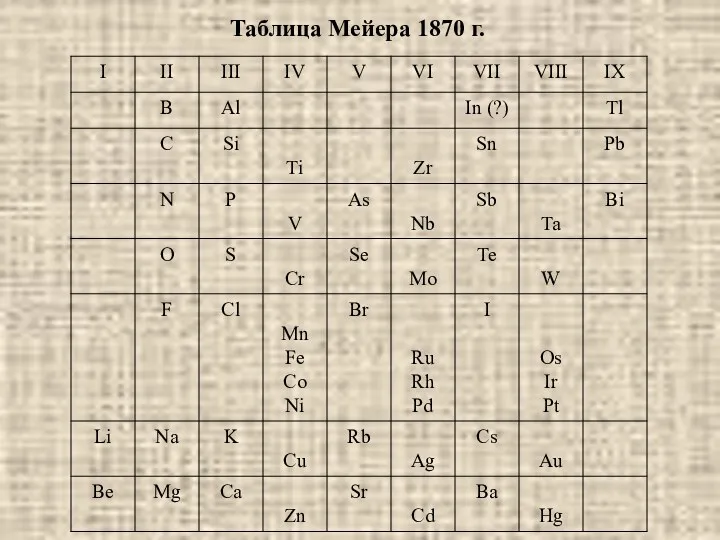
- 9. В 1870 году в "Анналах химии и фармации" появилась статья Мейера "Природа химических элементов как функция
- 10. Таблица Мейера 1870 г.
- 11. В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу, периодический закон химических
- 12. 1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств; 2. Сходные по свойствам
- 14. «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости
- 15. В конце 1870 г. Менделеев доложил РХО статью «Естественная система элементов и применение её к указанию
- 16. В 1875 году Лекок де Буабодран исследовал спектр цинковой обманки, привезенной из Пьеррфита (Пиренеи). В этом
- 17. «Я думаю, что нет необходимости настаивать на огромном значении подтверждения теоретических выводов г. Менделеева». Лекок де-Буабордан
- 18. В 1879 году шведский учёный Ларс Нильсон в одном из очень редких минералов обнаруживает новый элемент,
- 20. «Нет никакого сомнения, что в скандии открыт экабор. Так подтверждаются самым наглядным образом мысли русского химика,
- 21. В 1886 году один из профессоров Фрейбергской горной академии открыл новый минерал серебра – аргиродит. Этот
- 25. Скачать презентацию





















 Неметаллы: общая характеристика
Неметаллы: общая характеристика Строение и химические свойства кислот
Строение и химические свойства кислот Топлива и их свойства. Топлива автомобилей
Топлива и их свойства. Топлива автомобилей Общая и медицинская химия
Общая и медицинская химия Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау
Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Минеральные вещества
Минеральные вещества Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Вредные вещества
Вредные вещества Автомобильные масла. Классификация и применение автомобильных масел
Автомобильные масла. Классификация и применение автомобильных масел Оксид углерода-С
Оксид углерода-С Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс B13. Задачи на концентрацию и сплавы
B13. Задачи на концентрацию и сплавы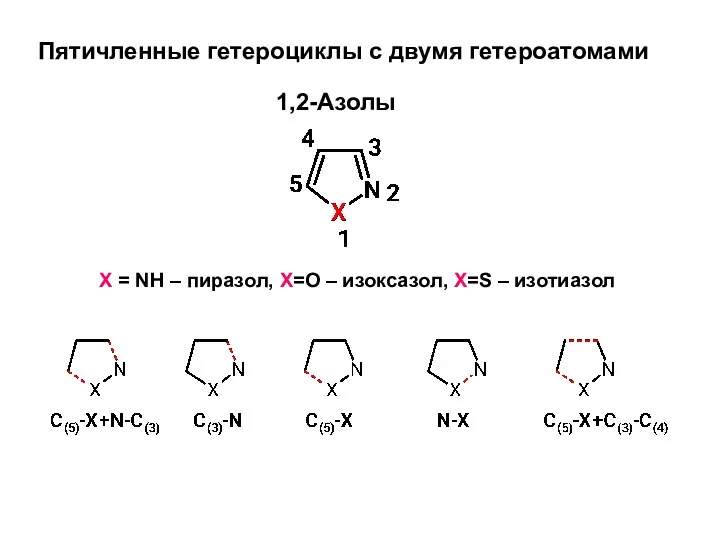 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Аминокислоты. Свойства
Аминокислоты. Свойства Камни и минералы
Камни и минералы Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи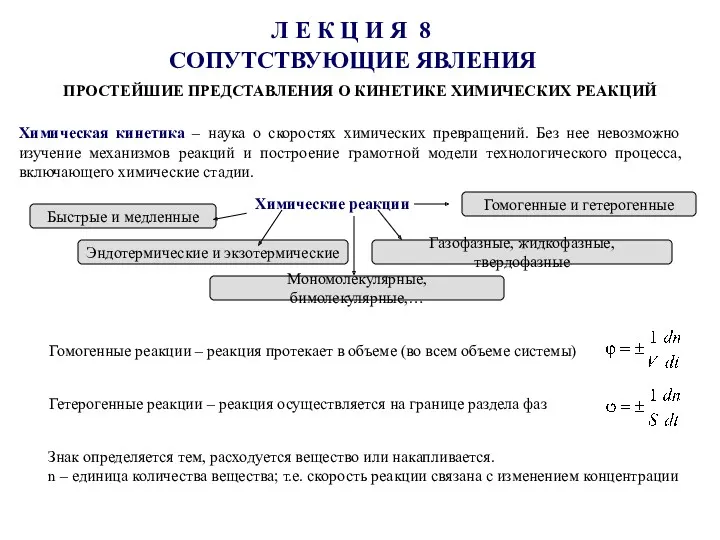 Простейшие представления о кинетике химических реакций
Простейшие представления о кинетике химических реакций Оксиды
Оксиды Электронное и пространственное строение молекул органических соединений – основа их биологической активности
Электронное и пространственное строение молекул органических соединений – основа их биологической активности Все о чае
Все о чае Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound Генетическая связь неорганических соединений (8 класс)
Генетическая связь неорганических соединений (8 класс) Типы химических реакций
Типы химических реакций Экстрагирование в химической промышленности
Экстрагирование в химической промышленности Связующие для полимерных композиционных материалов. (Тема 2)
Связующие для полимерных композиционных материалов. (Тема 2) Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Метали V групи побічної підгрупи (V, Nb, Ta)
Метали V групи побічної підгрупи (V, Nb, Ta)