Содержание
- 2. Кислоты в животном мире Тропический паук педипальпида стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты.
- 3. Кислоты в растительном мире Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито,
- 4. Аскорбиновая кислота витамин С
- 5. Кислоты в организме человека Аминокислоты в организме образуют белки. А без белков нет ни мышц и
- 6. Соляная кислота, находящаяся в желудке, помогает переваривать пищу. Молочная кислота образуется в мышцах при физической нагрузке.
- 7. Кислоты применяются в медицине. Аскорбиновая, фолиевая, липоевая, ацетил- салициловая и другие
- 8. Кислоты применяются в кулинарии. Уксусная и лимонная кислоты.
- 9. Прочитайте формулы кислот. HCl, H2SO4, H3PO4 Кислоты (HR) – это сложные вещества, состоящие из атомов водорода,
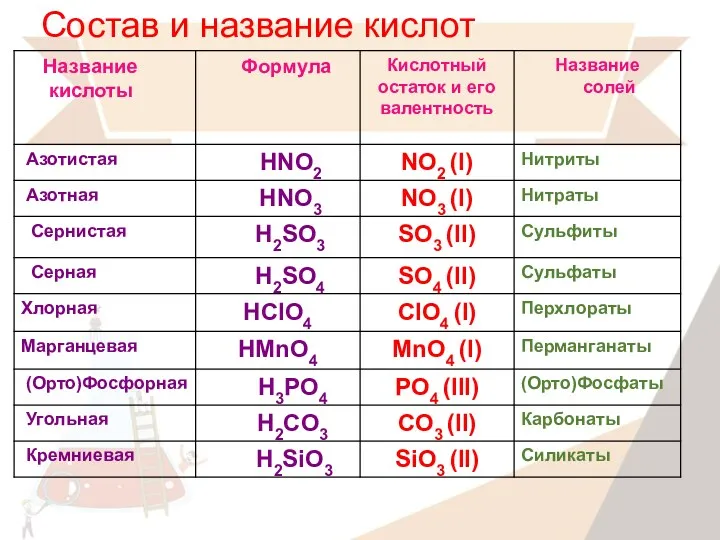
- 10. Состав и название кислот
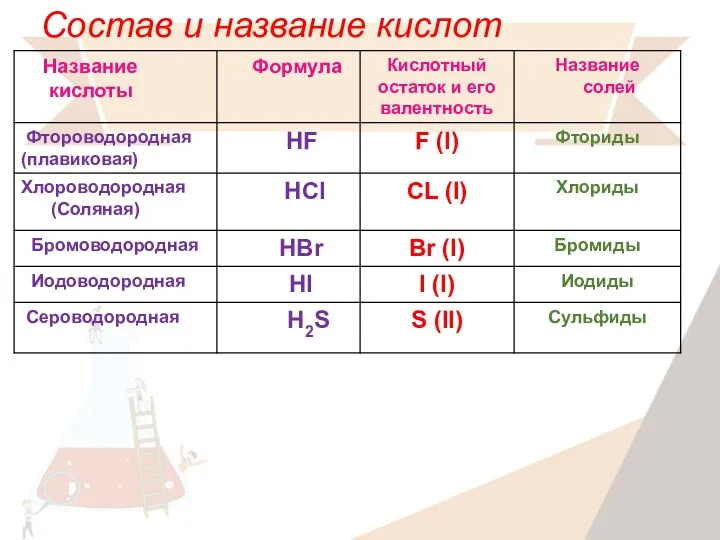
- 11. Состав и название кислот
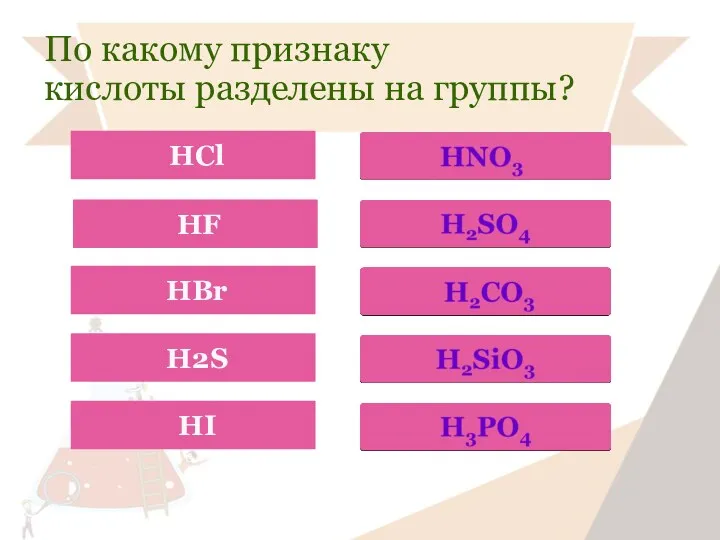
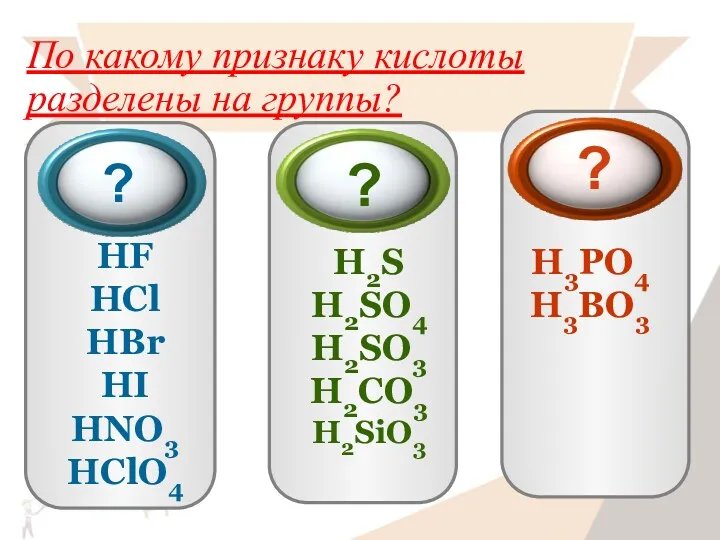
- 12. По какому признаку кислоты разделены на группы?
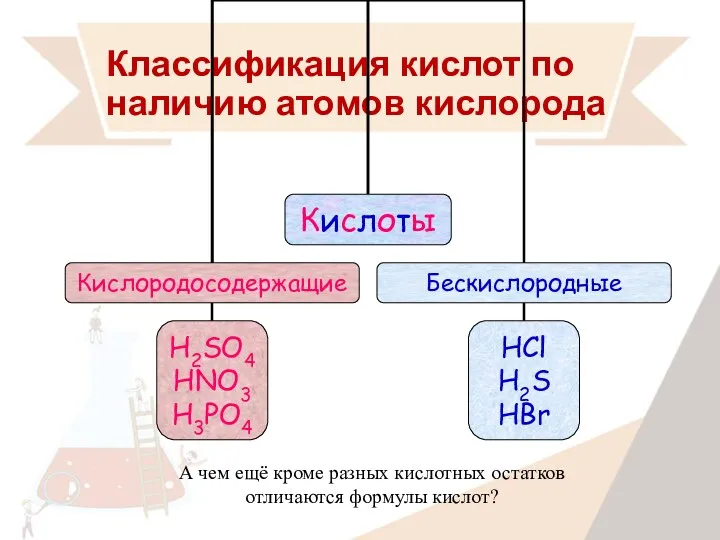
- 13. Классификация кислот по наличию атомов кислорода А чем ещё кроме разных кислотных остатков отличаются формулы кислот?
- 14. По какому признаку кислоты разделены на группы? HF HCl HBr HI HNO3 HClO4 H2S H2SO4 H2SO3
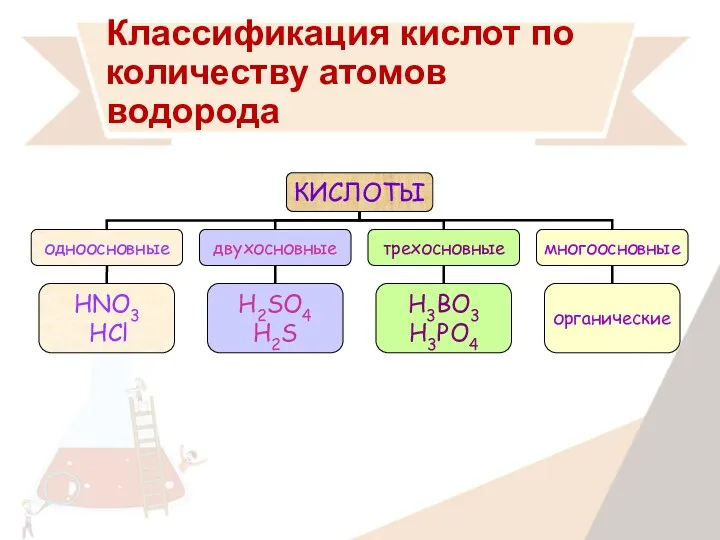
- 15. Классификация кислот по количеству атомов водорода
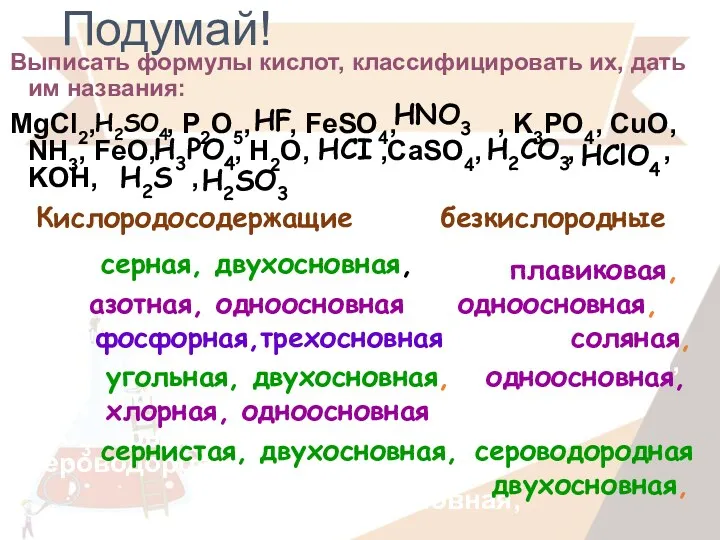
- 16. Подумай! Выписать формулы кислот, классифицировать их, дать им названия: MgCl2, , P2O5, , FeSO4, , K3PO4,
- 17. Физические свойства кислот По агрегатному состоянию: Газообразные (HCl, H2S) Жидкие (HNO3, H2SO4) Твердые (H3PO4, H2SiO3) Цвет
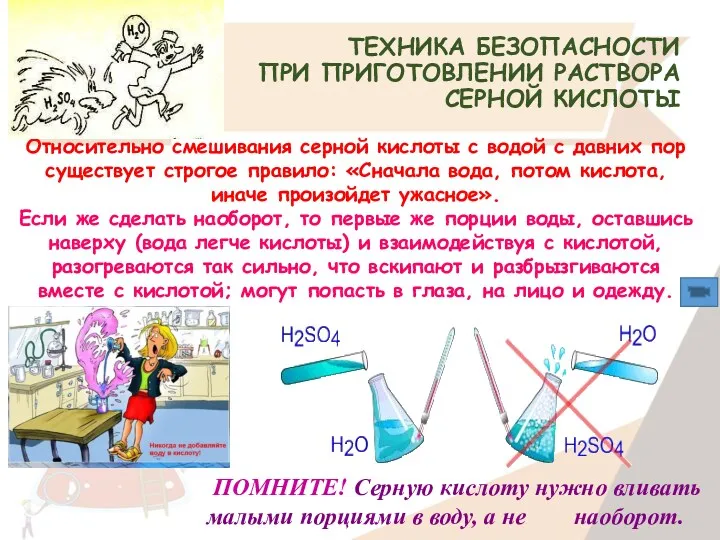
- 18. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРА СЕРНОЙ КИСЛОТЫ Относительно смешивания серной кислоты с водой с давних пор
- 19. ЕСЛИ КИСЛОТА ПОПАЛА НА КОЖУ. Пораженный участок кожи промывают сильно скользящей струей холодной воды в течение
- 20. Домашнее задание Изучить материал § 44. Выполнить задания на слайдах 21-25 и выучить таблицу на 10
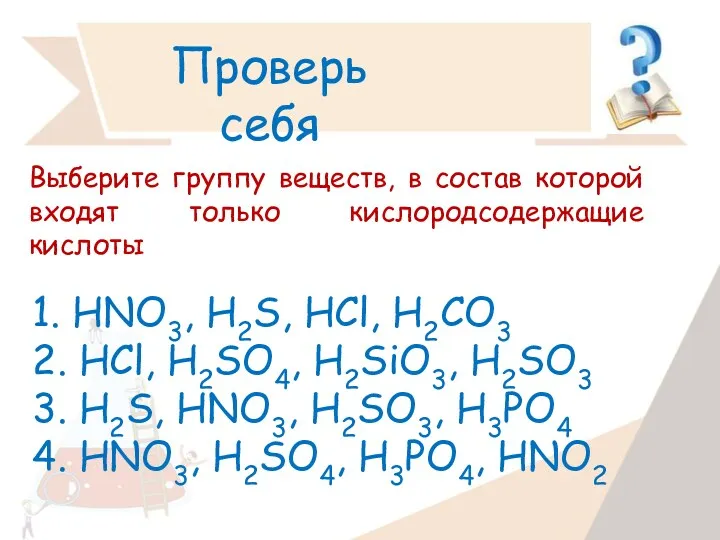
- 21. Проверь себя Выберите группу веществ, в состав которой входят только кислоты 1. HCl, SO3, NaOH,CuCl2 2.
- 22. 1. HNO3, H2S, HCl, H2CO3 2. HCl, H2SO4, H2SiO3, H2SO3 3. H2S, HNO3, H2SO3, H3PO4 4.
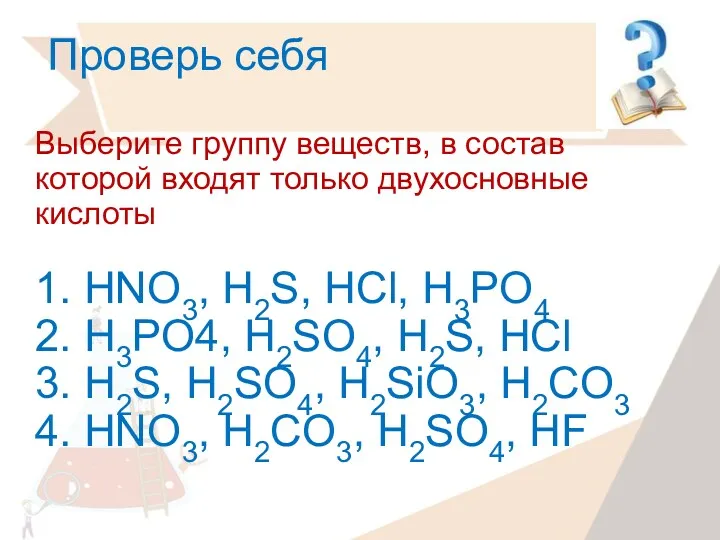
- 23. Проверь себя Выберите группу веществ, в состав которой входят только двухосновные кислоты 1. HNO3, H2S, HCl,
- 24. При разбавлении кислоты: а)Воду приливают к кислоте б)Кислоту приливают к воде в)Воду и кислоту смешивают одновременно
- 26. Скачать презентацию












 Строение и химические свойства кислот
Строение и химические свойства кислот Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Химия в пище. Пищевые добавки
Химия в пище. Пищевые добавки 1.1 Взрывчатые вещества и пороха
1.1 Взрывчатые вещества и пороха Проект: жило-было мыло
Проект: жило-было мыло Пластмассы
Пластмассы Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Alcohols. Learning Objectives
Alcohols. Learning Objectives Тепловой эффект химической реакции. Топливо. Водород. 8 класс
Тепловой эффект химической реакции. Топливо. Водород. 8 класс Азот, строение, свойства. Круговорот Азота в природе
Азот, строение, свойства. Круговорот Азота в природе Спирты
Спирты Электролиз Урок для 11 класса
Электролиз Урок для 11 класса 20230816_himiya_spirty
20230816_himiya_spirty Электронные конфигурации атомов
Электронные конфигурации атомов Электролитическая диссоциация. Степень и константа диссоциации
Электролитическая диссоциация. Степень и константа диссоциации Химия нефти и газа
Химия нефти и газа Общая характеристика неметаллов
Общая характеристика неметаллов Гетероциклічні ароматичні сполуки
Гетероциклічні ароматичні сполуки Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Добування кисню
Добування кисню Внеклассное мероприятие по химии. 9 класс
Внеклассное мероприятие по химии. 9 класс Проблемный химический эксперимент как составная часть проблемного обучения химии
Проблемный химический эксперимент как составная часть проблемного обучения химии Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Особенности дисперсных систем
Особенности дисперсных систем Происхождение, состав и свойства минералов
Происхождение, состав и свойства минералов Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Номенклатура органических соединений
Номенклатура органических соединений Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД)