Содержание
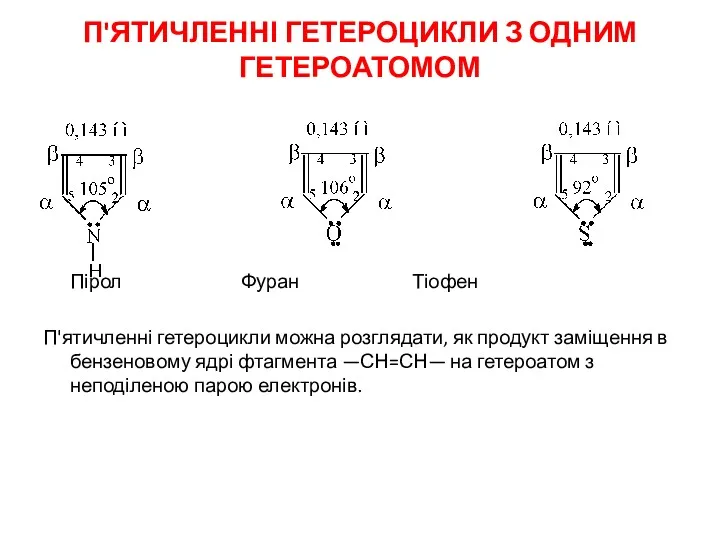
- 2. П'ЯТИЧЛЕННІ ГЕТЕРОЦИКЛИ З ОДНИМ ГЕТЕРОАТОМОМ Пірол Фуран Тіофен П'ятичленні гетероцикли можна розглядати, як продукт заміщення в
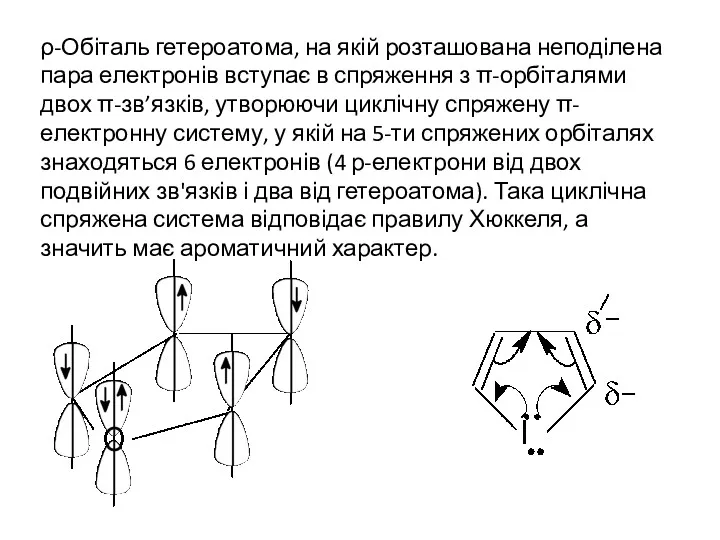
- 3. ρ-Обіталь гетероатома, на якій розташована неподілена пара електронів вступає в спряження з π-орбіталями двох π-зв’язків, утворюючи
- 4. Цікаво відмітити, що в результаті спряження електронної пари азоту пірол втрачає основні властивості, притаманні іншим амінам.
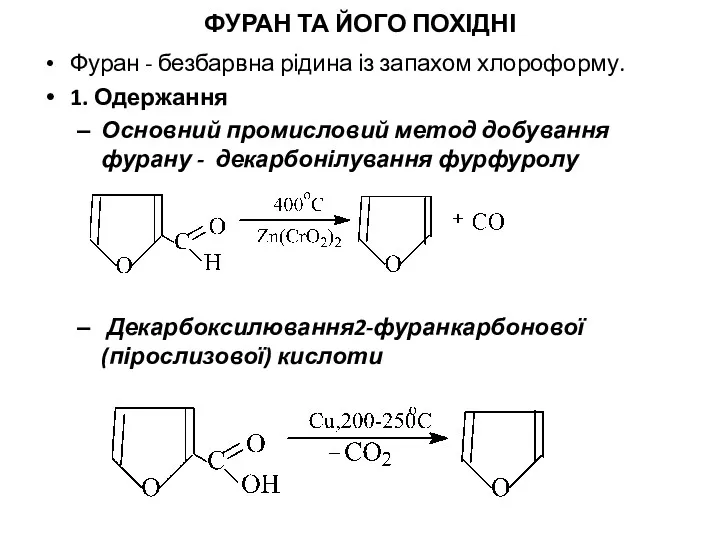
- 5. ФУРАН ТА ЙОГО ПОХІДНІ Фуран - безбарвна рідина із запахом хлороформу. 1. Одержання Основний промисловий метод
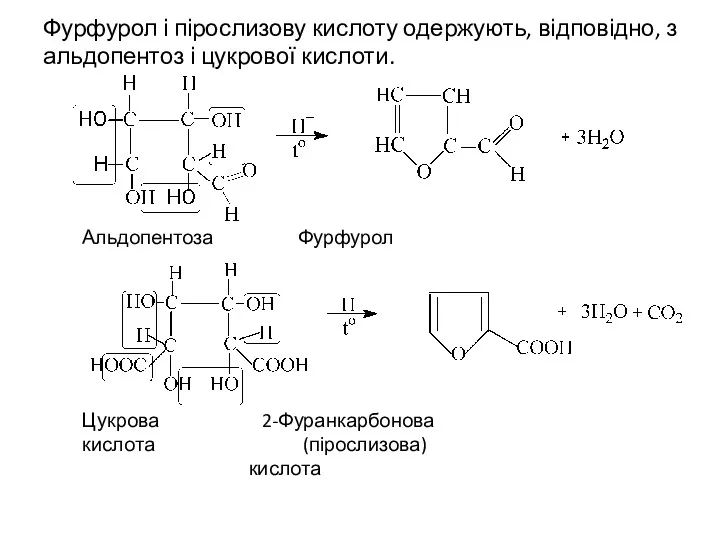
- 6. Фурфурол і пірослизову кислоту одержують, відповідно, з альдопентоз і цукрової кислоти. Альдопентоза Фурфурол Цукрова 2-Фуранкарбонова кислота
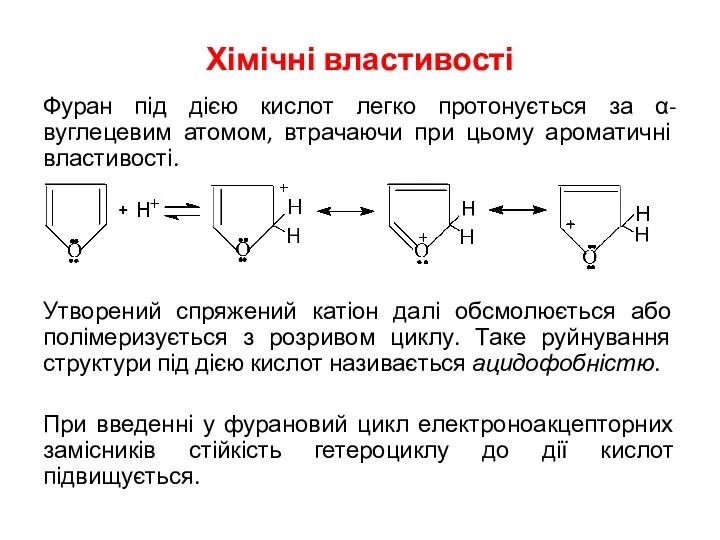
- 7. Хімічні властивості Фуран під дією кислот легко протонується за α-вуглецевим атомом, втрачаючи при цьому ароматичні властивості.
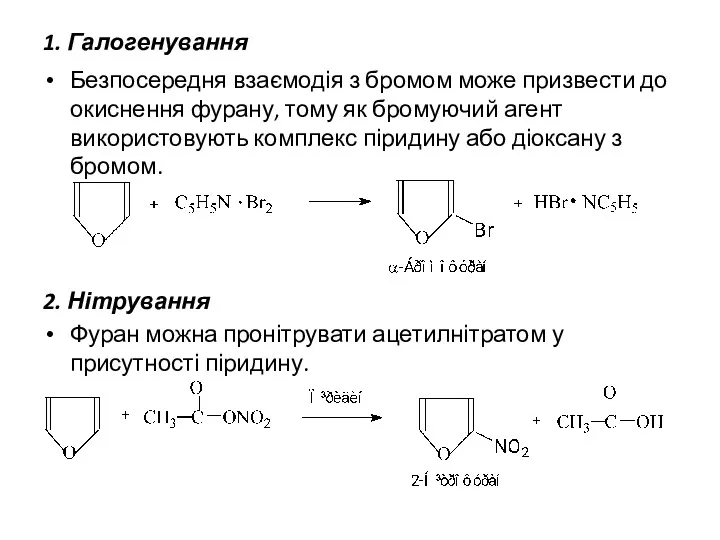
- 8. Реакції електрофільного заміщення Незважаючи на низьку стабільність фуран здатний до реакцій електрофільного заміщення (сульфування, нітрування, ацилювання,
- 9. 1. Галогенування Безпосередня взаємодія з бромом може призвести до окиснення фурану, тому як бромуючий агент використовують
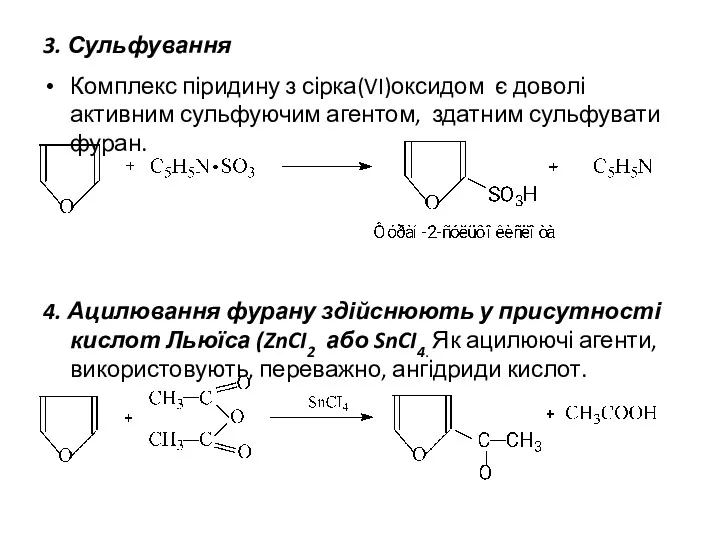
- 10. 3. Сульфування Комплекс піридину з сірка(VI)оксидом є доволі активним сульфуючим агентом, здатним сульфувати фуран. 4. Ацилювання
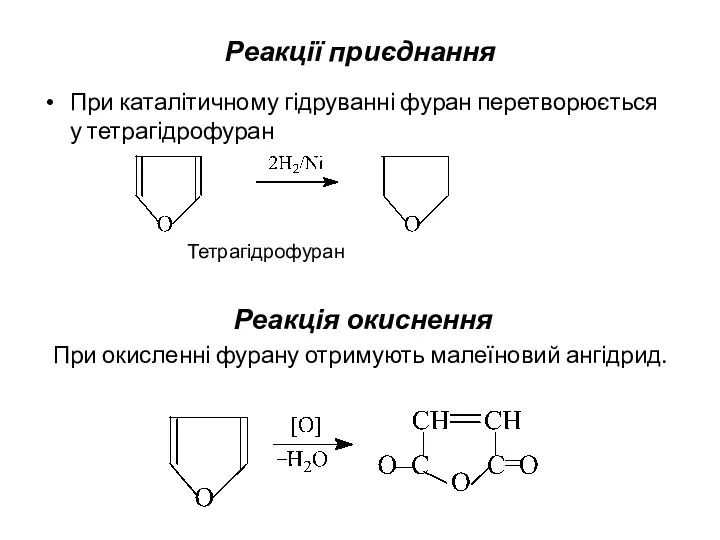
- 11. Реакції приєднання При каталітичному гідруванні фуран перетворюється у тетрагідрофуран Тетрагідрофуран Реакція окиснення При окисленні фурану отримують
- 12. ТІОФЕН ТА ЙОГО ПОХІДНІ Тіофен є найстійкішим із п'ятичленних гетероциклів. Він не має ацидофобних властивостей (не
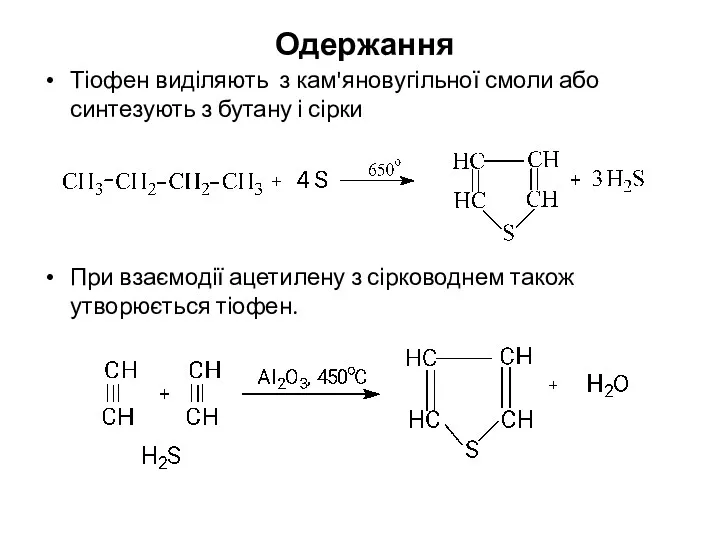
- 13. Одержання Тіофен виділяють з кам'яновугільної смоли або синтезують з бутану і сірки При взаємодії ацетилену з
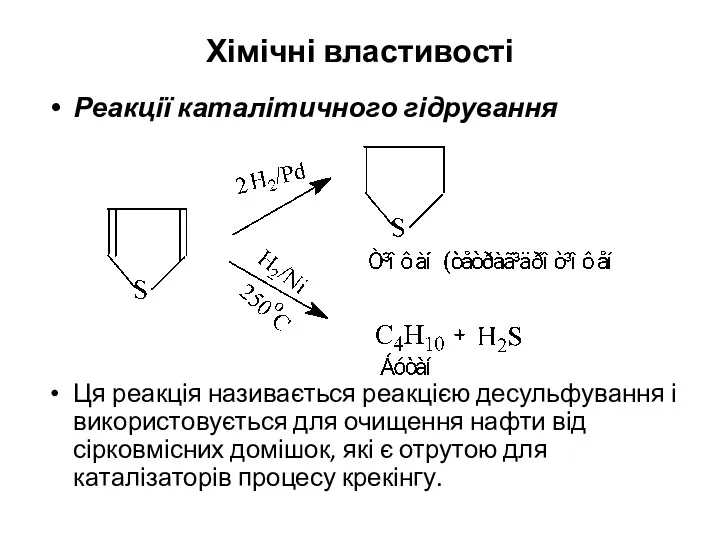
- 14. Хімічні властивості Реакції каталітичного гідрування Ця реакція називається реакцією десульфування і використовується для очищення нафти від
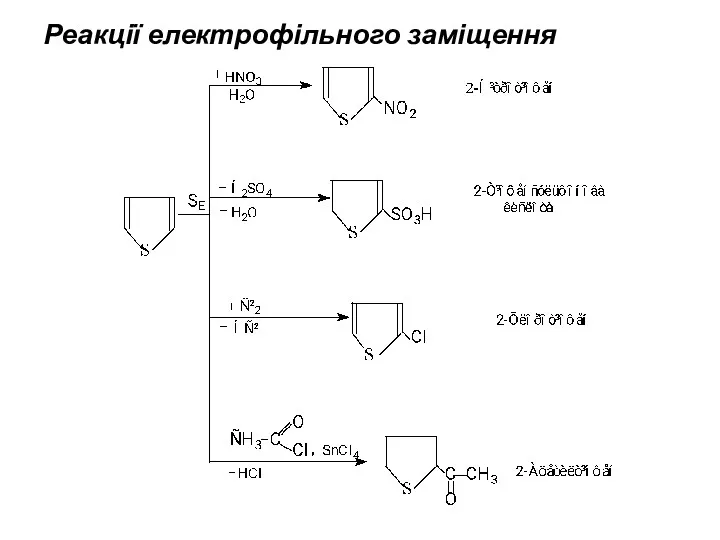
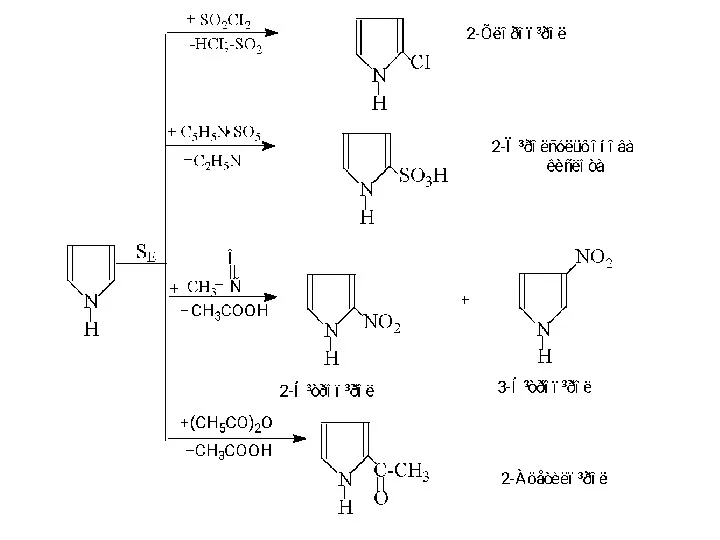
- 15. Реакції електрофільного заміщення
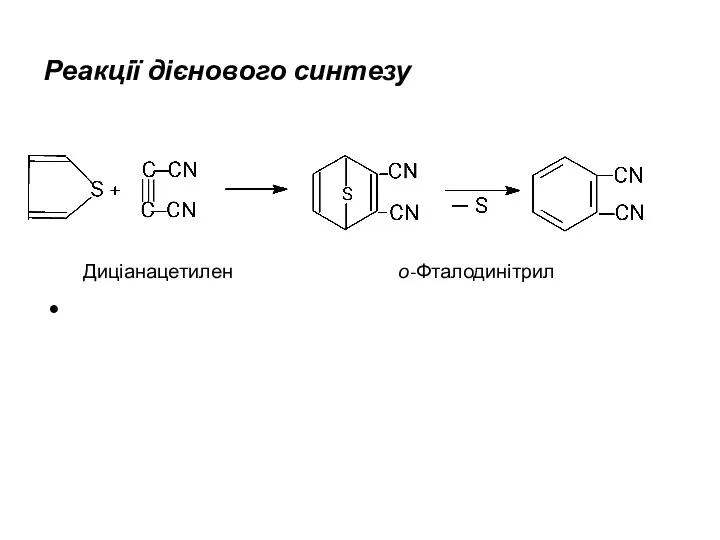
- 16. Реакції дієнового синтезу Диціанацетилен о-Фталодинітрил
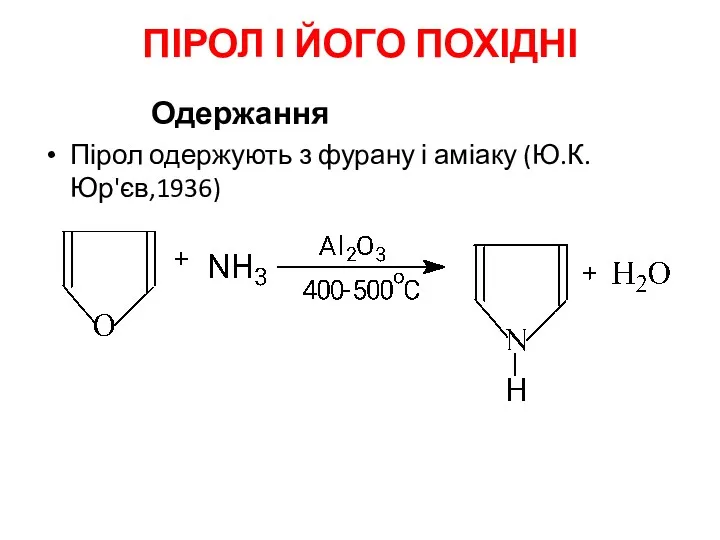
- 17. ПІРОЛ І ЙОГО ПОХІДНІ Одержання Пірол одержують з фурану і аміаку (Ю.К.Юр'єв,1936)
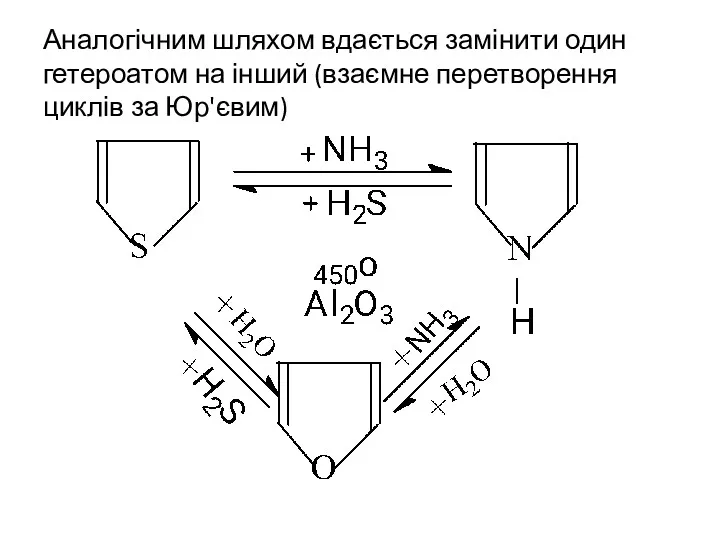
- 18. Аналогічним шляхом вдається замінити один гетероатом на інший (взаємне перетворення циклів за Юр'євим)
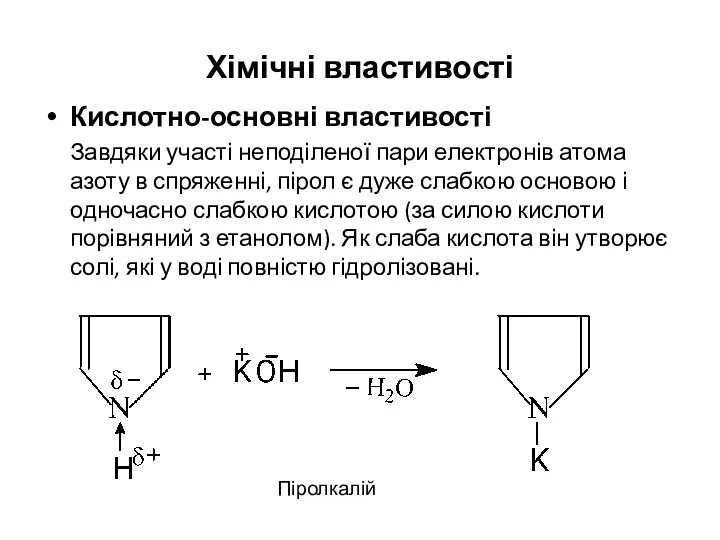
- 19. Хімічні властивості Кислотно-основні властивості Завдяки участі неподіленої пари електронів атома азоту в спряженні, пірол є дуже
- 20. Ацидофобні властивості Пірол ацидофобний. Він легко протонується, що веде до руйнування його спряженого циклу, аналогічно до
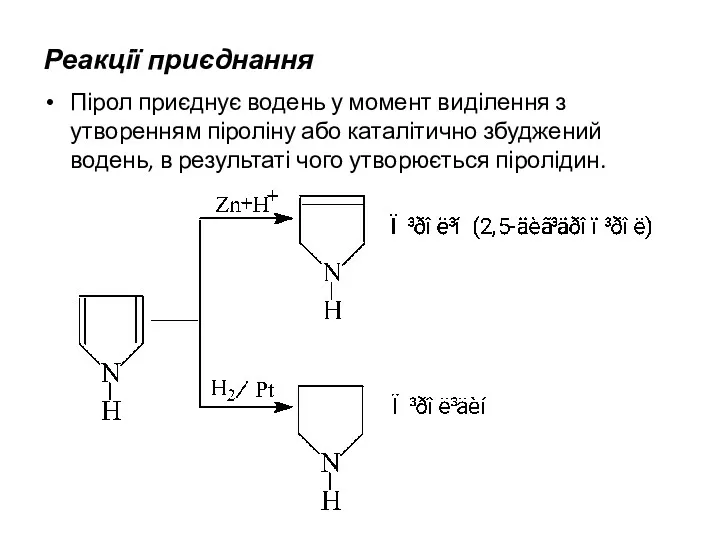
- 22. Реакції приєднання Пірол приєднує водень у момент виділення з утворенням піроліну або каталітично збуджений водень, в
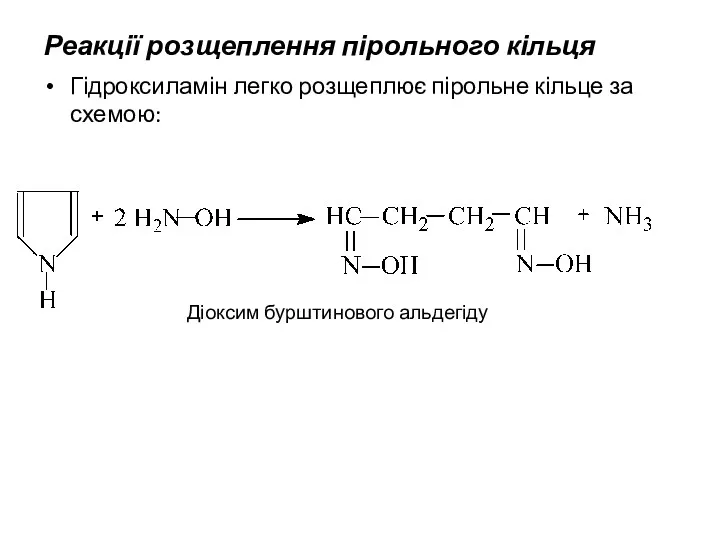
- 23. Реакції розщеплення пірольного кільця Гідроксиламін легко розщеплює пірольне кільце за схемою: Діоксим бурштинового альдегіду
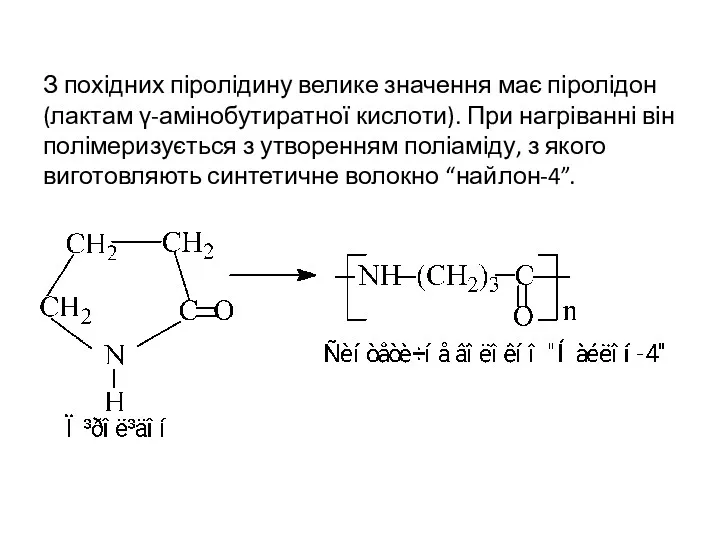
- 24. З похідних піролідину велике значення має піролідон (лактам γ-амінобутиратної кислоти). При нагріванні він полімеризується з утворенням
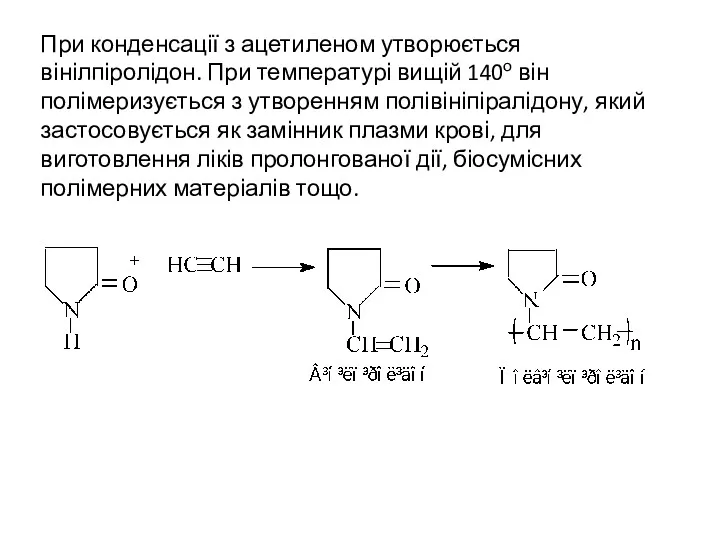
- 25. При конденсації з ацетиленом утворюється вінілпіролідон. При температурі вищій 140о він полімеризується з утворенням полівініпіралідону, який
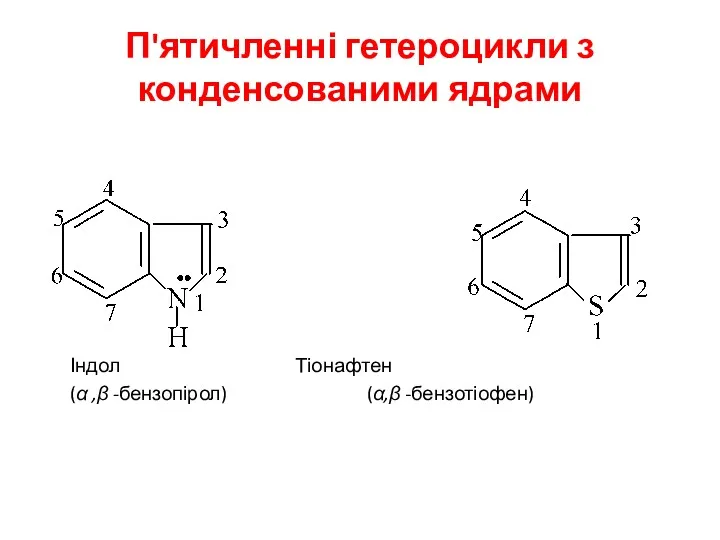
- 26. П'ятичленні гетероцикли з конденсованими ядрами Індол Тіонафтен (α ,β -бензопірол) (α,β -бензотіофен)
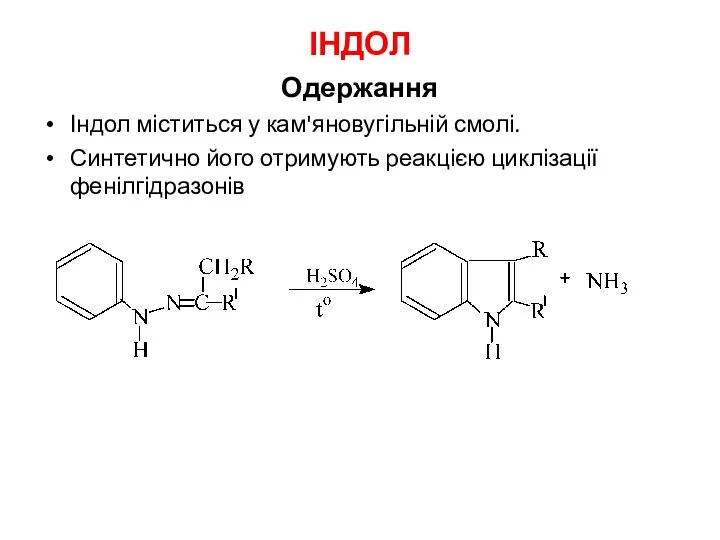
- 27. ІНДОЛ Одержання Індол міститься у кам'яновугільній смолі. Синтетично його отримують реакцією циклізації фенілгідразонів
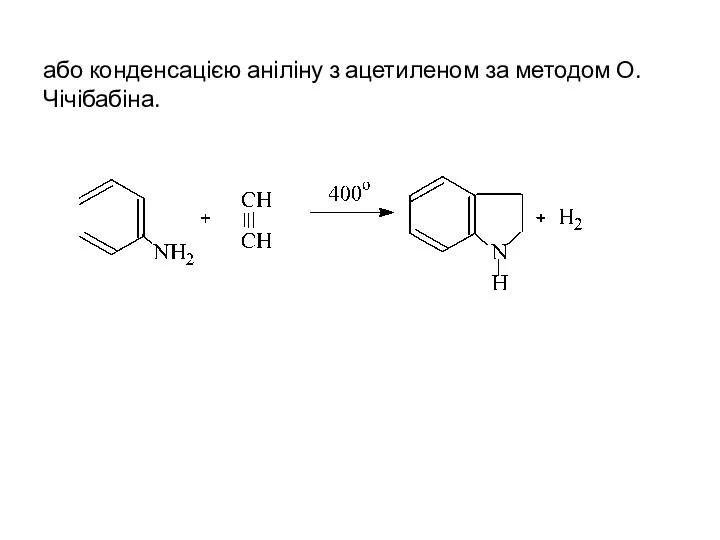
- 28. або конденсацією аніліну з ацетиленом за методом О.Чічібабіна.
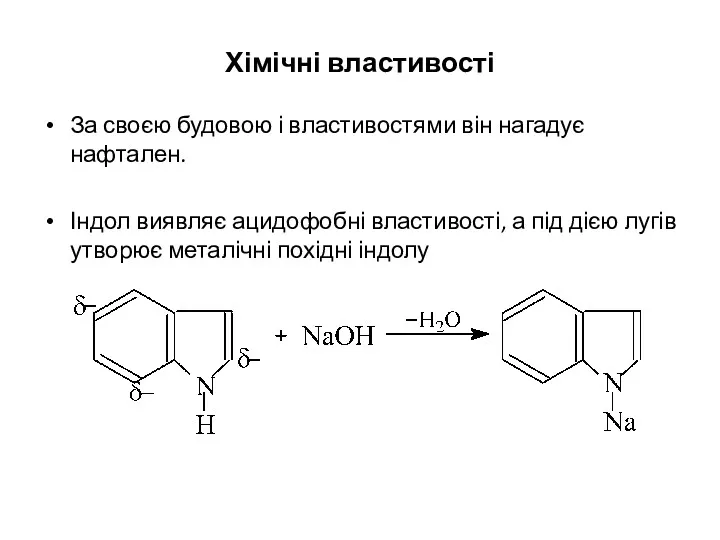
- 29. Хімічні властивості За своєю будовою і властивостями він нагадує нафтален. Індол виявляє ацидофобні властивості, а під
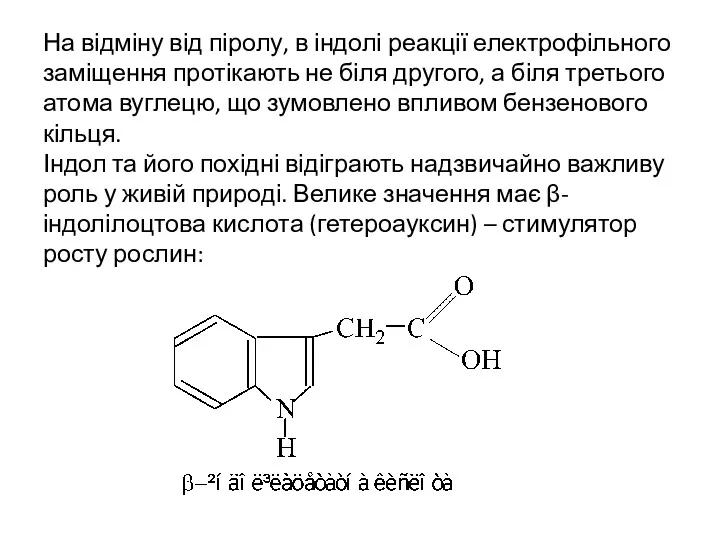
- 30. На відміну від піролу, в індолі реакції електрофільного заміщення протікають не біля другого, а біля третього
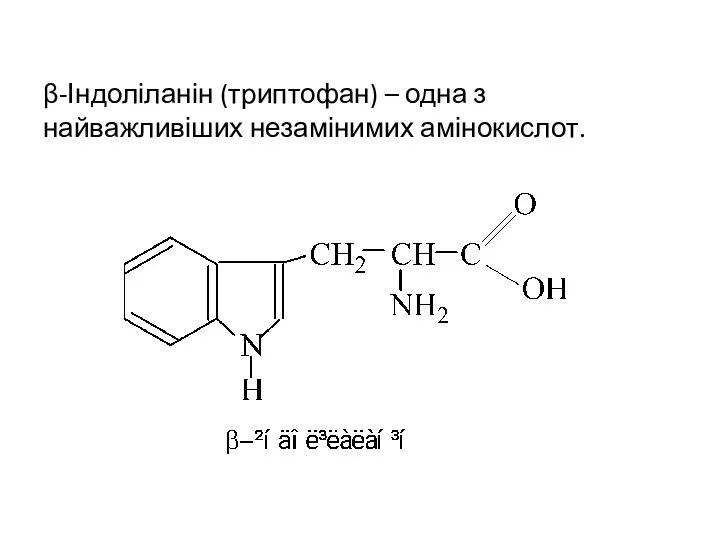
- 31. β-Індоліланін (триптофан) – одна з найважливіших незамінимих амінокислот.
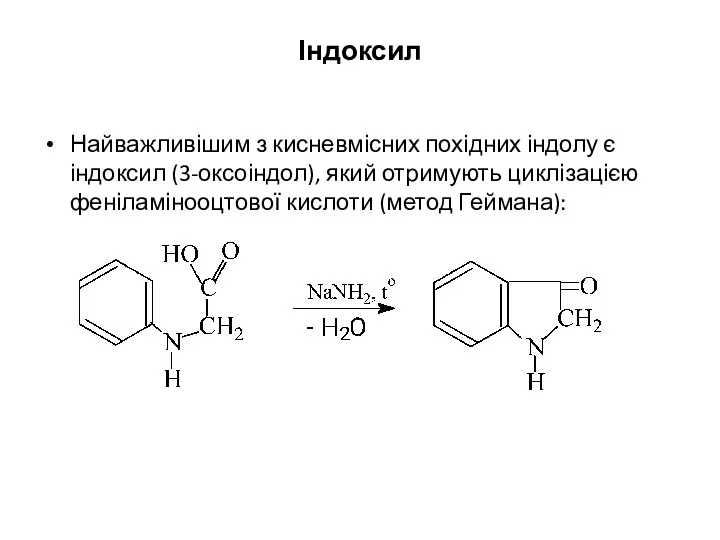
- 32. Індоксил Найважливішим з кисневмісних похідних індолу є індоксил (3-оксоіндол), який отримують циклізацією феніламінооцтової кислоти (метод Геймана):
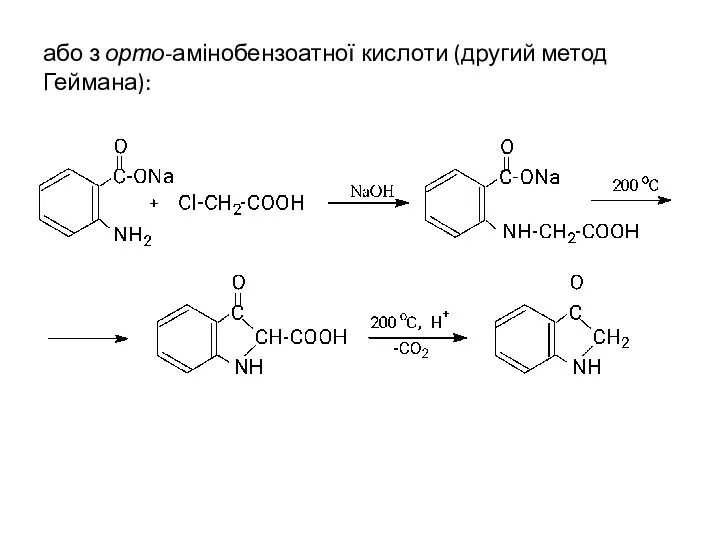
- 33. або з орто-амінобензоатної кислоти (другий метод Геймана):
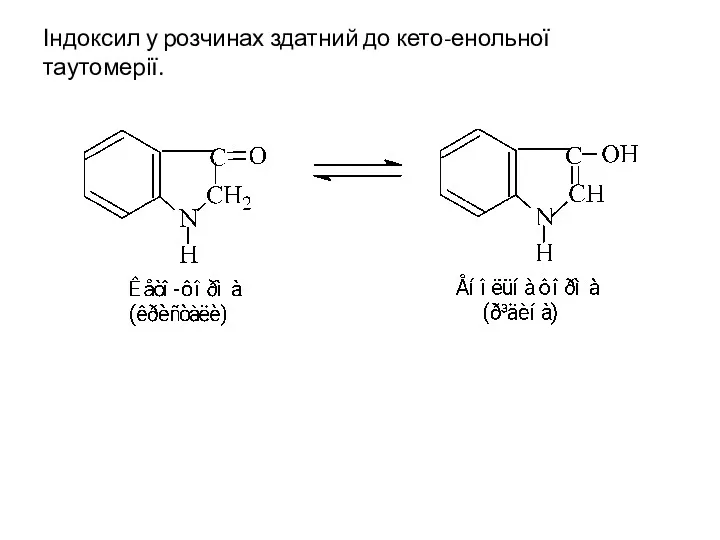
- 34. Індоксил у розчинах здатний до кето-енольної таутомерії.
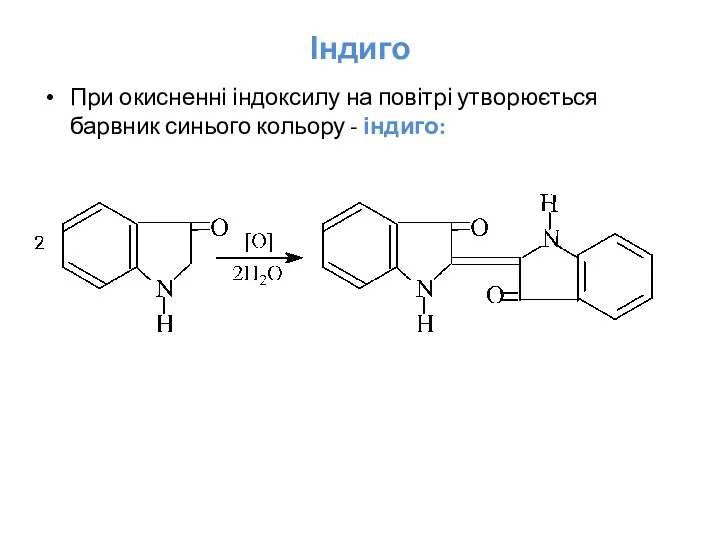
- 35. Індиго При окисненні індоксилу на повітрі утворюється барвник синього кольору - індиго:
- 36. Раніше індиго добували з тропічної рослини “indigofera”. Він здавна відомий, але не втратив і сьогодні свого
- 38. Скачать презентацию





 Аммиак
Аммиак Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Комплексные соединения. Определения
Комплексные соединения. Определения Коррозия металлов
Коррозия металлов Классификация органических соединений
Классификация органических соединений Производство извести
Производство извести Добування кисню
Добування кисню Водород
Водород Строение атома (лекция 3)
Строение атома (лекция 3) Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Окислительно-восстановительные электроды
Окислительно-восстановительные электроды Алканы
Алканы Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Горение топлива
Горение топлива Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Алкины. Ацетилены
Алкины. Ацетилены Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Химические реакции. Урок-обобщение
Химические реакции. Урок-обобщение Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Исследование снежного покрова
Исследование снежного покрова Алюминий и его соединения
Алюминий и его соединения Теоретические основы получения полимеров
Теоретические основы получения полимеров