Содержание
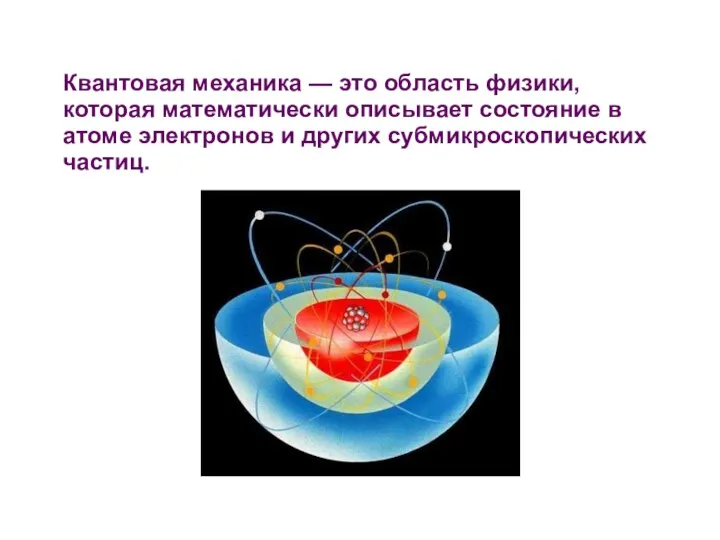
- 2. Квантовая механика — это область физики, которая математически описывает состояние в атоме электронов и других субмикроскопических
- 3. Луи де Бройль (1892 - 1987) Корпускулярно-волновой дуализм
- 5. Нильс Бор (1885 - 1962)
- 6. Принцип неопределенности Гейзенберга Вернер Гейзенберг (1901 - 1976) Невозможно одновременно точно определить положение микрочастицы (её координаты)
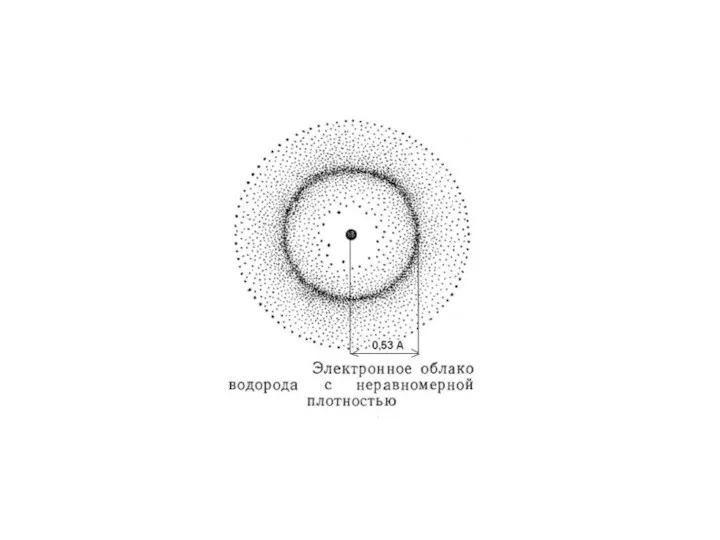
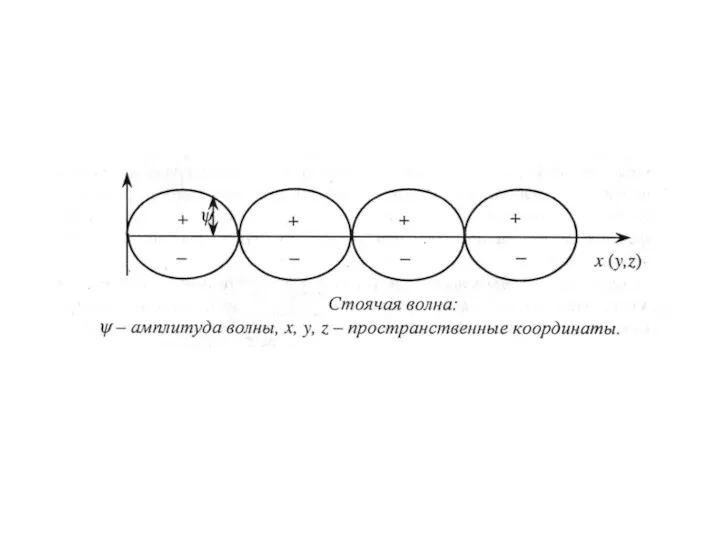
- 8. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
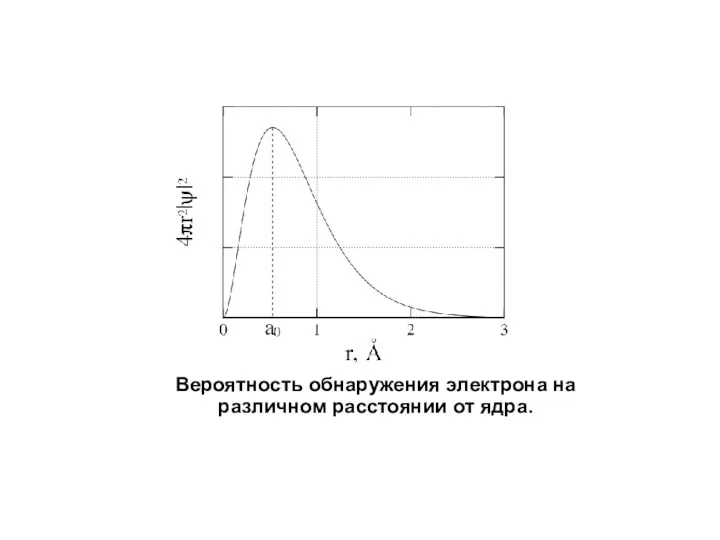
- 11. Вероятность обнаружения электрона на различном расстоянии от ядра.
- 12. Эрвин Шредингер (1887 — 1961) Австрийский физик-теоретик, один из основателей квантовой механики Уравнение Шредингера:
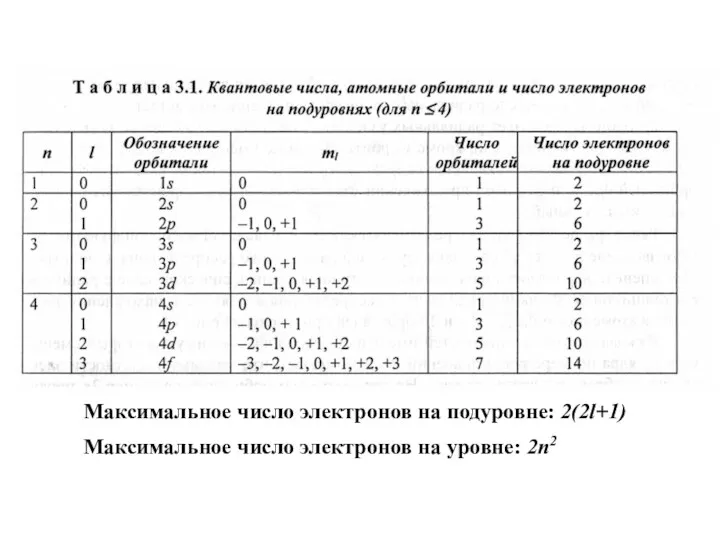
- 13. Квантовые числа Главное квантовое число n - характеризует общий запас энергии электрона: чем больше n, тем
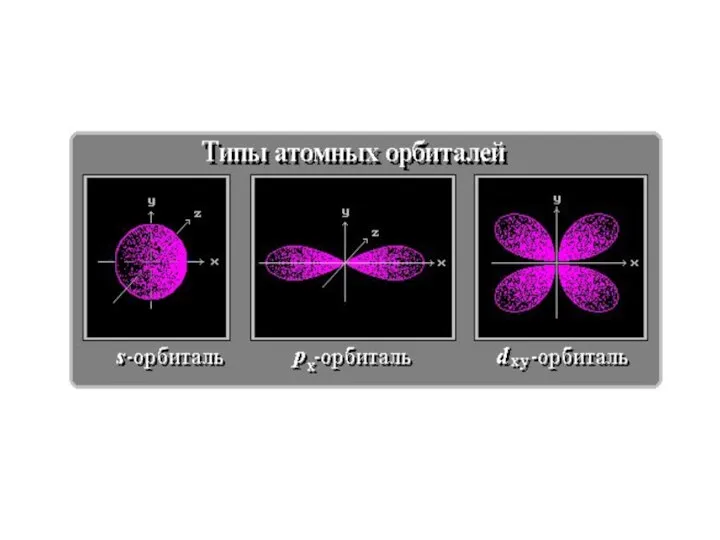
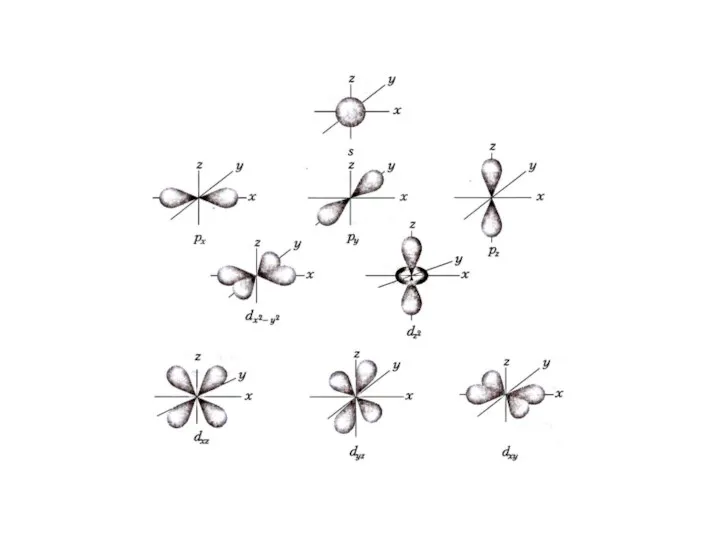
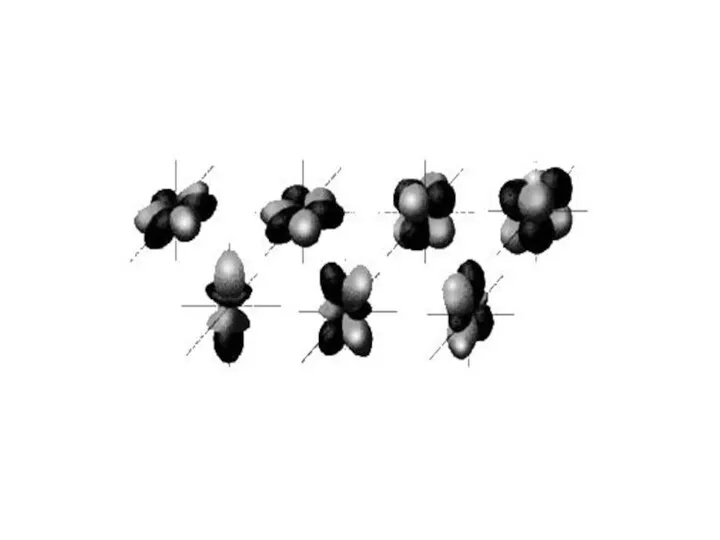
- 14. Квантовые числа Орбитальное квантовое число l - определяет момент количества движения электрона; - характеризует пространственную форму
- 16. Квантовые числа Магнитное квантовое число ml - определяет пространственное расположение атомных орбиталей в пространстве; - показывает
- 19. Максимальное число электронов на подуровне: 2(2l+1) Максимальное число электронов на уровне: 2n2
- 20. Квантовые числа Спиновое квантовое число ms - квантово-механическое свойство электрона — проекция спина на ось z;
- 21. Четыре квантовых числа описывают состояние электрона в атоме и характеризуют: - энергию электрона; - спин; -
- 22. Правила заполнения электронных орбиталей. Принцип наименьшей энергии: в первую очередь электроны заполняют орбитали, подуровни и уровни
- 23. 1s Энергетическая последовательность заполнения подуровней:
- 24. Правила заполнения электронных орбиталей. Правило Гунда: в пределах подуровня электроны располагаются на орбиталях так, чтобы их
- 25. Правила заполнения электронных орбиталей. Принцип Паули (или запрет Паули): в атоме не может быть двух электронов
- 26. Правило Клечковского: вначале заселяется подуровень с меньшей суммой главного и орбитального квантовых чисел (n+l). В случае
- 28. Скачать презентацию















 Адсорбция на твердых телах
Адсорбция на твердых телах Барий. Щелочноземельные металлы
Барий. Щелочноземельные металлы Жидкие кристаллы
Жидкие кристаллы Тест: полимеры
Тест: полимеры Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Кислотно-основное титрование. Алкалиметрия
Кислотно-основное титрование. Алкалиметрия Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Алюминий. Строение и свойство атомов
Алюминий. Строение и свойство атомов Общая характеристика элементов VА-группы. Азот
Общая характеристика элементов VА-группы. Азот Технология монокристаллов и особо чистых веществ
Технология монокристаллов и особо чистых веществ Полимеры органические и неорганические
Полимеры органические и неорганические Спирты
Спирты Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Методи очищення води в побуті
Методи очищення води в побуті Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Сложные эфиры. Жиры
Сложные эфиры. Жиры Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Материаловедение как наука
Материаловедение как наука Способы получения и очистки металлов
Способы получения и очистки металлов Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Нефть. Лекция 5
Нефть. Лекция 5 Воспользуйтесь ЛСМ Химические реакции
Воспользуйтесь ЛСМ Химические реакции Complex compounds
Complex compounds Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6 Понятие о СМС и моющем процессе
Понятие о СМС и моющем процессе Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Карбоновые кислоты, их нахождение в природе и применение
Карбоновые кислоты, их нахождение в природе и применение