Слайд 2

Алкалиметрия. Стандартизация титранта
NaOH, KOH
1 – 0,5 – 0,1 – 0,05
– 0,02 – 0,01 н.
По точной навеске приготовить нельзя, т.к. щелочи гигроскопичны и поглощают углекислый газ воздуха
Готовят раствор щелочи приблизительно нужной концентрации и проводят стандарти-зацию по установочным веществам: гидрофта-лату калия C8H9O4K, щавелевой кислоте H2C2O4⋅2H2O, янтарной кислоте H2C4H4O4, бензойной кислоте C6H5COOH и другим веществам.
Слайд 3
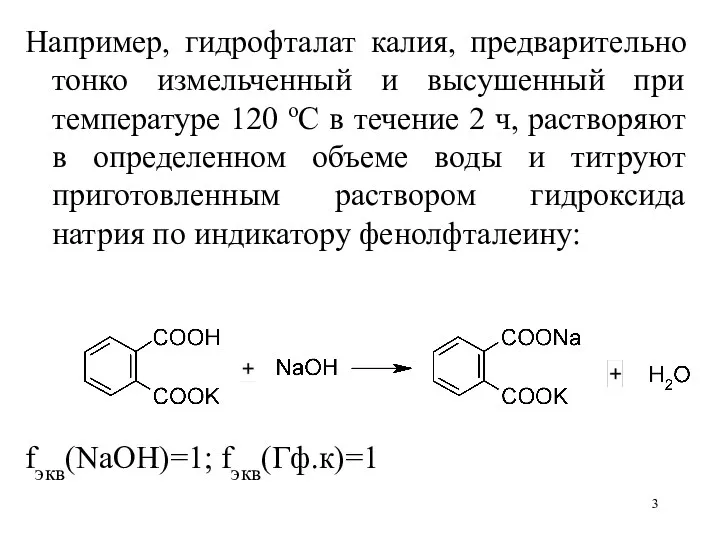
Например, гидрофталат калия, предварительно тонко измельченный и высушенный при температуре 120
оС в течение 2 ч, растворяют в определенном объеме воды и титруют приготовленным раствором гидроксида натрия по индикатору фенолфталеину:
fэкв(NaOH)=1; fэкв(Гф.к)=1
Слайд 4

В общем виде:
Сэкв(Y) · Mэкв(Y) · V(мл)
m(Y)
= ————————————
1000
m(Y)т.н.. · 1000
Сэкв(Y)практ = ———————
Mэкв(Y) · V(мл)
В алкалиметрии:
Сэкв(Гф.к)теор · Mэкв(Гф.к) · Vм.к.
m(Гф.к) = —————————————
1000
m(Гф.к) · 1000
Сэкв(Гф.к)практ = ———————
Mэкв(Гф.к) · Vм.к.
Слайд 5
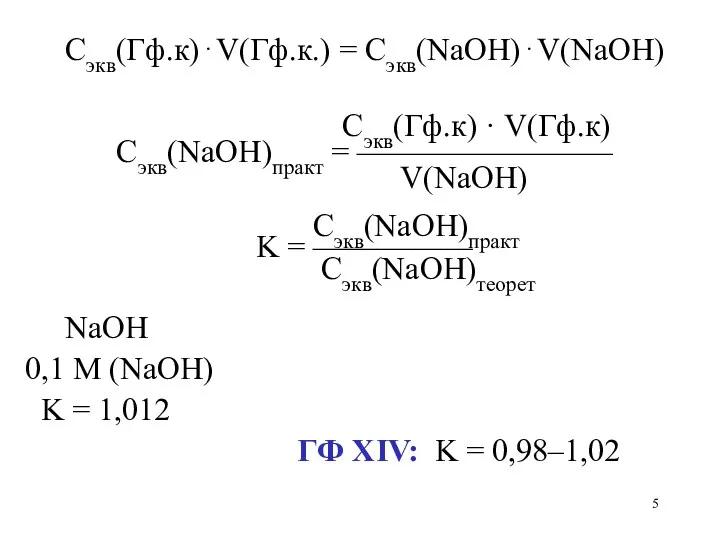
Сэкв(Гф.к)⋅V(Гф.к.) = Сэкв(NaOH)⋅V(NaOH)
Сэкв(Гф.к) · V(Гф.к)
Сэкв(NaOH)практ = ————————
V(NaOH)
Сэкв(NaOH)практ
K = —————
Сэкв(NaOH)теорет
NaOH
0,1 M (NaOH)
K = 1,012
ГФ ХIV: K = 0,98–1,02
Слайд 6

Алкалиметрия применяется для количествен-ного определения сильных и слабых кислот, солей слабых
оснований, как правило, прямым титрованием.
Ион аммония NH4+ − очень слабая кислота (рК=9,24), поэтому прямое титрование его в водном растворе невозможно. Определяют аммиак в солях аммония одним из двух способов: обратным титрованием или заместительным титрованием.
Слайд 7

Обратное титрование:
t
NH4Cl + NaOH → NH3↑ + NaCl + H2O
избыток
NaOH + HCl → NaCl + H2O
остаток
m(NH3) = (V(NaOH)⋅K − V(HCl)⋅K)⋅Т(HCl/NH3)
(V(NaOH)⋅K − V(HCl)⋅K)⋅Т(HCl/NH3)⋅100
ω(NH3) = ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯ (%)
а (NH4Cl)
Сэкв(HCl)⋅Мэкв(NH3)
Т(HCl/NH3) = ⎯⎯⎯⎯⎯⎯⎯⎯
1000
fэкв(HCl)=1; fэкв(NH3)=1; Мэкв(NH3)=М(NH3)
Слайд 8

Заместительное титрование
4NH4Cl + 6HCOH → (CH2)6N4 + 4HCl + 6H2O
Гексаметилентетрамин
(ГМТА)
HCl + NaOH → NaCl + H2O
m(NH3) = V(NaOH)⋅K⋅Т(NaOH/NH3)
V(NaOH)⋅K⋅Т(NaOH/NH3)⋅100
ω(NH3) = ⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯⎯ (%)
а (NH4Cl)
Сэкв(NaOH)⋅Мэкв(NH3)
Т(NaOH/NH3) = ⎯⎯⎯⎯⎯⎯⎯⎯⎯
1000
fэкв(NaOH)=1; fэкв(NH3)=1; Мэкв(NH3)=М(NH3)
Слайд 9

В фармацевтическом анализе прямое алкалиметрическое титрование применяется для количественного определения кислот
(хлороводородной, бензойной, салициловой, аскорбиновой и др. кислот) и солей, образованных слабым основанием и сильной кислотой (новокаин, гоматропина гидробромид, тровентол и др. солей).
Слайд 10
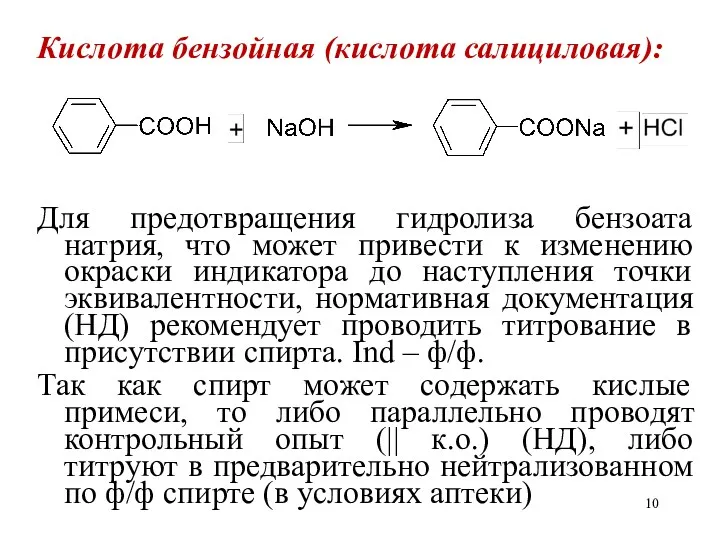
Кислота бензойная (кислота салициловая):
Для предотвращения гидролиза бензоата натрия, что может привести
к изменению окраски индикатора до наступления точки эквивалентности, нормативная документация (НД) рекомендует проводить титрование в присутствии спирта. Ind – ф/ф.
Так как спирт может содержать кислые примеси, то либо параллельно проводят контрольный опыт (|| к.о.) (НД), либо титруют в предварительно нейтрализованном по ф/ф спирте (в условиях аптеки)
Слайд 11

Расчет массы бензойной кислоты:
m(Б.к.) = V(NaOH)·K·T(NaOH/Б.к.)
Расчет массовой доли бензойной кислоты:
V(NaOH)·K·T(NaOH/Б.к.)·100
ω(Б.к.)
= —————————————%
а(Б.к.)
Сэкв(NaOH) · Mэкв(Б.к.)
Т(NaOH/Б.к.) = ————————
1000
fэкв(NaOH)=1; fэкв(Б.к.)=1; Мэкв(Б.к.)=М(Б.к.)
Слайд 12

Расчет массы и массовой доли с учетом контрольного опыта:
m(Б.к.) =
(V(NaOH)оп –V(NaOH)к.оп)·K·T(NaOH/Б.к.)
(V(NaOH)оп–V(NaOH)к.оп)·K·T(NaOH/Б.к.)·100
ω(Б.к.) = ——————————————————%
а(Б.к.)
Слайд 13
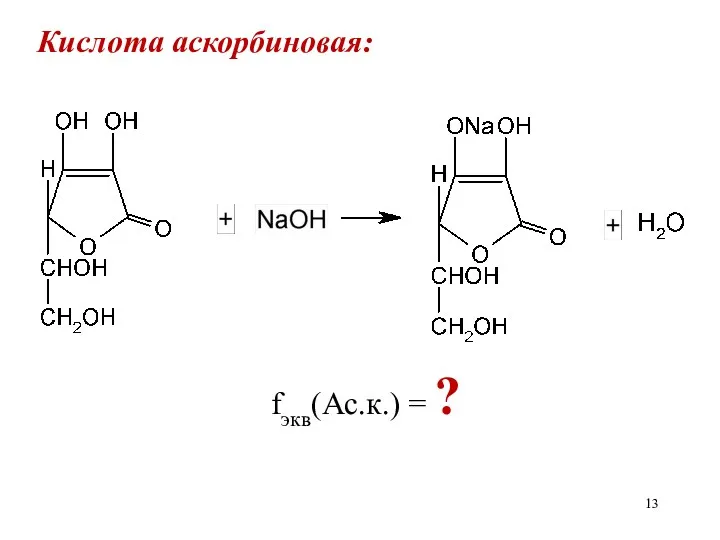
Кислота аскорбиновая:
fэкв(Ас.к.) = ?
Слайд 14
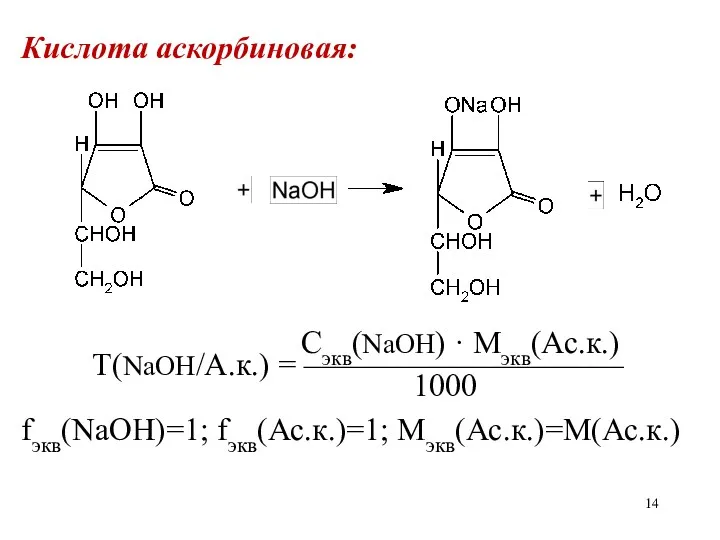
Кислота аскорбиновая:
Сэкв(NaOH) · Mэкв(Ас.к.)
Т(NaOH/А.к.) = ——————————
1000
fэкв(NaOH)=1; fэкв(Ас.к.)=1; Мэкв(Ас.к.)=М(Ас.к.)
Слайд 15
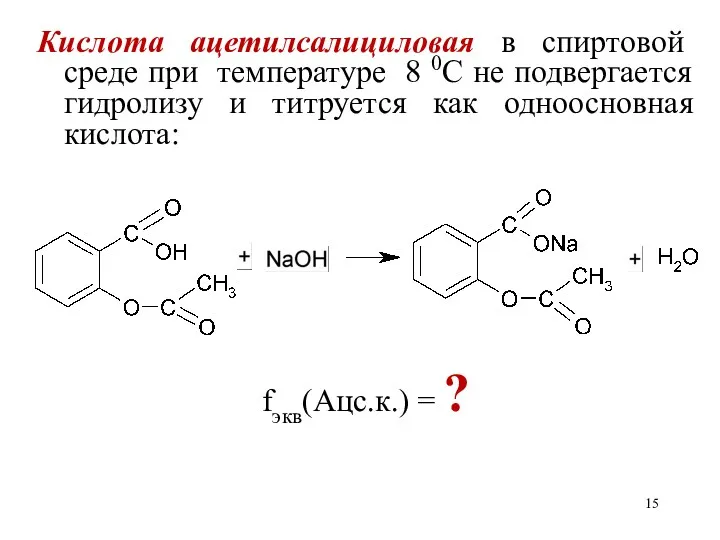
Кислота ацетилсалициловая в спиртовой среде при температуре 8 0С не подвергается
гидролизу и титруется как одноосновная кислота:
fэкв(Ацс.к.) = ?
Слайд 16
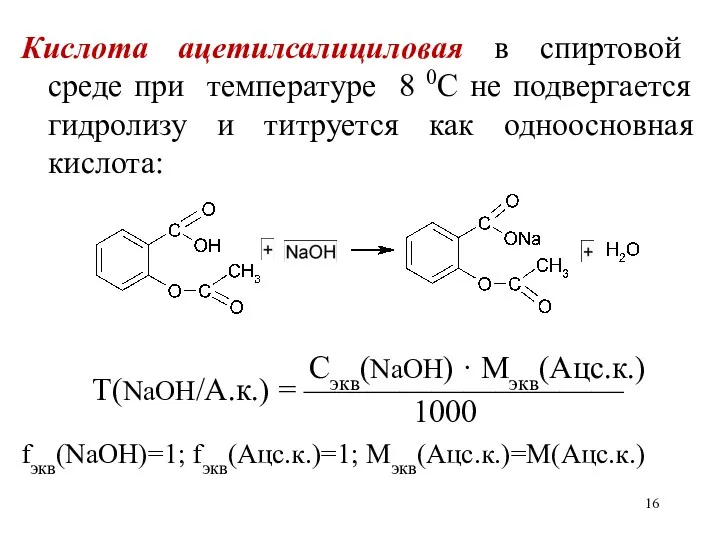
Кислота ацетилсалициловая в спиртовой среде при температуре 8 0С не подвергается
гидролизу и титруется как одноосновная кислота:
Сэкв(NaOH) · Mэкв(Ацс.к.)
Т(NaOH/А.к.) = ——————————
1000
fэкв(NaOH)=1; fэкв(Ацс.к.)=1; Мэкв(Ацс.к.)=М(Ацс.к.)
Слайд 17
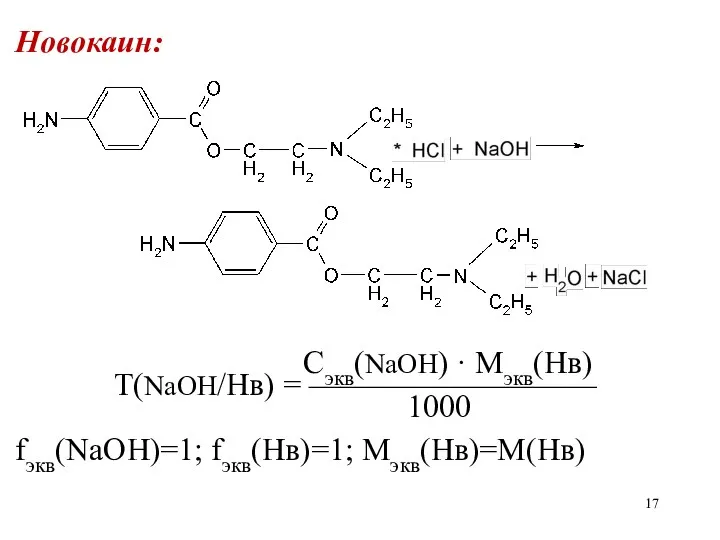
Новокаин:
Сэкв(NaOH) · Mэкв(Нв)
Т(NaOH/Нв) = —————————
1000
fэкв(NaOH)=1; fэкв(Нв)=1; Мэкв(Нв)=М(Нв)
Слайд 18
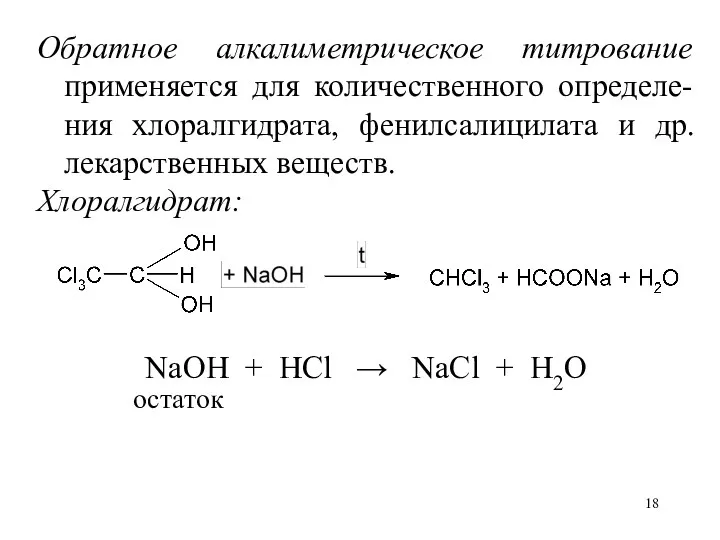
Обратное алкалиметрическое титрование применяется для количественного определе-ния хлоралгидрата, фенилсалицилата и др.
лекарственных веществ.
Хлоралгидрат:
NaOH + HCl → NaCl + H2O
остаток
Слайд 19
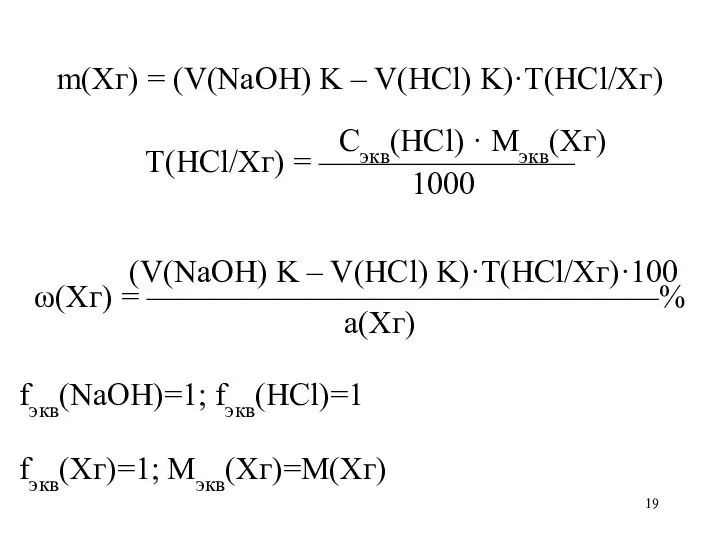
m(Xг) = (V(NaOH) K – V(HCl) K)·T(HCl/Xг)
Сэкв(HCl) · Mэкв(Xг)
Т(HCl/Хг)
= ————————
1000
(V(NaOH) K – V(HCl) K)·T(HCl/Xг)·100
ω(Xг) = ————————————————%
а(Хг)
fэкв(NaOH)=1; fэкв(HCl)=1
fэкв(Хг)=1; Мэкв(Хг)=М(Хг)
Слайд 20
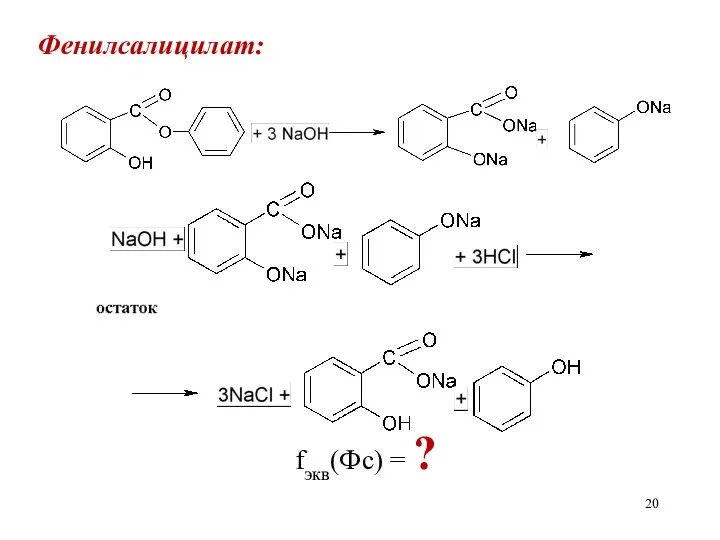
Фенилсалицилат:
fэкв(Фс) = ?
Слайд 21

При титровании избытка щелочи одновременно будут оттитровываться динатривая соль салициловой кислоты
и фенолят натрия. Изменение окраски фенолфталеина будет происходить при переходе от динатриевой соли салицилата в мононатриевую соль
Слайд 22

m(Фс) = (V(NaOH) K – V(HCl) K)·T(HCl/Фс)
Сэкв(HCl) · Mэкв(Фс)
Т(HCl/Фс)
= ————————
1000
(V(NaOH) K – V(HCl) K)·T(HCl/Фс)·100
ω(Фс) = ————————————————%
а(Фс)
fэкв(NaOH)=1; fэкв(HCl)=1
fэкв(Фс)=1; Мэкв(Фс)=М(Фс)
Слайд 23
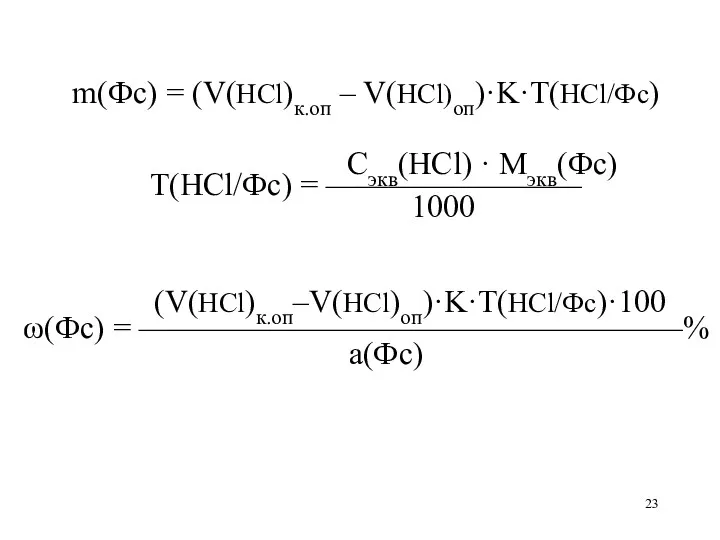
m(Фс) = (V(HCl)к.оп – V(HCl)оп)·K·T(HCl/Фс)
Сэкв(HCl) · Mэкв(Фс)
Т(HCl/Фс) = ————————
1000
(V(HCl)к.оп–V(HCl)оп)·K·T(HCl/Фс)·100
ω(Фс) = —————————————————%
а(Фс)
Слайд 24

Вариант заместительного титрования (косвенного титрования) применяется для лекарственных веществ, содержащих гидроксильную
группу (глицерин, ментол, синэстрол, диэтилстильбэстрол и др) (метод ацетилирования).
Слайд 25

Метод основан на свойстве веществ за счет спиртовых гидроксилов ацетилироваться уксусным
ангидридом с образованием слож-ных эфиров и выделением эквивалентного количества уксусной кислоты, которую оттитровывают стандартным раствором гид-роксида натрия.
Так как одновременно будет оттитровываться уксусная кислота, образующаяся при гидролизе избытка уксусного ангидрида, взятого для ацетилирования, параллельно проводят контрольный опыт.
Слайд 26
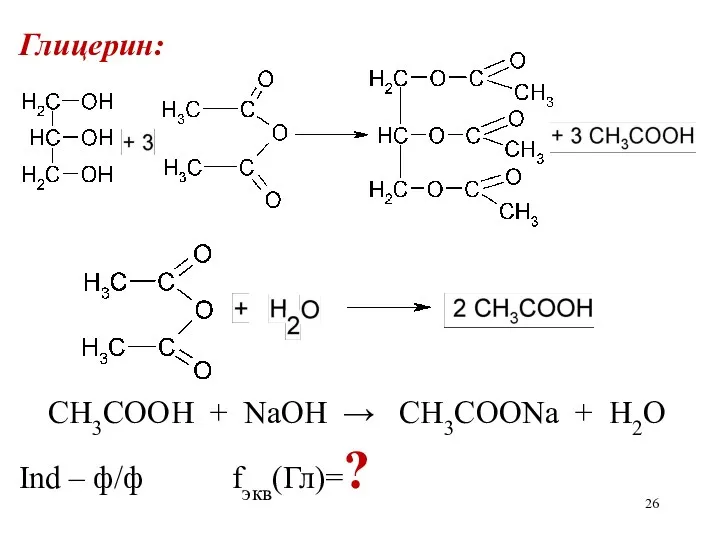
Глицерин:
CH3COOH + NaOH → CH3COONa + H2O
Ind – ф/ф fэкв(Гл)=?
Слайд 27
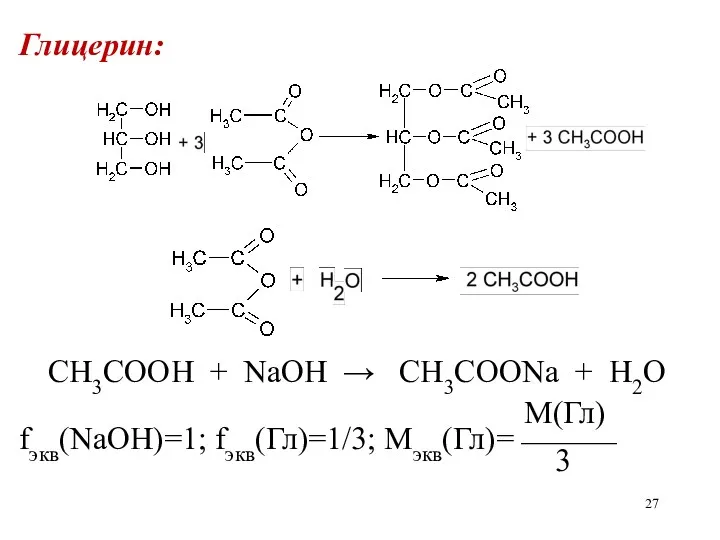
Глицерин:
CH3COOH + NaOH → CH3COONa + H2O
М(Гл)
fэкв(NaOH)=1; fэкв(Гл)=1/3; Мэкв(Гл)=⎯⎯⎯
3
Слайд 28
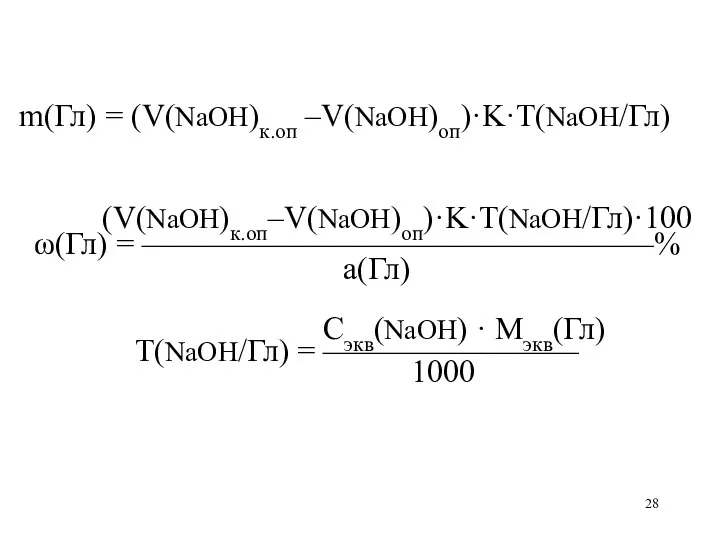
m(Гл) = (V(NaOH)к.оп –V(NaOH)оп)·K·T(NaOH/Гл)
(V(NaOH)к.оп–V(NaOH)оп)·K·T(NaOH/Гл)·100
ω(Гл) = ————————————————%
а(Гл)
Сэкв(NaOH) · Mэкв(Гл)
Т(NaOH/Гл)
= ————————
1000
Слайд 29

Слайд 30
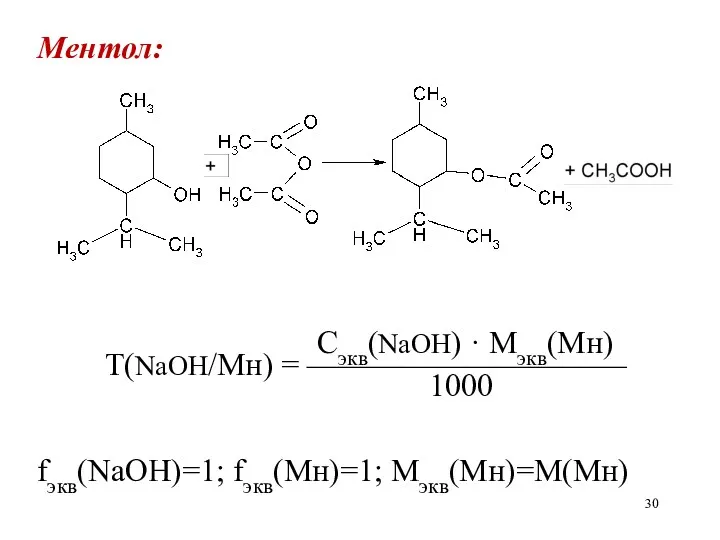
Ментол:
Сэкв(NaOH) · Mэкв(Мн)
Т(NaOH/Мн) = ——————————
1000
fэкв(NaOH)=1; fэкв(Мн)=1; Мэкв(Мн)=М(Мн)
Слайд 31
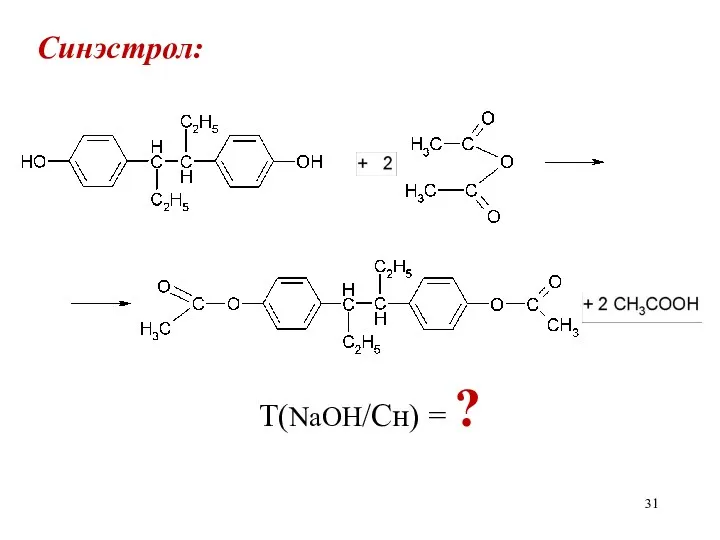
Слайд 32
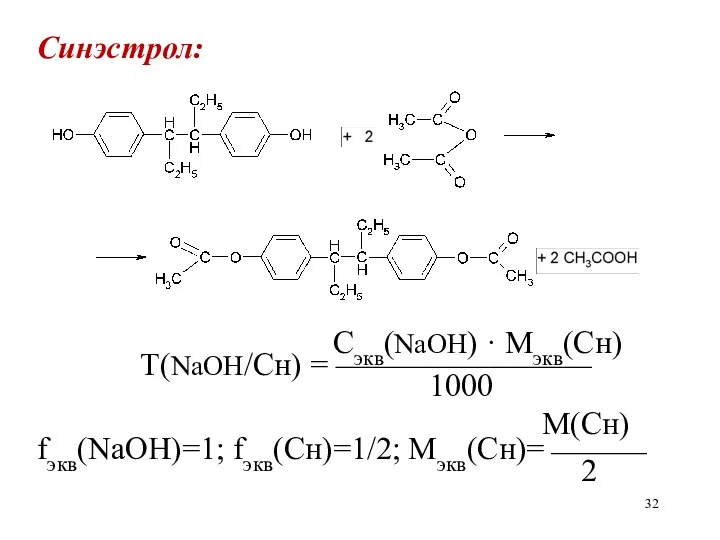
Синэстрол:
Сэкв(NaOH) · Mэкв(Сн)
Т(NaOH/Сн) = ————————
1000
М(Сн)
fэкв(NaOH)=1; fэкв(Сн)=1/2; Мэкв(Сн)=⎯⎯⎯
2
Слайд 33
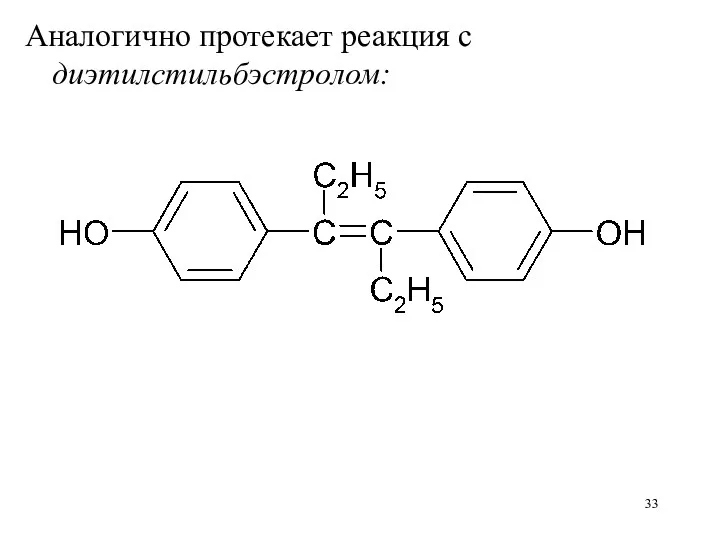
Аналогично протекает реакция с диэтилстильбэстролом:
Слайд 34

Косвенный метод нейтрализации применяется, также, для количественного определения теобромина и теофиллина.
При взаимодей-ствии с нитратом серебра выделяется азотная кислота, которая оттитровывается стандарт-ным раствором гидроксида натрия.
Слайд 35

Теофиллин:
HNO3 + NaOH → NaNO3 + H2O
Сэкв(NaOH) · Mэкв(Тф)
Т(NaOH/Тф)
= ————————
1000
fэкв(Тф)=1; Мэкв(Тф)=М(Тф)
Слайд 36
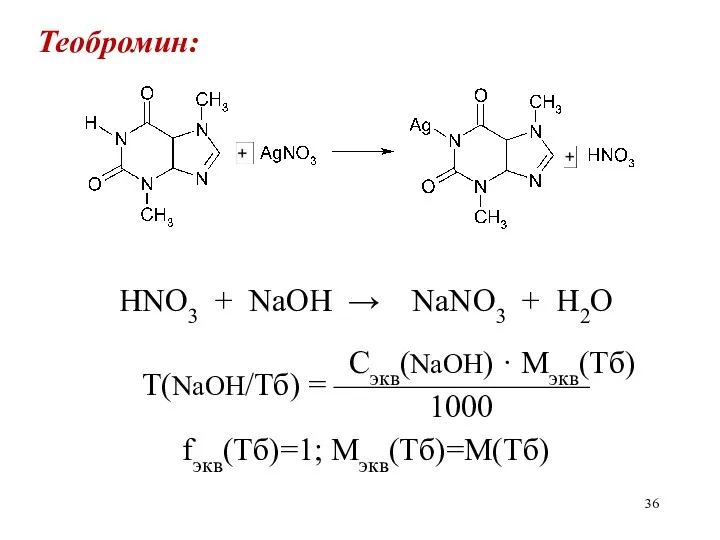
Теобромин:
HNO3 + NaOH → NaNO3 + H2O
Сэкв(NaOH) · Mэкв(Тб)
Т(NaOH/Тб)
= ————————
1000
fэкв(Тб)=1; Мэкв(Тб)=М(Тб)

















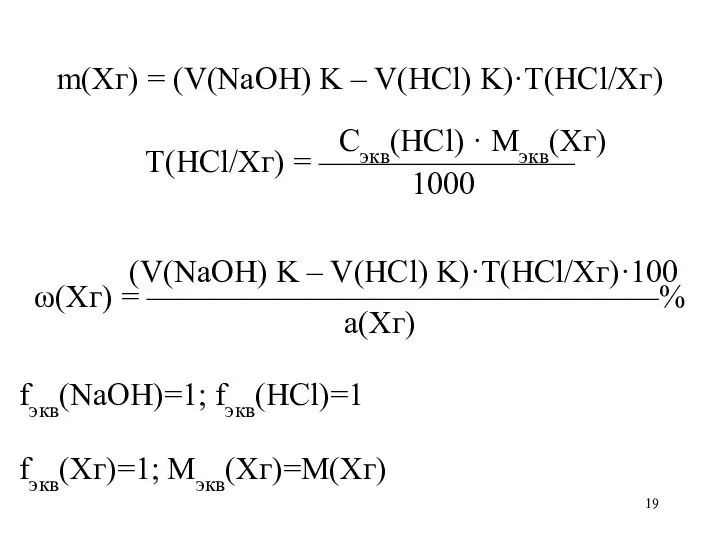

















 Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Газовые гидраты
Газовые гидраты Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Моющие средства
Моющие средства Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Алюминий и его соединения
Алюминий и его соединения Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Термический анализ
Термический анализ Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Кислород и оксиген
Кислород и оксиген Нитраттарды қолдану
Нитраттарды қолдану Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Химия. Дисперсные системы. Растворы
Химия. Дисперсные системы. Растворы Металлы и сплавы. Общие сведения о металлах и сплавах
Металлы и сплавы. Общие сведения о металлах и сплавах Элементы VIА группы
Элементы VIА группы Химическая промышленность
Химическая промышленность Основные классы неорганических соединений
Основные классы неорганических соединений Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Нуклеиновые кислоты
Нуклеиновые кислоты Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі
Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі Карбоновые кислоты
Карбоновые кислоты Ауыр түсті металдар
Ауыр түсті металдар