Содержание
- 2. ВАЖНЕЙШИЕ ПОНЯТИЯ 1. Строение атома. Протоны, нейтроны и электроны. Атомная единица массы, порядковый (атомный) номер и
- 3. ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ Изотопы— это атомы одного и того же элемента, но с различным числом нейтронов в
- 4. Пример 1.1 Каков символ и порядковый номер брома? Почему в качестве символа брома не используется только
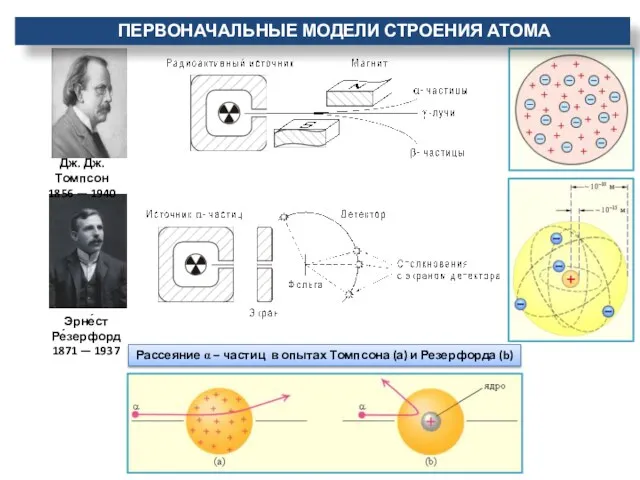
- 5. Эрне́ст Ре́зерфорд 1871 — 1937 Рассеяние α – частиц в опытах Томпсона (а) и Резерфорда (b)
- 6. КЛАССИЧЕСКАЯ МОДЕЛЬ СТРОЕНИЯ АТОМА – КВАНТОВАЯ МОДЕЛЬ БОРА Нильс Бор 1885 – 1962 Электрон в атоме
- 7. Современная модель строения атома Основные положения: 1. Электрон имеет двойственную (корпускулярно-волновую) природу: он может себя вести
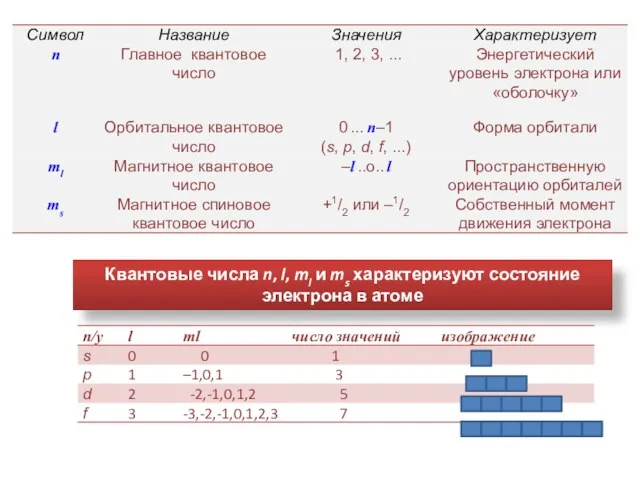
- 8. КВАНТОВЫЕ ЧИСЛА Орбитальное квантовое число (l) характеризует состояние электрона в пределах данного подуровня и форму орбитали.
- 9. Квантовые числа n, l, ml и ms характеризуют состояние электрона в атоме
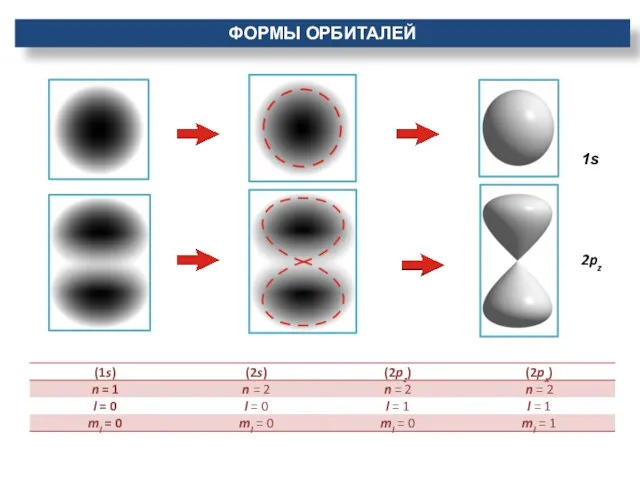
- 10. 1s 2pz ФОРМЫ ОРБИТАЛЕЙ
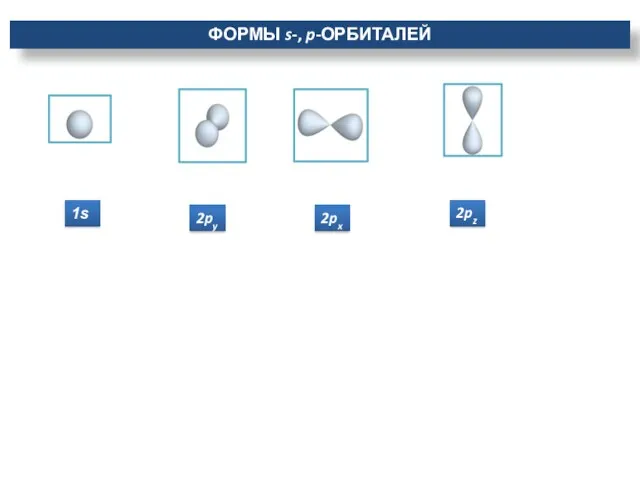
- 11. 1s ФОРМЫ s-, p-ОРБИТАЛЕЙ 2px 2py 2pz
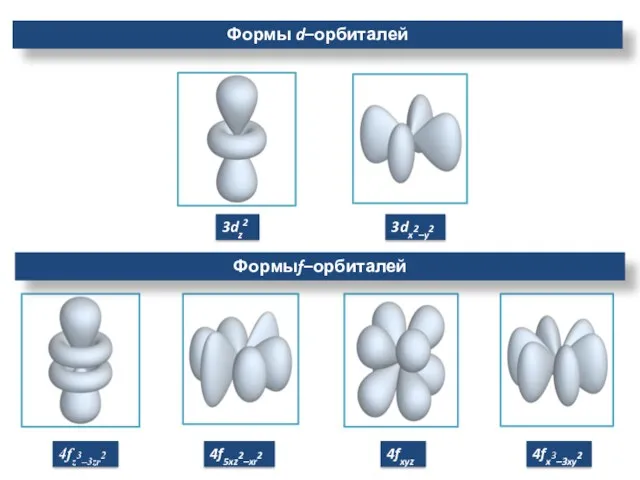
- 12. 3dz2 3dx2–y2 4fz3–3zr2 4f5xz2–xr2 4fxyz 4fx3–3xy2 Формыf–орбиталей Формы d–орбиталей
- 13. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ В АТОМАХ ПОДЧИНЯЕТСЯ: 1. Принцип запрета (В. Паули, 1925) Вольфганг Паули 1900 - 1958
- 14. Правила Клечковского 1. По мере увеличения заряда ядра атома электроны в первую очередь заполняют подуровень с
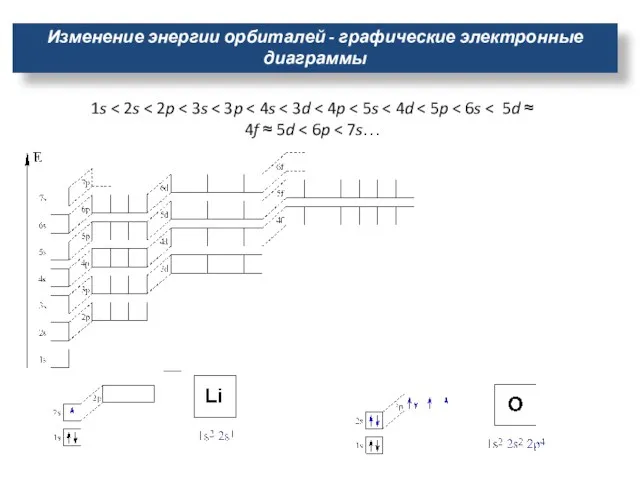
- 15. Изменение энергии орбиталей - графические электронные диаграммы 1s
- 16. Правило октетов Атом удовлетворяет правилу октетов, когда он, путем присоединения, потери или обобществления электронов с другими
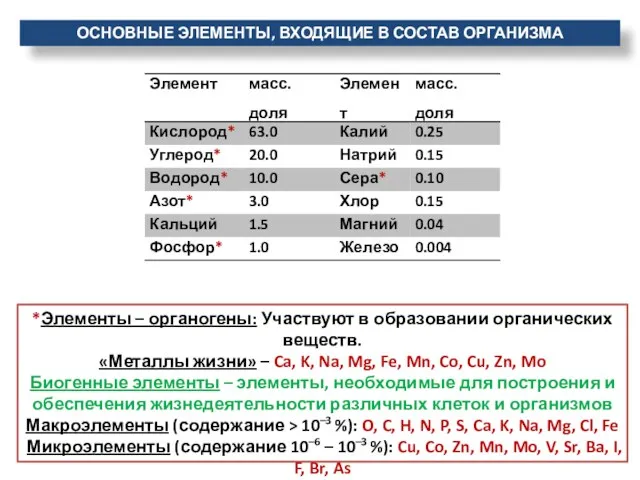
- 17. *Элементы – органогены: Участвуют в образовании органических веществ. «Металлы жизни» – Ca, K, Na, Mg, Fe,
- 18. Современная формулировка периодического закона: Свойства элементов находятся в периодической зависимости от их атомных номеров ПЕРИОДИЧЕСКИЙ ЗАКОН
- 19. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА Д.И. МЕНДЕЛЕЕВА Дмитрий Иванович Менделеев 1834 – 1907
- 20. СТАНДАРТНАЯ ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ИЮПАК
- 21. РАСПОЛОЖЕНИЕ ЭЛЕМЕНТОВ В ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ Металлоиды — химические элементы, расположенные на границе между металлами и неметаллами.
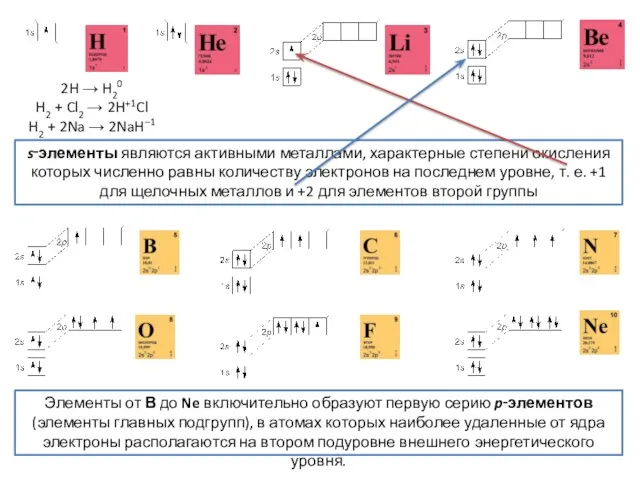
- 22. 2H → H20 H2 + Cl2 → 2H+1Cl H2 + 2Na → 2NaH–1 s‑элементы являются активными
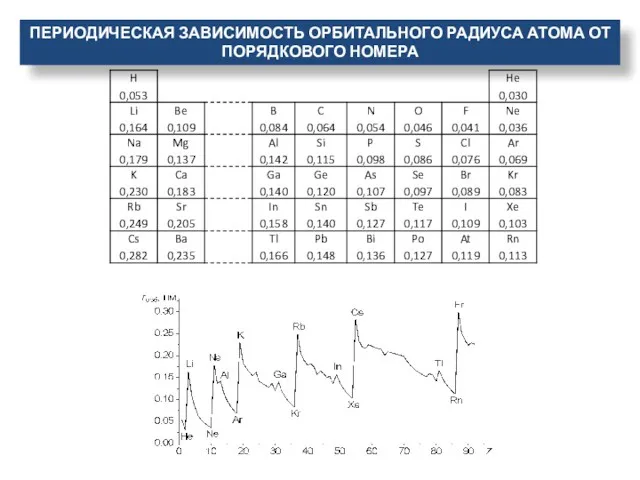
- 23. ПЕРИОДИЧЕСКАЯ ЗАВИСИМОСТЬ ОРБИТАЛЬНОГО РАДИУСА АТОМА ОТ ПОРЯДКОВОГО НОМЕРА
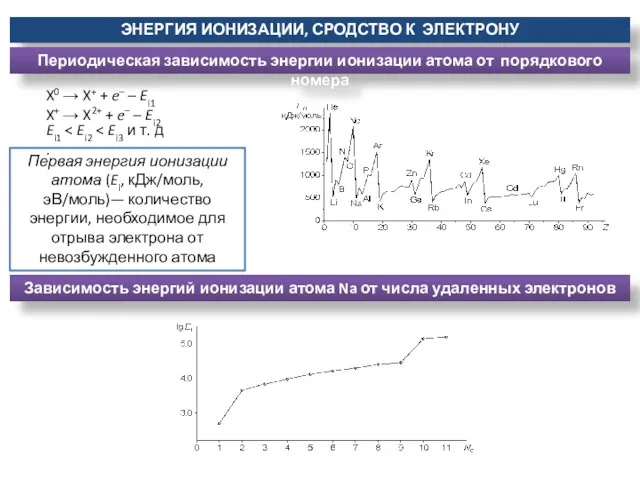
- 24. ЭНЕРГИЯ ИОНИЗАЦИИ, СРОДСТВО К ЭЛЕКТРОНУ Первая энергия ионизации атома (Ei, кДж/моль, эВ/моль)— количество энергии, необходимое для
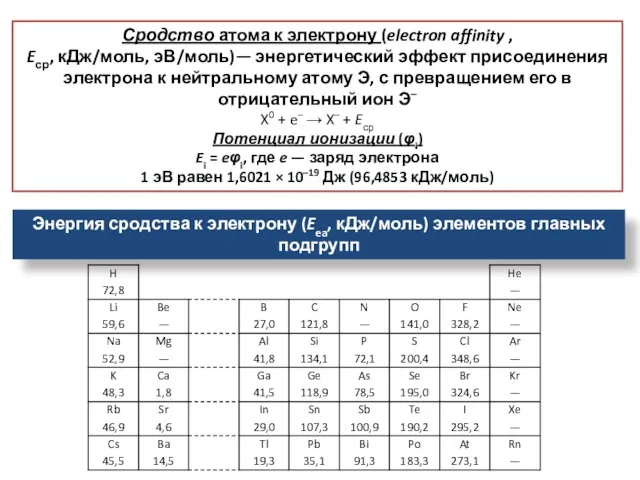
- 25. Энергия сродства к электрону (Eea, кДж/моль) элементов главных подгрупп Сродство атома к электрону (electron affinity ,
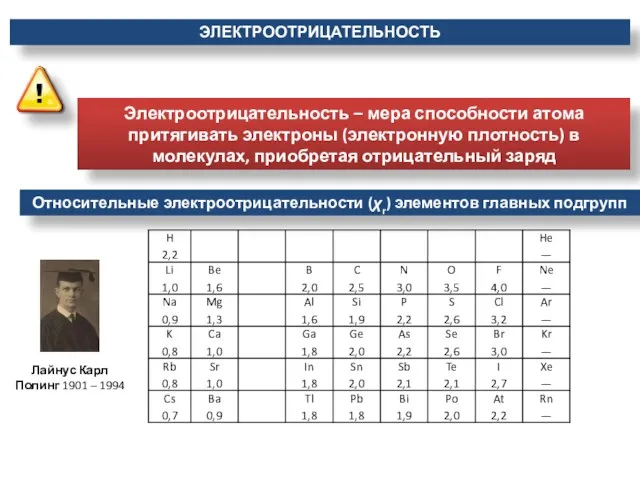
- 26. Относительные электроотрицательности (χr) элементов главных подгрупп Лайнус Карл Полинг 1901 – 1994 Электроотрицательность – мера способности
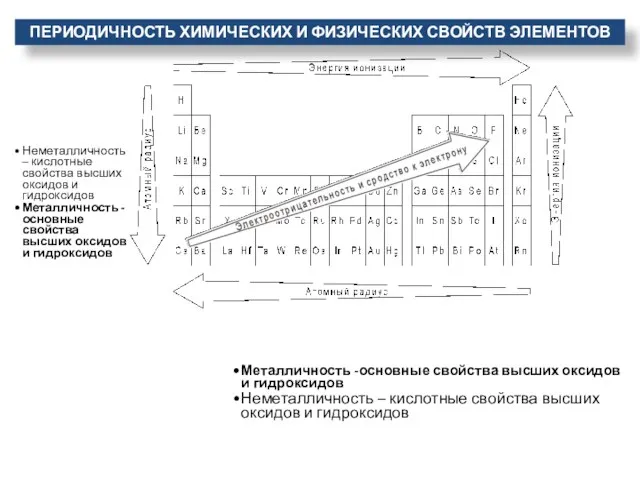
- 27. ПЕРИОДИЧНОСТЬ ХИМИЧЕСКИХ И ФИЗИЧЕСКИХ СВОЙСТВ ЭЛЕМЕНТОВ Металличность -основные свойства высших оксидов и гидроксидов Неметалличность – кислотные
- 29. Скачать презентацию













 Введение в неорганическую химию. Классификация неорганических соединений
Введение в неорганическую химию. Классификация неорганических соединений Основні принципи мас-спектрометрії
Основні принципи мас-спектрометрії Оксиды, свойства и способы получения
Оксиды, свойства и способы получения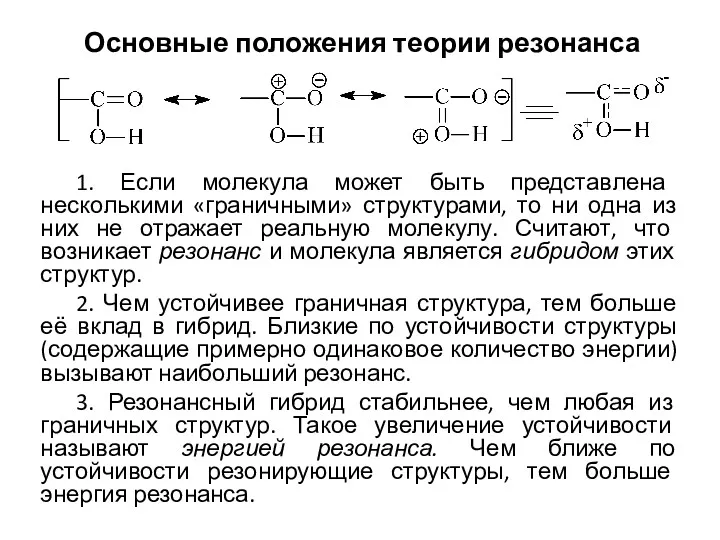 Основные положения теории резонанса
Основные положения теории резонанса Подгруппа селена
Подгруппа селена Химическое сопротивление меди и ее сплавов
Химическое сопротивление меди и ее сплавов Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Методы в химии
Методы в химии Бутадиеновые каучуки
Бутадиеновые каучуки Аммиак. 9 класс
Аммиак. 9 класс Промышленные катализаторы
Промышленные катализаторы Углеводороды
Углеводороды Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Термодинамика химических процессов
Термодинамика химических процессов Признаки и условия протекания химических реакций
Признаки и условия протекания химических реакций Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия Классификация химических элементов
Классификация химических элементов Растворение. Растворы. Физическая теория
Растворение. Растворы. Физическая теория Цинковое покрытие
Цинковое покрытие Химическое равновесие
Химическое равновесие Алюминий и его соединения
Алюминий и его соединения Химические свойства металлов
Химические свойства металлов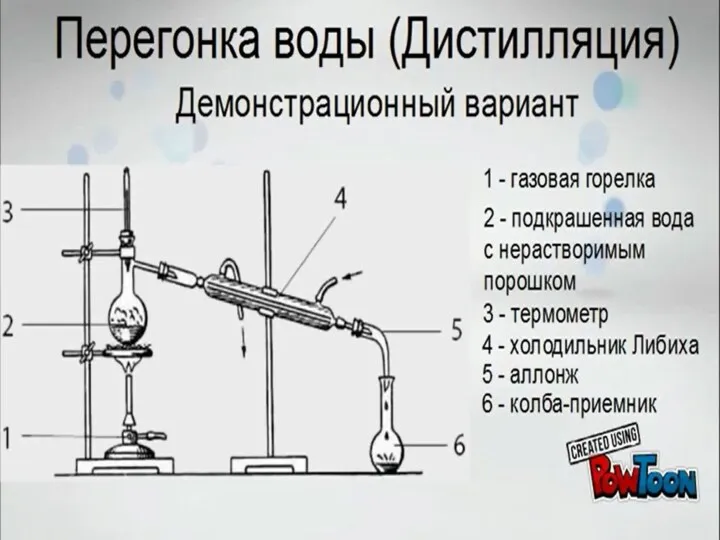 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Строение и свойства циклоалканов
Строение и свойства циклоалканов Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Циклоалканы
Циклоалканы Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)