Содержание
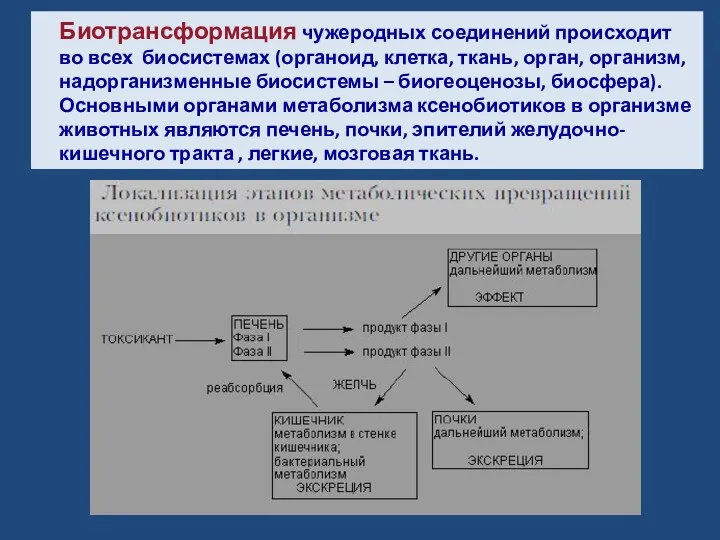
- 2. Биотрансформация чужеродных соединений происходит во всех биосистемах (органоид, клетка, ткань, орган, организм, надорганизменные биосистемы – биогеоценозы,
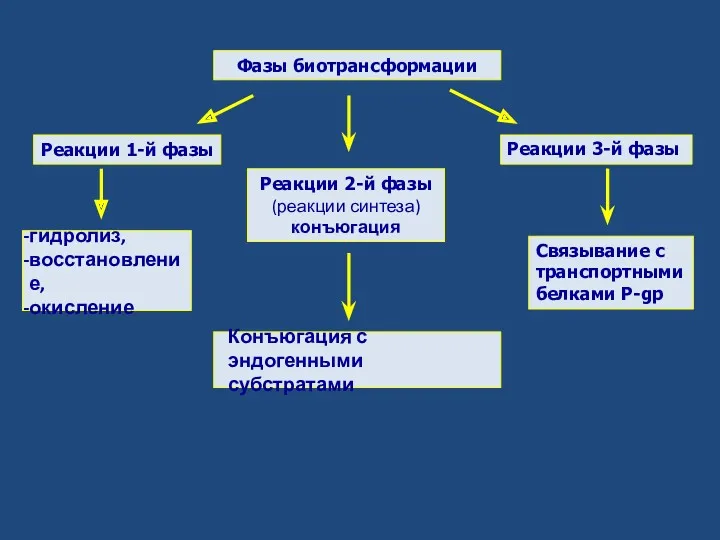
- 3. Фазы биотрансформации Реакции 1-й фазы Реакции 2-й фазы (реакции синтеза) конъюгация гидролиз, восстановление, окисление Конъюгация с
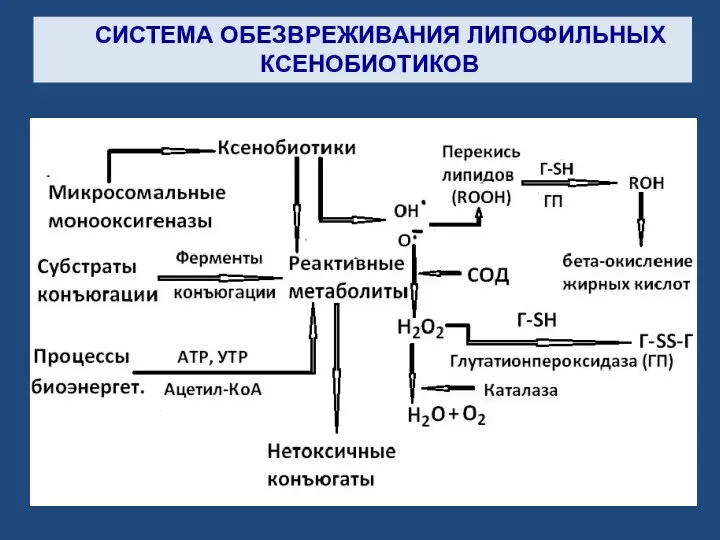
- 4. СИСТЕМА ОБЕЗВРЕЖИВАНИЯ ЛИПОФИЛЬНЫХ КСЕНОБИОТИКОВ
- 5. Основные пути биотрансформации чужеродных соединений. I ФАЗА Окисление: а) микросомальное – алифатичекое или ароматическое гидроксилирование, –
- 6. Восстановление: а) восстановление нитросоединений, азосоединений микросомальными ферментами; б) микросомальное восстановительное галогенирование; в) немикросомальное восстановление. Гидролиз с
- 7. Ферменты биотрансформации ксенобиотиков присутствуют, в основном, в микросомах и в цитозоле, незначительная часть – в митохондриях,
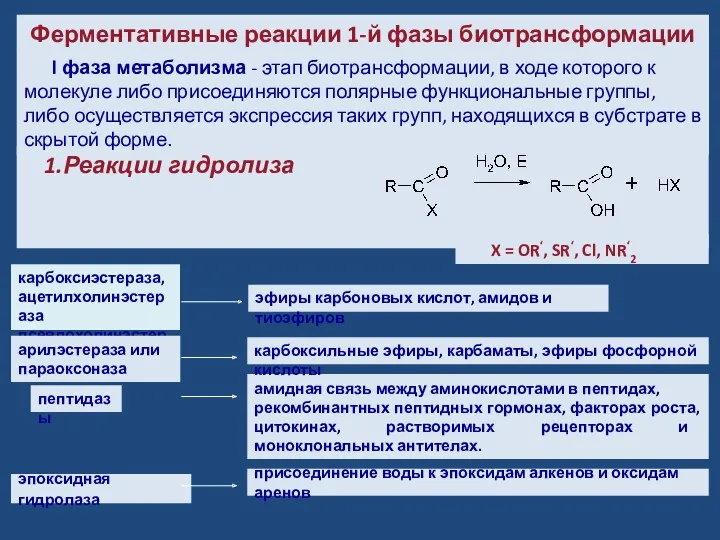
- 8. Ферментативные реакции 1-й фазы биотрансформации карбоксиэстераза, ацетилхолинэстераза псевдохолинэстераза эпоксидная гидролаза l фаза метаболизма - этап биотрансформации,
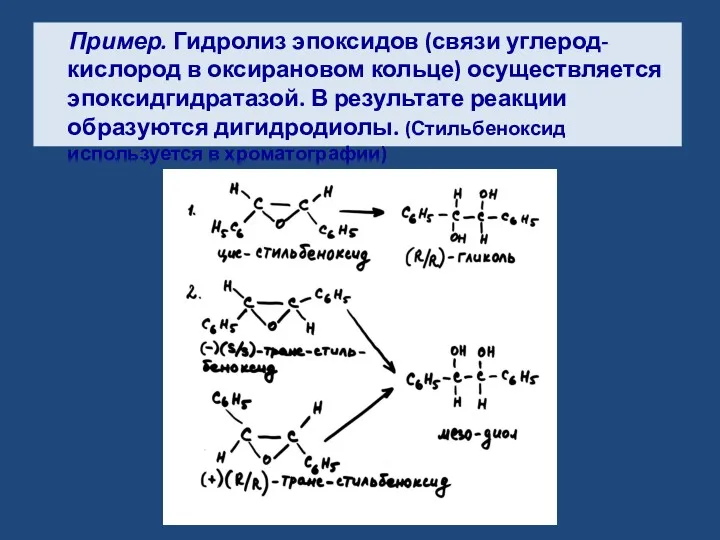
- 9. Пример. Гидролиз эпоксидов (связи углерод-кислород в оксирановом кольце) осуществляется эпоксидгидратазой. В результате реакции образуются дигидродиолы. (Стильбеноксид
- 10. 2 . Реакции восстановления. Восстанавливаются некоторые металлы, альдегиды, кетоны, дисульфиды, сульфоксиды, хиноны, алкены, азо- и нитросоединения.
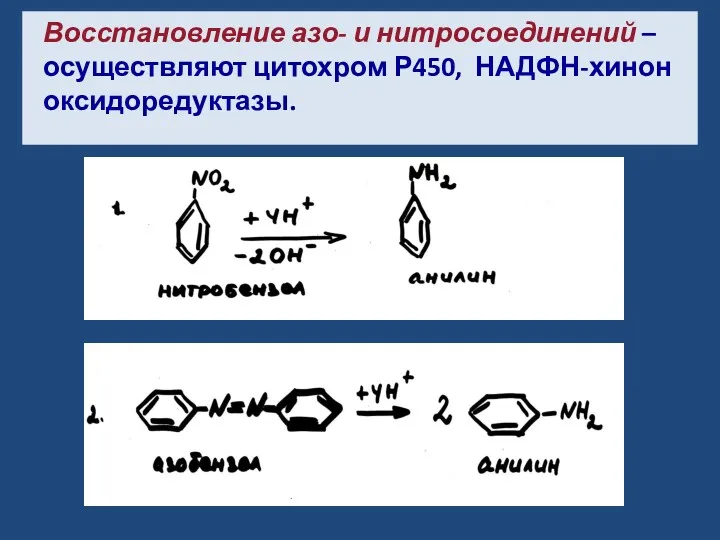
- 11. Восстановление азо- и нитросоединений – осуществляют цитохром Р450, НАДФН-хинон оксидоредуктазы.
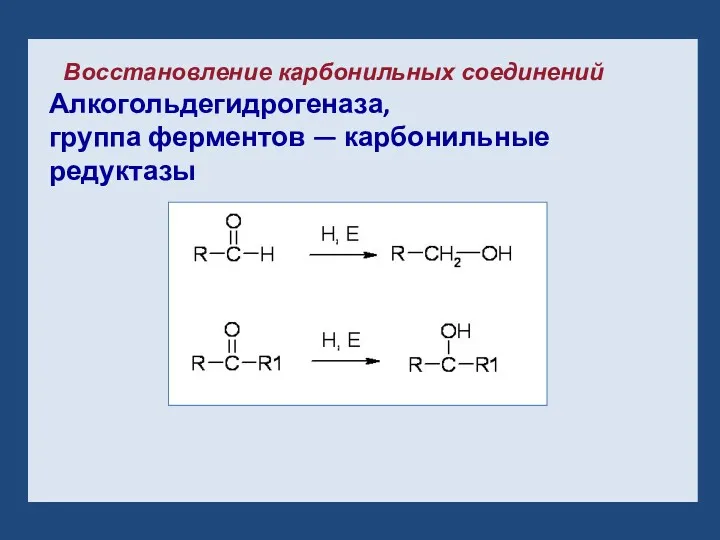
- 12. Восстановление карбонильных соединений Алкогольдегидрогеназа, группа ферментов — карбонильные редуктазы
- 13. Восстановление дисульфидов – ферменты: глутатионредуктаза, глутатион - S-трансфераза, или неферментативно
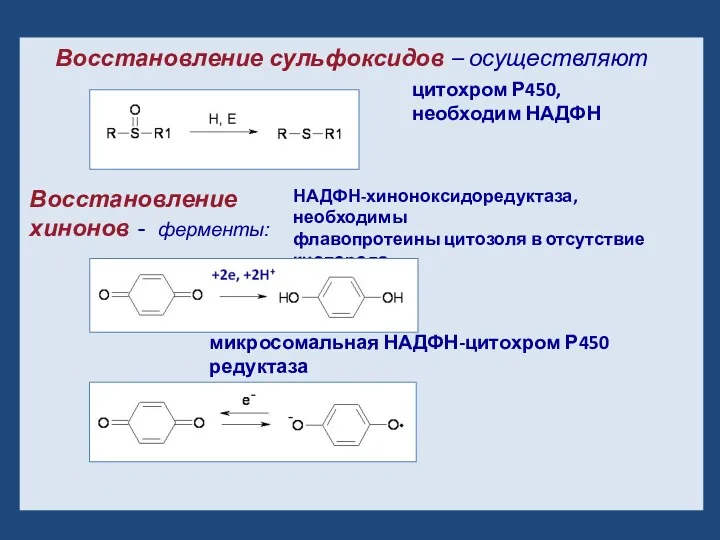
- 14. Восстановление сульфоксидов – осуществляют цитохром Р450, необходим НАДФН Восстановление хинонов - ферменты: НАДФН-хиноноксидоредуктаза, необходимы флавопротеины цитозоля
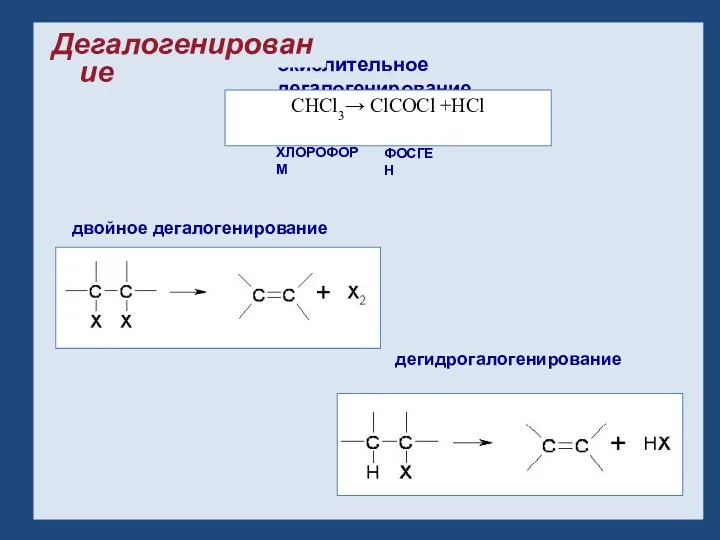
- 15. Дегалогенирование: окислительное дегалогенирование двойное дегалогенирование дегидрогалогенирование ХЛОРОФОРМ ФОСГЕН CHCl3→ ClCOCl +HCl Дегалогенирование
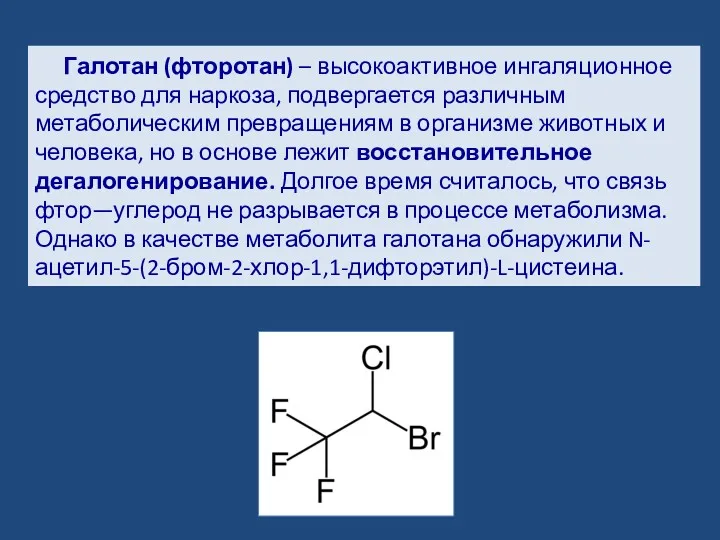
- 16. Галотан (фторотан) – высокоактивное ингаляционное средство для наркоза, подвергается различным метаболическим превращениям в организме животных и
- 17. Последние данные указывают, что метаболизм галотана условно делится на два пути: включает окисление молекулы с образованием
- 18. 3. Реакции окисления. Альдегиддегидрогеназы (АлДГ) - окисление альдегидов до карбоновых кислот (кофактор НАД+). Дигидродиолдегидрогеназы - окисление
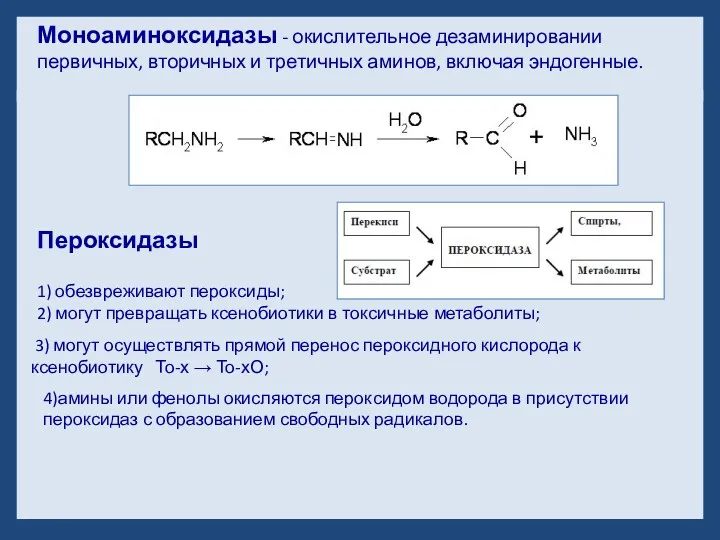
- 19. Пероксидазы 1) обезвреживают пероксиды; 2) могут превращать ксенобиотики в токсичные метаболиты; 3) могут осуществлять прямой перенос
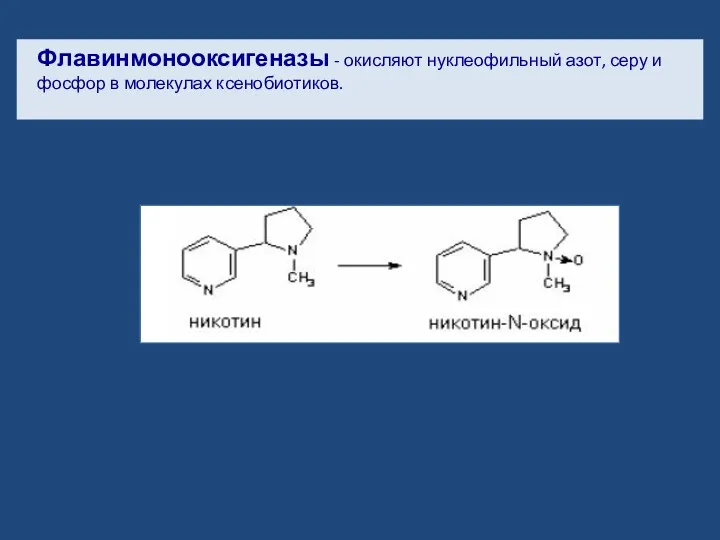
- 20. Флавинмонооксигеназы - окисляют нуклеофильный азот, серу и фосфор в молекулах ксенобиотиков.
- 21. Цитохром Р450 катализирует реакции окисления: -гидроксилирование алифатических и ароматических углеводородов; эпоксидирование двойной связи; окисление гетероатомов (О-,
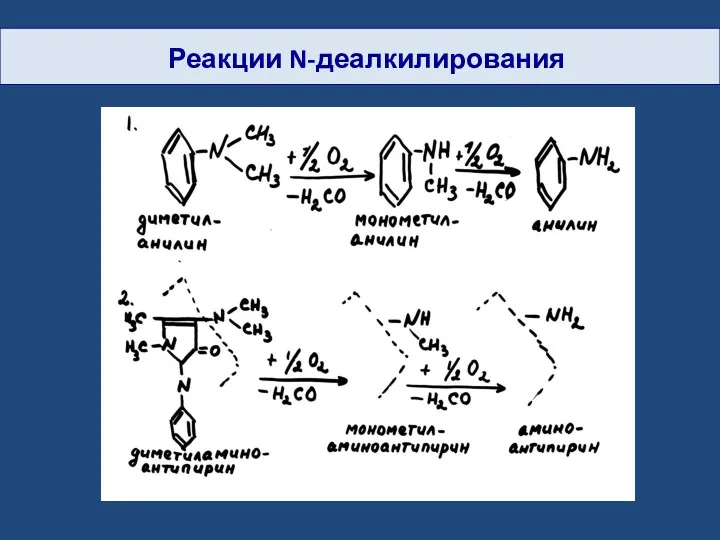
- 22. Реакции N-деалкилирования
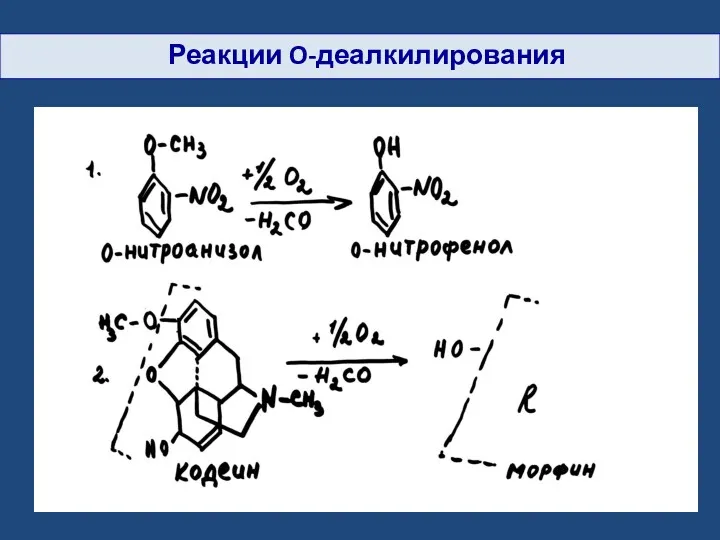
- 23. Реакции O-деалкилирования
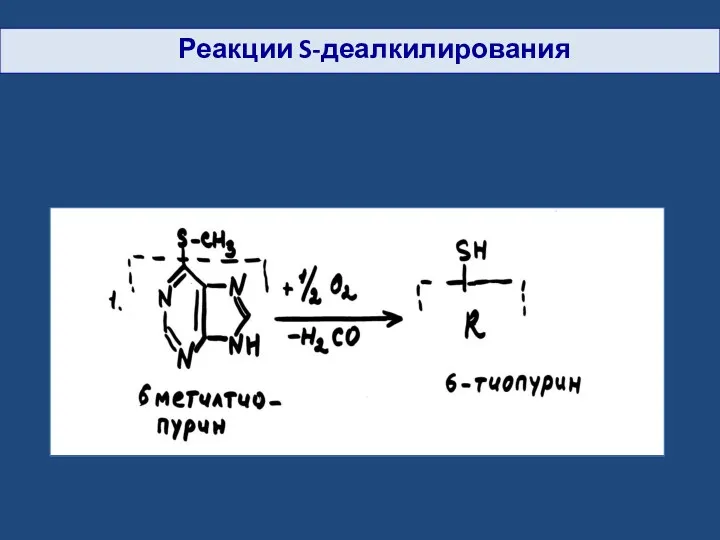
- 24. Реакции S-деалкилирования
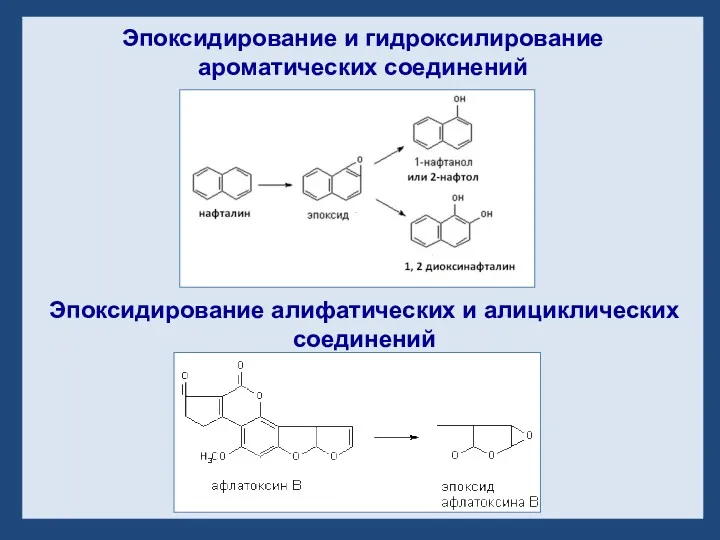
- 25. Эпоксидирование и гидроксилирование ароматических соединений Эпоксидирование алифатических и алициклических соединений
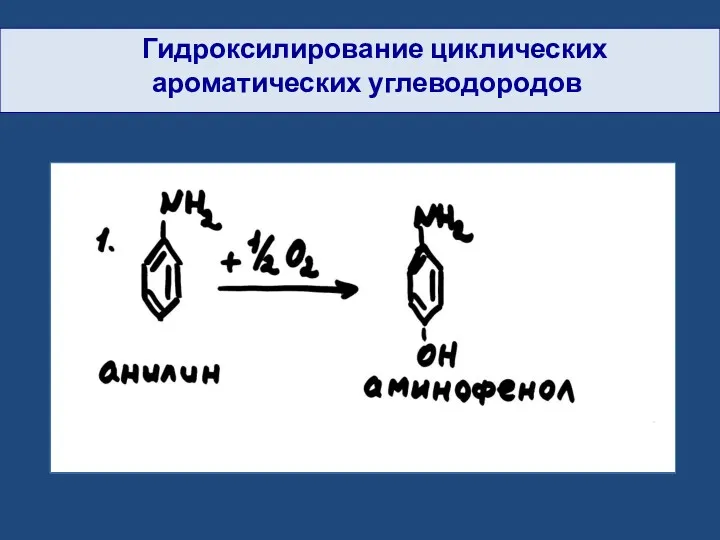
- 26. Гидроксилирование циклических ароматических углеводородов
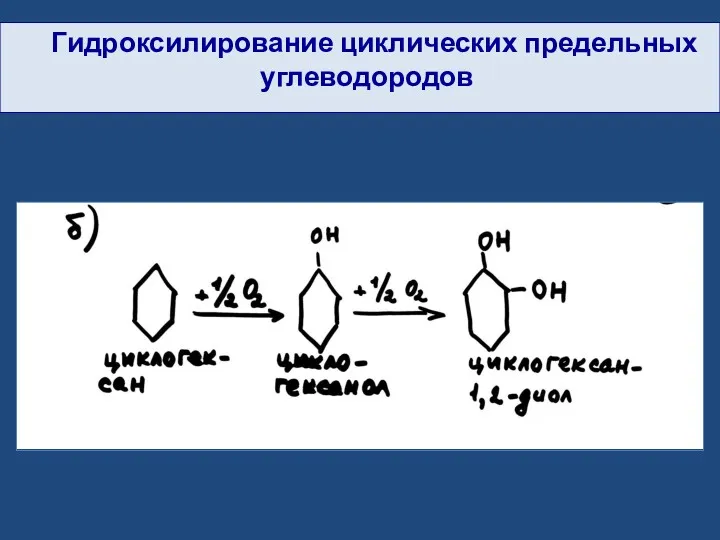
- 27. Гидроксилирование циклических предельных углеводородов
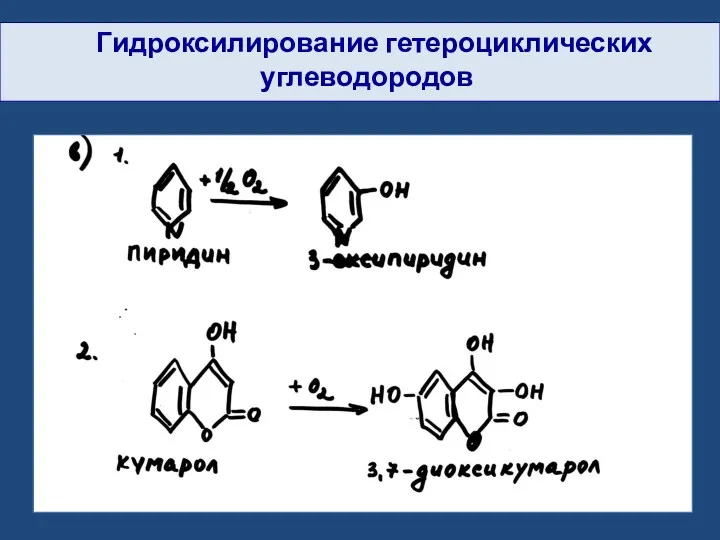
- 28. Гидроксилирование гетероциклических углеводородов
- 29. Гидроксилирование алифатических соединений: а) предельных углеводородов
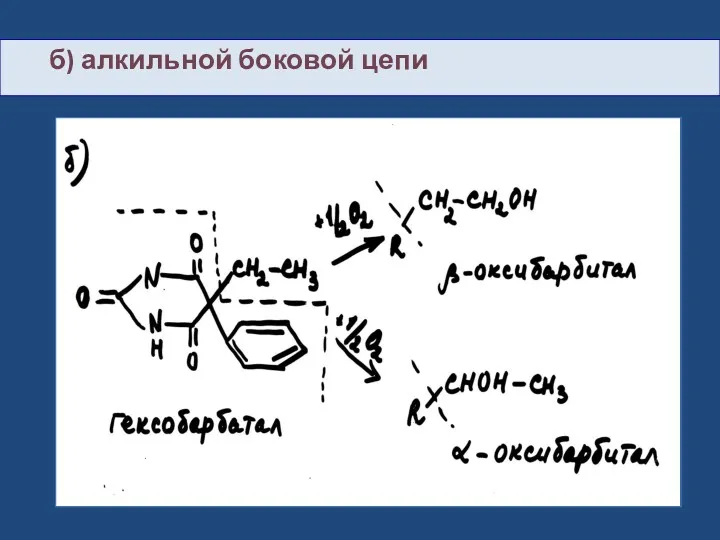
- 30. б) алкильной боковой цепи
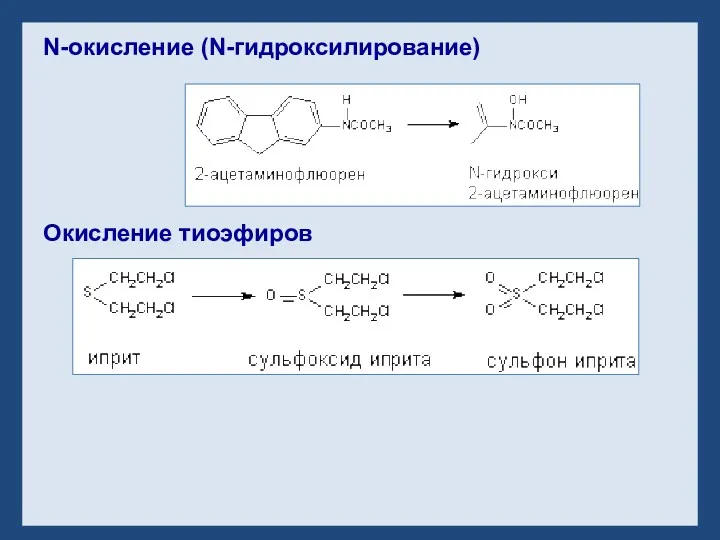
- 31. N-окисление (N-гидроксилирование) Окисление тиоэфиров
- 32. Обезвреживание этанола Поступивший в организм этанол кровью переносится во все органы и ткани организма. Его катаболизм
- 33. Окисление этанола NAD-зависимой алкогольдегидрогеназой Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения
- 34. Изоферменты алкогольдегидрогеназы. Класс I АДГ-изоферментов (α-АДГ, β- АДГ и γ - АДГ) – окисление этанола и
- 35. 2. Окисление этанола при участии цитохром Р450 - зависимой микросомальной этанолокисляющей системы Цитохром Р450-зависимая микросомальная этанолокисляющая
- 36. При хроническом алкоголизме окисление этанола ускоряется на 50 – 70 % за счёт гипертрофии ЭР и
- 37. 3. Окисление этанола каталазой Второстепенную роль в окислении этанола играет каталаза, находящаяся в пероксисомах. Этот фермент
- 38. Ацетальдегид, образовавшийся из этанола, окисляется до уксусной кислоты. Работают два фермента: 1) FAD -зависимая альдегидоксидаза: СН3СНО
- 39. 2) Ацетальдегиддегидрогеназа (АлДГ) – окисляет субстрат при участии кофермента NAD+. СН3СНО + Н2О + NAD+ →
- 40. Например, митохрондриальная изоформа АлДГ гепатоцитов, обладает более высоким сродством к ацетальдегиду (имеет низкую константу Михаэлиса КМ
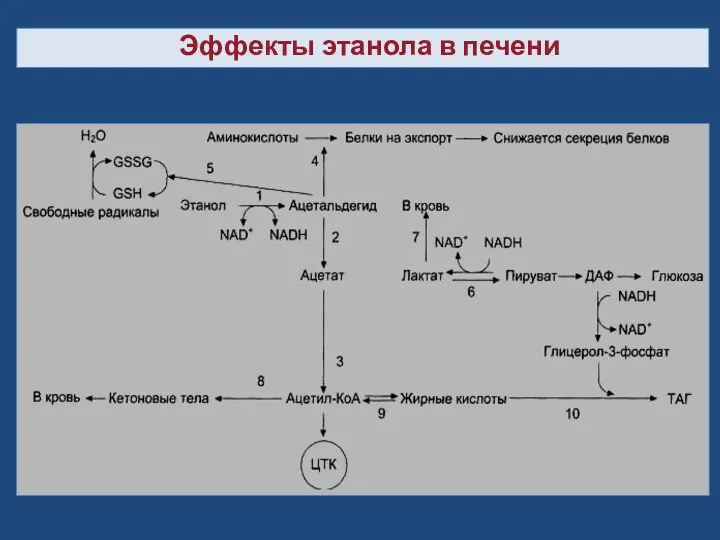
- 41. Эффекты этанола в печени
- 42. Эффекты этанола в печени (пояснение схемы). 1 → 2 → 3 - окисление этанола до ацетата
- 43. Следствия химической модификации молекулы ксенобиотика
- 44. Следствия химической модификации молекулы ксенобиотика
- 45. За возможность образования легко выводимого из организма вещества путем окисления моноаминоксидазами клетка «платит» образованием в ряде
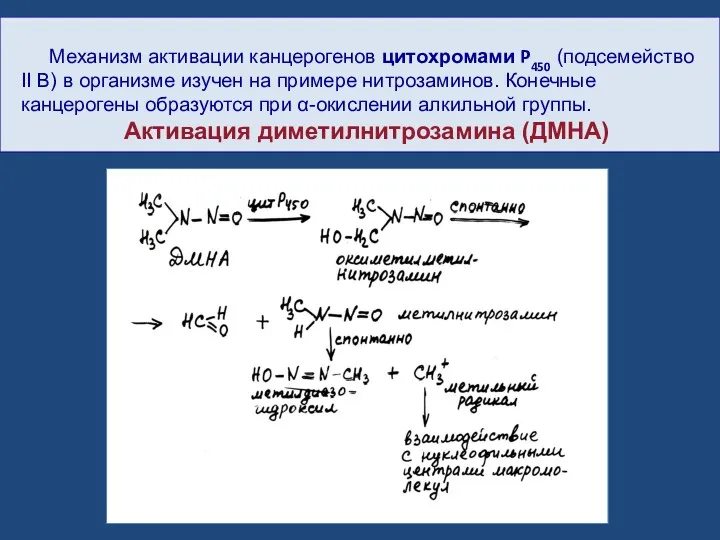
- 46. Механизм активации канцерогенов цитохромами P450 (подсемейство II В) в организме изучен на примере нитрозаминов. Конечные канцерогены
- 48. Скачать презентацию






















 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН