Слайд 2

Слайд 3

Слайд 4

Слайд 5
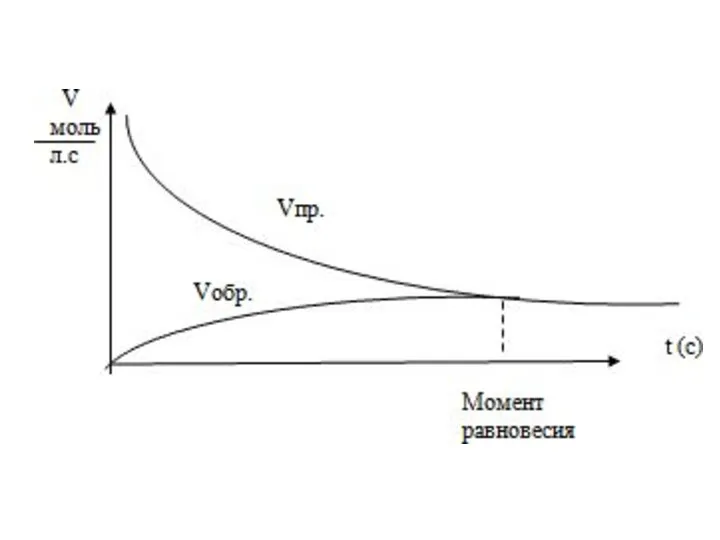
Слайд 6

Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной
реакции, называется химическим равновесием.
Слайд 7

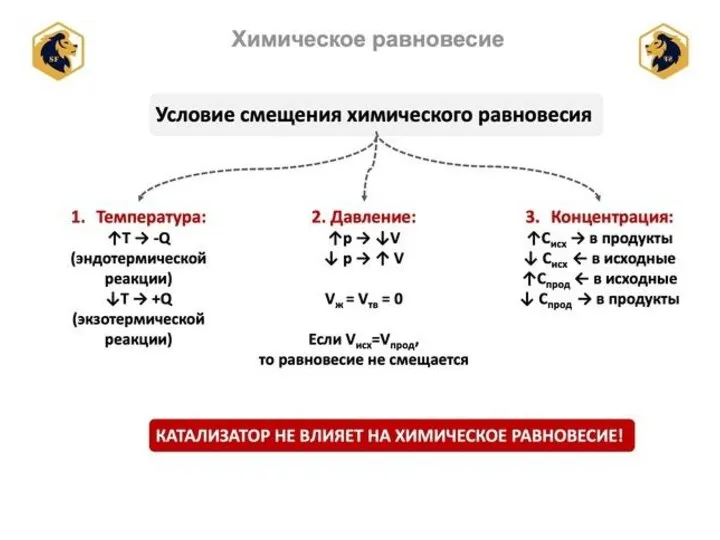
Факторы, которые могут приводить к смещению химического равновесия:
А) Концентрация реагирующих веществ.
Б) Температура.
В)
Давление.
Слайд 8

Влияние концентрации реагирующих веществ.
Повышение концентрации исходных веществ смещает равновесие в сторону
прямой реакции, понижение – в сторону обратной реакции.
Слайд 9

Влияние температуры.
При нагревании системы равновесие смещается в сторону эндотермической реакции; при
охлаждении в сторону экзотермической реакции.
Слайд 10

Влияние давления.
Давление влияет на равновесие реакций, в которых принимают участие газообразные
вещества. При увеличении давления равновесие смещается в сторону меньшего объема, при уменьшении давления равновесие смещается в сторону большего объема.
Слайд 11
Слайд 12

1.Обратимыми называются реакции, которые:
А. завершаются образованием нерастворимых веществ или газов
Б. происходят между
газообразными веществами
В. идут при одинаковых условиях в противоположных направлениях
Слайд 13

2. Повышение температуры:
А. не влияет на состояние равновесия
Б. увеличивает выход продуктов
экзотермической реакции
В. увеличивает выход продуктов эндотермической реакции
Слайд 14

3. Реакция протекает в соответствии с уравнением N2+3H2⇄2NH3+Q.
В какую сторону сместится равновесие, если снизить
температуру?
Слайд 15

4. Реакция протекает в соответствии с уравнением N2+O2⇄2NO−Q.
В какую сторону сместится равновесие, если увеличить
температуру?
Слайд 16

5. Реакция протекает в соответствии с уравнением N2(г)+3H2(г)⇄2NH3(г).
В какую сторону сместится равновесие
этой реакции, если увеличить давление?
Слайд 17

6. Реакция протекает в соответствии с уравнением 2CO(г)+O2(г)⇄2CO2(г).
В какую сторону сместится равновесие
этой реакции, если снизить давление?
Слайд 18

7. Реакция протекает в соответствии с уравнением SO2(г)+H2O(ж)⇄H2SO3(ж).
В какую сторону сместится равновесие
этой реакции, если увеличить давление?
Слайд 19

8. Реакция протекает в соответствии с уравнением SO2+H2O⇄H2SO3+Q.
В какую сторону сместится равновесие, если увеличить
концентрацию сернистого газа?
Слайд 20

9. Реакция протекает в соответствии с уравнением N2+O2⇄2NO−Q.
В какую сторону сместится равновесие, если уменьшить
концентрацию кислорода?



















 Соединения химических элементов
Соединения химических элементов Строение атома. Химическая связь
Строение атома. Химическая связь Лекция № 7. Конкурентные реакции у насыщенного атома
Лекция № 7. Конкурентные реакции у насыщенного атома Монокристаллы InSb. Свойства, выращивание, применение
Монокристаллы InSb. Свойства, выращивание, применение Железо и его соединения
Железо и его соединения Значення хімічних процесів у природі
Значення хімічних процесів у природі Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Распространенность химических элементов на земле и в космосе
Распространенность химических элементов на земле и в космосе Ізомери в природі
Ізомери в природі План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Химический элемент. Неон
Химический элемент. Неон Полимеры. Каучук
Полимеры. Каучук Ансамбль пор в реальном твердом теле
Ансамбль пор в реальном твердом теле Введение в коллоидную химию. Основные понятия и закономерности
Введение в коллоидную химию. Основные понятия и закономерности Синтетические каучуки и их применение
Синтетические каучуки и их применение Побутові хімікати
Побутові хімікати Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Свинец и цинк в природе
Свинец и цинк в природе Молекулы и атомы (часть 2)
Молекулы и атомы (часть 2) Защитно-декоративные покрытия
Защитно-декоративные покрытия Атомның электрондық конфегурациясы
Атомның электрондық конфегурациясы Карбонильные соединения
Карбонильные соединения Вода. Практическая работа
Вода. Практическая работа Растворы. Концентрация растворов
Растворы. Концентрация растворов Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Органическая химия. Пособие
Органическая химия. Пособие Фолий қышқылы (B9 дәрумені)
Фолий қышқылы (B9 дәрумені)