Содержание
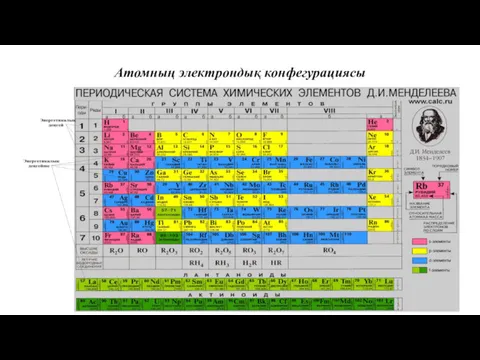
- 3. Атомның электрондық конфегурациясы
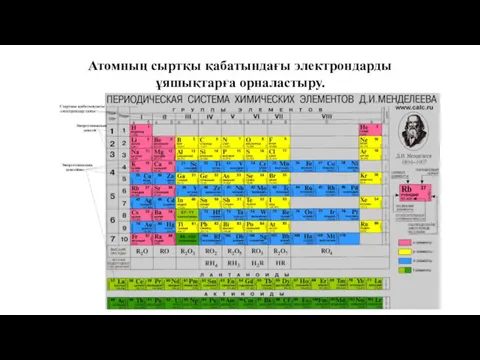
- 5. Атомның сыртқы қабатындағы электрондарды ұяшықтарға орналастыру.
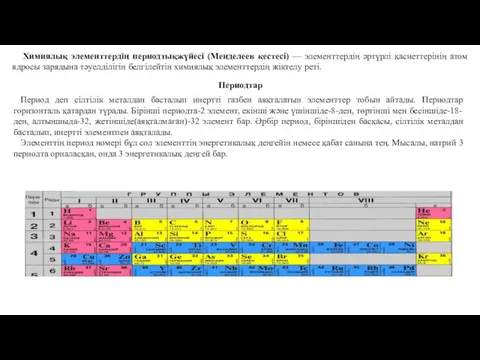
- 6. Химиялық элементтердің периодтықжүйесі (Менделеев кестесі) — элементтердің әртүрлі қасиеттерінің атом ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің
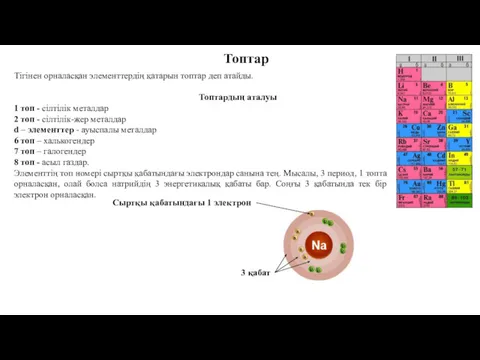
- 7. Тігінен орналасқан элементтердің қатарын топтар деп атайды. Топтардың аталуы 1 топ - сілтілік металдар 2 топ
- 8. Сыртқы қабаттағы электрондардың ұяшықтарға толтырылуы Валенттілік дегеніміз – бұл жұптакспаған электрондардың саны Натрий – тұрақты бір
- 9. Электрондық қабат
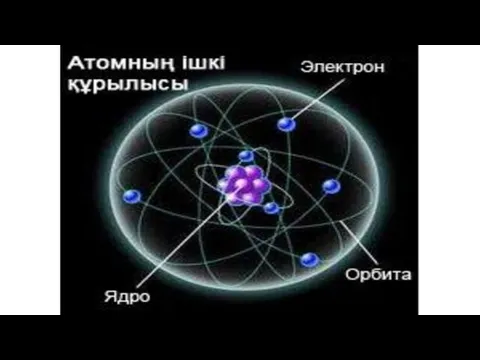
- 10. Элементтердің планетарлық моделі
- 11. Электрондық қабат
- 12. Бинарлы қосылыстарды атау Элементтердің заряды индекс Индекс – қосылыстың құрамында элементің мөлщерін көрсететін сан.
- 13. Бинарлы қосылыстарды атау алгоритімі
- 14. Заряд Оң + Теріс - Тұрақты Ауспалы
- 15. Римдік сандарды қолдану (IUPAC) Грек префиксі арқылы Катионның заряды тұрақты болған жағдайда екі әдісте қолданылмайды. Тек
- 16. Аниондардың аталуы Аниондардың латынша атауының соңына –ид жалғауы жалғанады.
- 17. Сутегі
- 18. Сутекті алу Өндірісте алу әдісі Лабораторияда алу әдістері Металл + қышқыл = тұз + сутегі Мырыш
- 19. Сутекті алу және анықтау
- 20. ПАХ! дыбысы Сутегіні анықтау
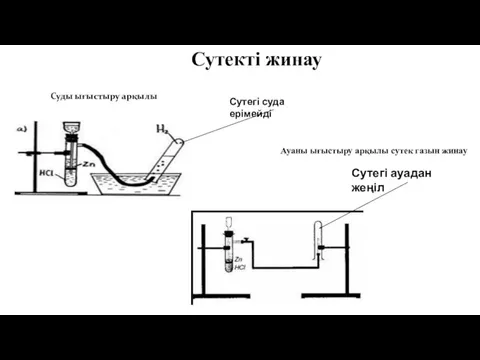
- 21. Сутекті жинау Суды ығыстыру арқылы Сутегі суда ерімейді Ауаны ығыстыру арқылы сутек газын жинау Сутегі ауадан
- 22. Сутегінің химиялық қасиеті Металл + сутегі = металл гидриді Натрий + сутегі = натрий гидриді Кальций
- 23. Оттегі
- 24. O2 өнеркәсіпте алу Өнеркәсіпте көп мөлшерде оттегіні ауадан алады. Өнеркәсіпте алу үшін ауаны шаң – тозаңнан,
- 25. Оттегін зертханада алу Алғаш рет оттек газын 1771ж К.В. Шееле зертханада сынап оксидін айыру арқылы алған
- 26. Лабораторияда оттектің аз мөлшерін калий перманганатын қыздыру арқылы алады (KMnO4): Калий перманганаты = калий манганаты +
- 27. Оттекті тағы басқа оттек бар қосылыстардан алады: 2 KClO3 = 2 KCl + 3O2↑ Калий хлораты
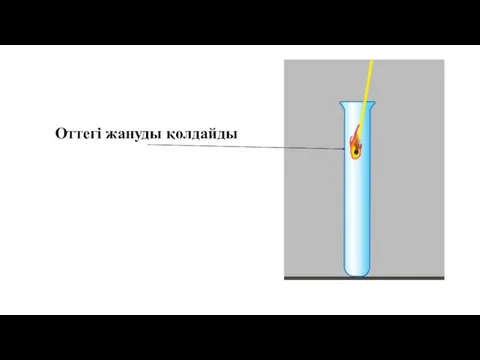
- 29. Оттегі жануды қолдайды
- 30. Оттегінің химиялық қасиеті Металл + оттегі = металл оксиді (негіздік оксид) Натрий + оттегі = натрий
- 31. Оттегі және озон
- 32. Оттегінің аллотропиялық түр өзгерістері. Озон Оттегі табиғатта екі түрлі жай зат күйінде кездеседі, оның бірі O2,
- 33. Атмосфераның жоғары қабатында, жерден 25 км биіктікте (стратосферада) күн сәулесінің әсерінен жерді қорғап тұратын өте жұқа
- 34. Жылдамдық дегеніміз?
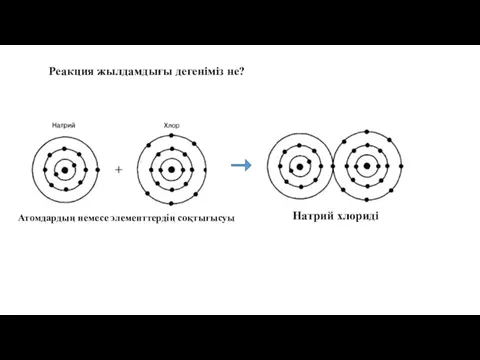
- 35. Реакция жылдамдығы дегеніміз не? Атомдардың немесе элементтердің соқтығысуы Натрий хлориді
- 36. Химиялық реакцияның жылдамдығы
- 37. Химиялық реакцияның жылдамдығы
- 38. Химиялық реакцияның жылдамдығына әсер ететін факторлар 1. Концентрацияның әсері (Бөлшектер саны, өлшем бірлігі {моль/л}) Бөлшектер саны
- 39. Ерітіндінің концентрациясын есептеу
- 40. Реакция жылдамдығының концентрацияға тәуелділігі
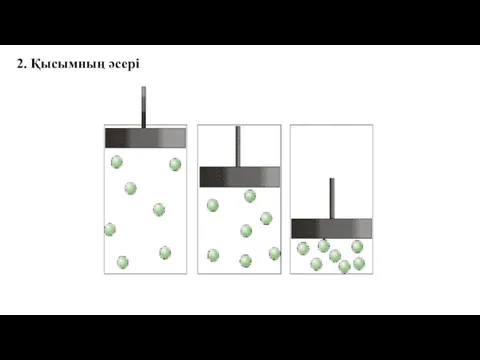
- 41. 2. Қысымның әсері
- 42. 3. Реагенттердің табиғатының әсері
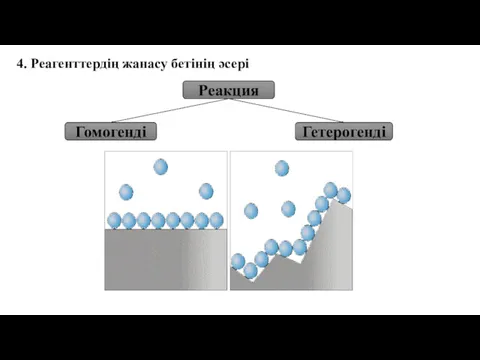
- 43. 4. Реагенттердің жанасу бетінің әсері Реакция Гомогенді Гетерогенді
- 44. Реакция жылдамдығының жанасу бетінің ауданына тәуелділігі
- 45. 5. Температураның әсері http://www.chem.msu.su/rus/teaching/Kinetics-online/flash/ill2_rus.swf
- 46. Вант – Гофф ережесі
- 48. Скачать презентацию




























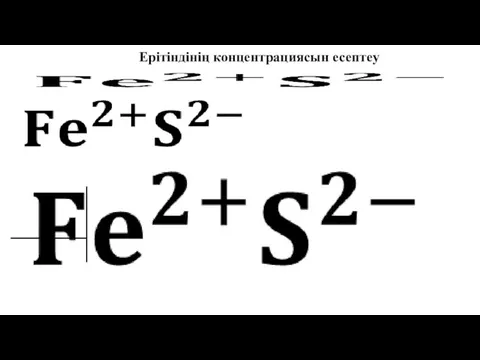




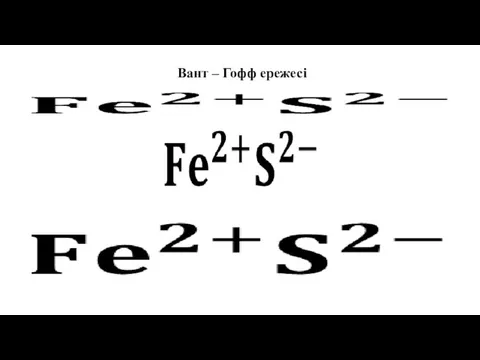
 Азотная кислота и её соли
Азотная кислота и её соли Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия Химия и здоровье
Химия и здоровье Классификация химических реакций по различным основаниям. 9 класс
Классификация химических реакций по различным основаниям. 9 класс Галогены. 9 класс
Галогены. 9 класс Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Алкины. Химические и физические свойства алкинов. Строение алкинов
Алкины. Химические и физические свойства алкинов. Строение алкинов Теория электролитической диссоциации
Теория электролитической диссоциации Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів
Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів Основные классы неорганических соединений
Основные классы неорганических соединений Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Apparatus of installations with circulating ball catalyst
Apparatus of installations with circulating ball catalyst Посуда, ее виды и использование
Посуда, ее виды и использование Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Азот
Азот Штучні та природні речовини
Штучні та природні речовини Многоатомные спирты (10 класс)
Многоатомные спирты (10 класс) Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Механические свойства минералов
Механические свойства минералов Альдегиды и кетоны
Альдегиды и кетоны Геохимические классификации элементов
Геохимические классификации элементов Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Дробный метод анализа металлических ядов в минерализате (деструктате) (Продолжение)
Дробный метод анализа металлических ядов в минерализате (деструктате) (Продолжение) Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Пироксены. Группа пироксенов
Пироксены. Группа пироксенов Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Вода - розчинник. Урок 41
Вода - розчинник. Урок 41