Содержание
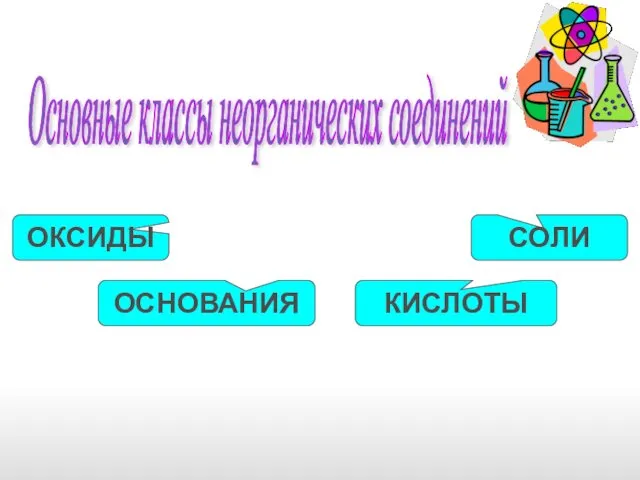
- 2. Основные классы неорганических соединений ОКСИДЫ ОСНОВАНИЯ КИСЛОТЫ СОЛИ
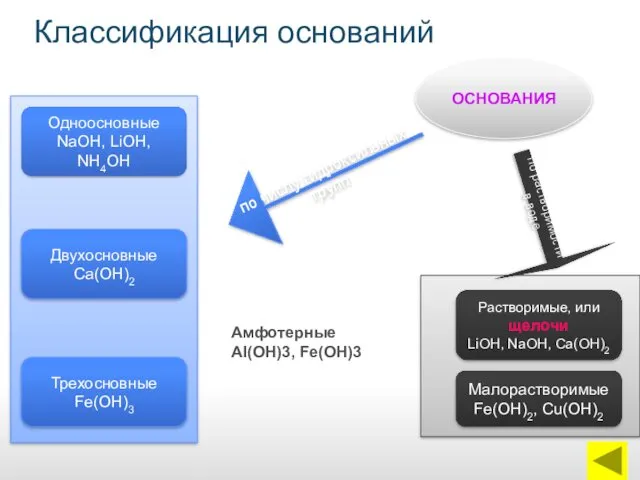
- 5. Классификация оснований ОСНОВАНИЯ Одноосновные NaОН, LiОН, NН4ОН Двухосновные Са(ОН)2 Трехосновные Fe(ОН)3 Растворимые, или щелочи LiОН, NаОН,
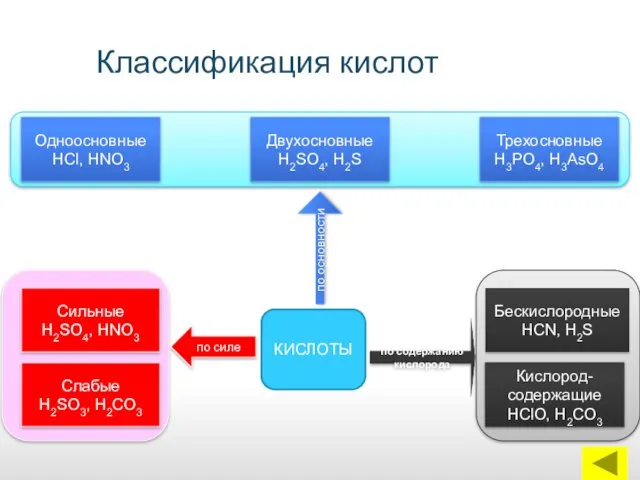
- 6. Классификация кислот КИСЛОТЫ Одноосновные НСl, НNО3 Сильные Н2SO4, НNО3 Слабые Н2SО3, Н2СО3 Кислород-содержащие НСlО, Н2СО3 Бескислородные
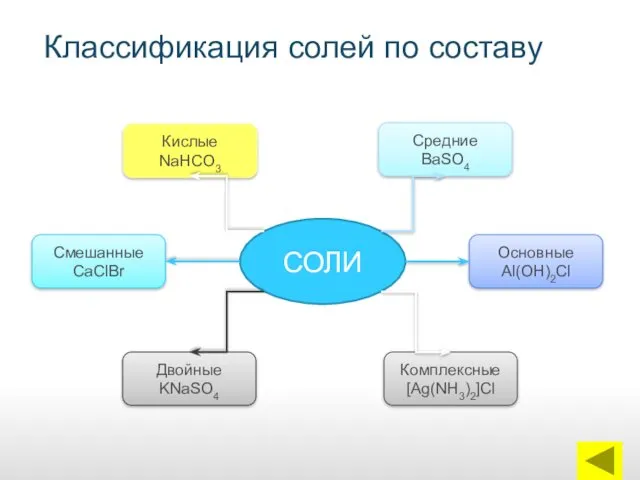
- 7. Классификация солей по составу СОЛИ Кислые NaHCO3 Смешанные CaClBr Двойные KNaSO4 Средние BaSO4 Основные Al(OH)2Cl Комплексные
- 9. ПОЛУЧЕНИЕ ОСНОВАНИЙ Взаимодействие активных металлов с водой Me + Н2O = МеОН + Н2 Взаимодействие оксидов
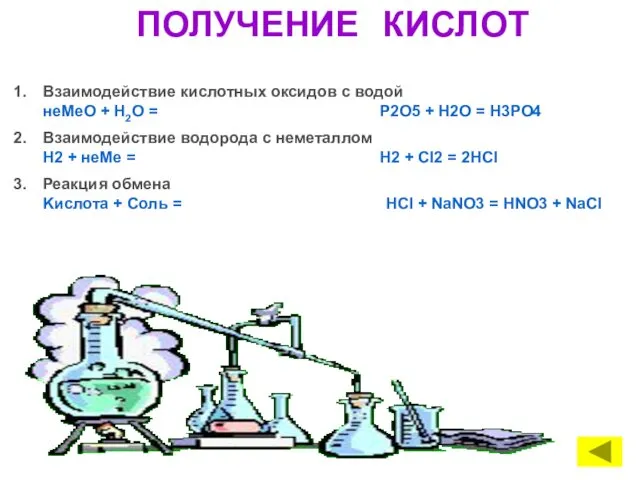
- 10. ПОЛУЧЕНИЕ КИСЛОТ Взаимодействие кислотных оксидов с водой неMeО + Н2O = P2O5 + H2O = H3PO4
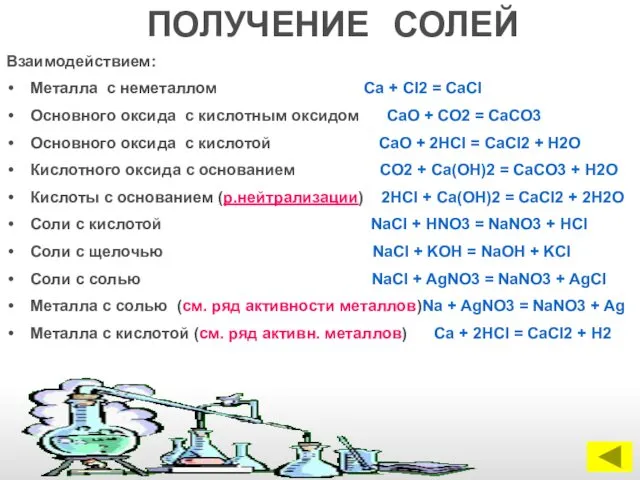
- 11. ПОЛУЧЕНИЕ СОЛЕЙ Взаимодействием: Металла с неметаллом Са + Сl2 = СаСl Основного оксида с кислотным оксидом
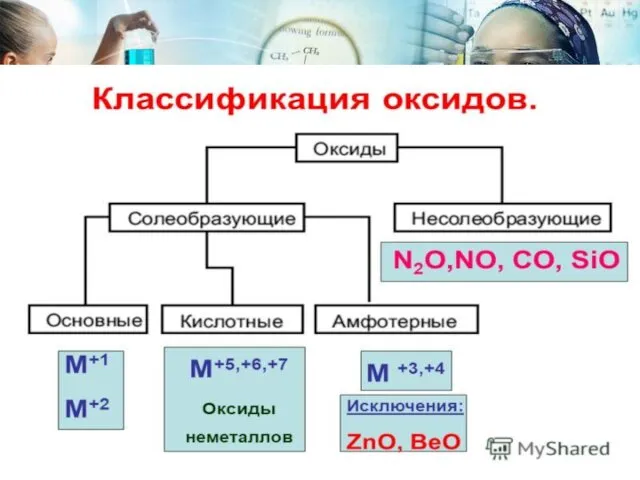
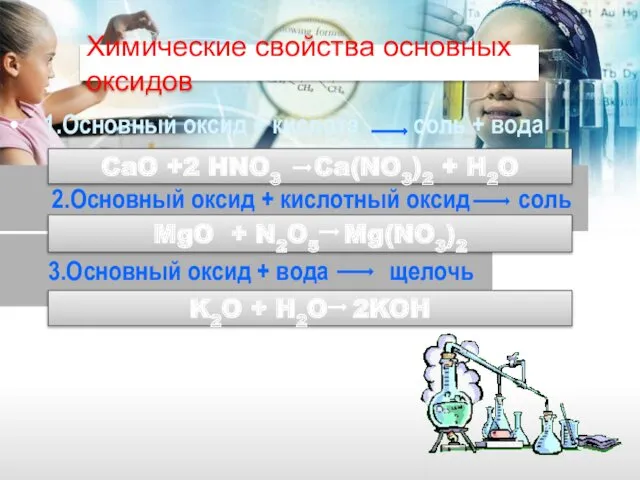
- 12. Химические свойства основных оксидов 1.Основный оксид + кислота соль + вода 2.Основный оксид + кислотный оксид
- 13. Химические свойства кислотных оксидов 1.Кислотный оксид + основание соль + вода 2.Кислотный оксид+ основный оксид соль
- 14. Химические свойства амфотерных оксидов 1.Взаимодействуют с сильными кислотами ZnO + 2HCl ZnCl2 + H2O Основный оксид
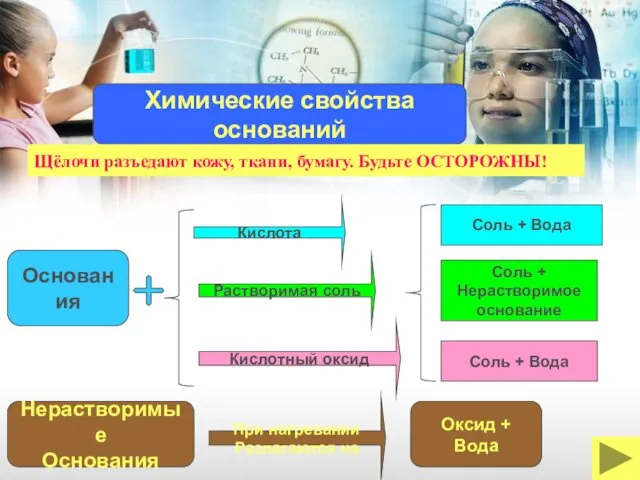
- 15. Кислота Основания Растворимая соль Кислотный оксид Соль + Вода Соль + Нерастворимое основание Соль + Вода
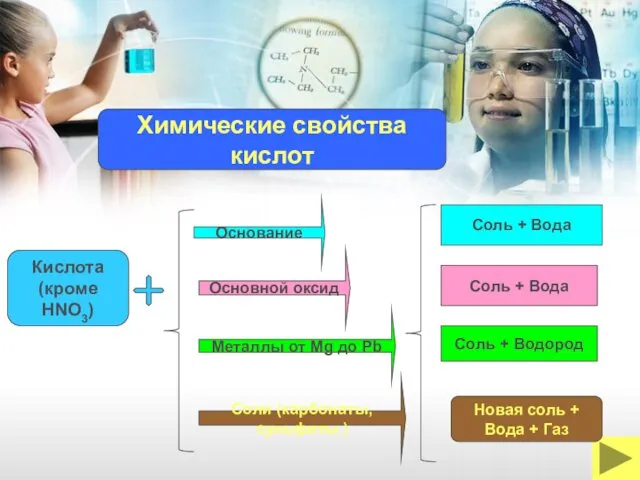
- 16. Основание Кислота (кроме HNO3) Металлы от Mg до Pb Основной оксид Соль + Вода Соль +
- 17. ТБ при работе с кислотами Запомни правило: «Сначала вода, потом кислота, иначе произойдет ужасное». Если же
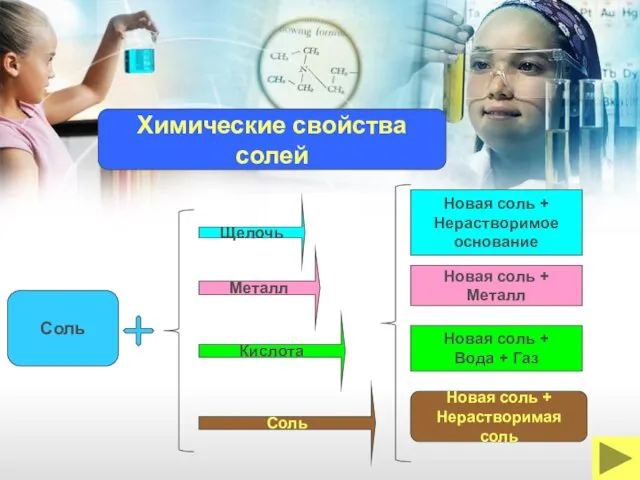
- 19. Щелочь Соль Кислота Металл Новая соль + Нерастворимое основание Новая соль + Вода + Газ Новая
- 20. Применение оксидов Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо. Песок, состоящий
- 25. Скачать презентацию







 Рождение органической химии
Рождение органической химии Химические свойства металлов
Химические свойства металлов Чистые вещества и смеси
Чистые вещества и смеси Осмий. Нахождение в природе
Осмий. Нахождение в природе Корбонаттар көмір қышқылынның тұздары
Корбонаттар көмір қышқылынның тұздары Соли. Свойства солей
Соли. Свойства солей Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Бутадиеновые каучуки
Бутадиеновые каучуки Алюминий
Алюминий Phosphorus
Phosphorus Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Получение и применение спиртов
Получение и применение спиртов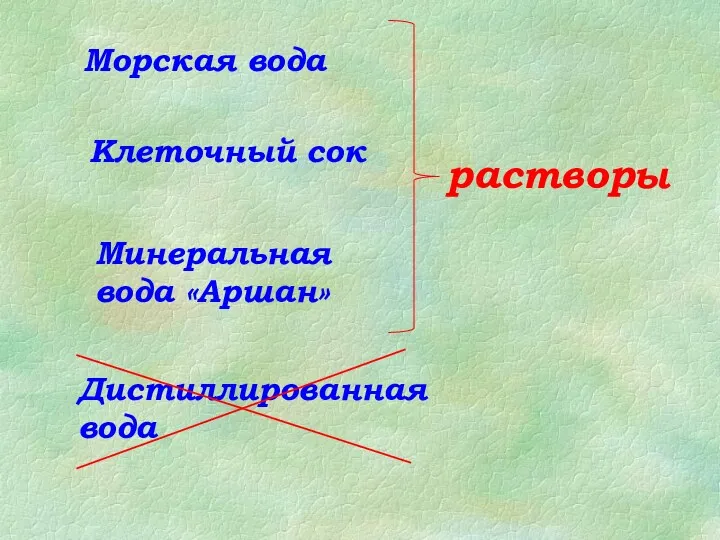 Растворы и растворители
Растворы и растворители Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей
Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей ВОДОРОД
ВОДОРОД Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5
Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5 Многоатомные спирты (10 класс)
Многоатомные спирты (10 класс) Хлор
Хлор Аминокислоты и белки
Аминокислоты и белки Строение атома
Строение атома Химия в повседневной жизни человека
Химия в повседневной жизни человека Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Обмен липидов
Обмен липидов Свойства катализатора. Влияние массы катализатора на скорость реакции
Свойства катализатора. Влияние массы катализатора на скорость реакции Нефть и способы её переработки
Нефть и способы её переработки