Содержание
- 2. Неметаллы: общая характеристика. 9 класс
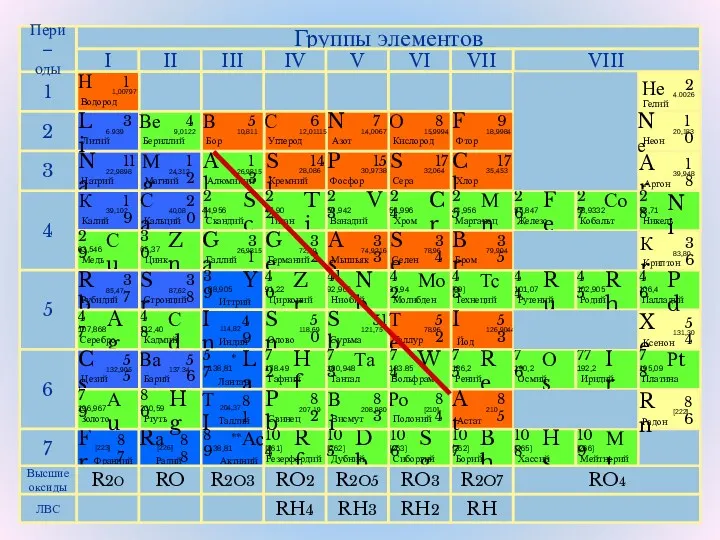
- 3. Вопросы для повторения: Положение неметаллов в ПС Строение атомов неметаллов Кристаллическое строение неметаллов – простых веществ
- 4. Не
- 5. Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных
- 6. Для вещества с ковалентной связью характерны два типа кристаллических решеток (совокупность точек пространства, в которых располагаются
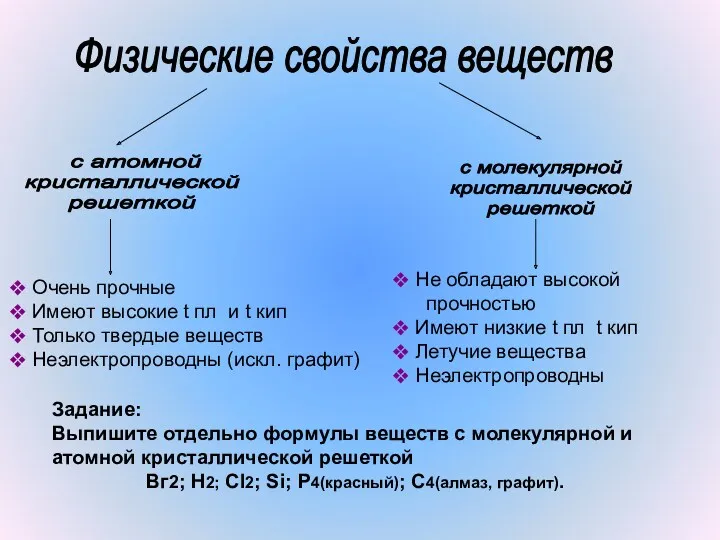
- 7. Физические свойства веществ с атомной кристаллической решеткой с молекулярной кристаллической решеткой Не обладают высокой прочностью Имеют
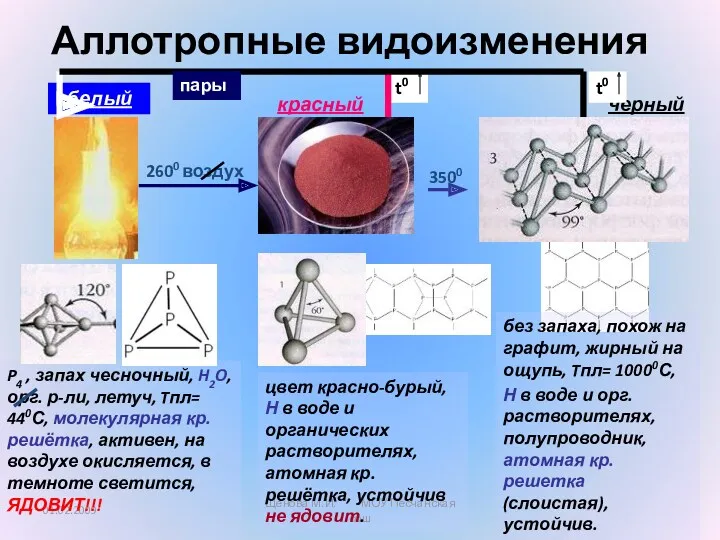
- 8. Аллотро́пия— существование одного и того же химического элемента в виде двух и более простых веществ, различных
- 9. 1. Различное число атомов элемента в молекулах простых веществ кислород озон 2.Различное строение кристаллической решетки. Причины
- 10. Графит Алмаз Графит и алмаз состоят из углерода.
- 11. 01.02.2009 Щенова М.И. МОУ Песчанская сош Аллотропные видоизменения P4 , запах чесночный, H2O, орг. р-ли, летуч,
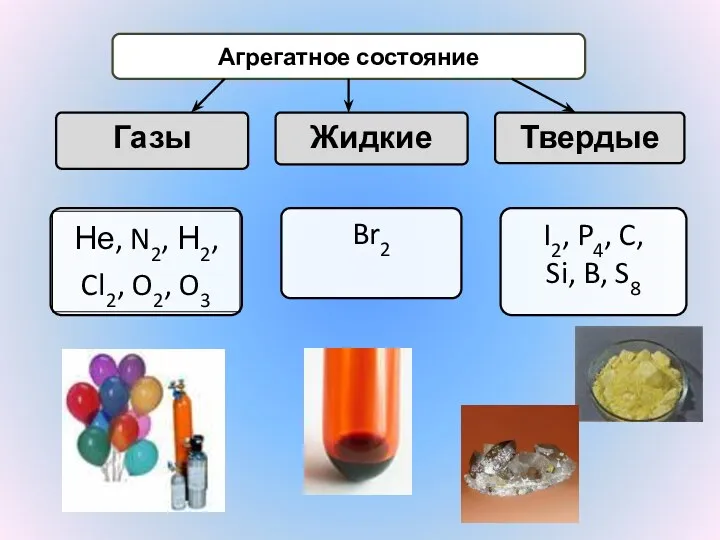
- 13. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
- 14. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8
- 15. Цвет неметаллов БЕЛЫЙ ЧЕРНЫЙ ФОСФОР ФОСФОР ГРАФИТ ЖЕЛТО-ЗЕЛЕНЫЙ ХЛОР
- 16. Цвет неметаллов КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
- 17. Химические свойства Неметаллы – окислители. Э0 + nē → Э-n а) с металлами Na + S
- 18. 1) Элементы-неметаллы расположены в главных подгруппах IV-VII групп ПС Д.И. Менделеева, занимая её верхний правый угол.
- 20. Скачать презентацию













 Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Растворение. Растворы. Физическая теория
Растворение. Растворы. Физическая теория Ртуть
Ртуть Электронные представления в химии
Электронные представления в химии Щелочные породы среднего состава
Щелочные породы среднего состава Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Виды соли и ее значение в питании
Виды соли и ее значение в питании Оксид цинка
Оксид цинка Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не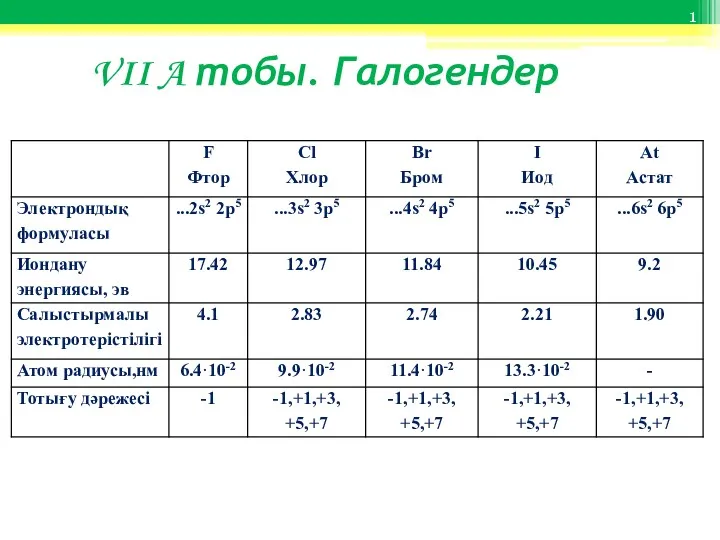 VII A тобы. Галогендер
VII A тобы. Галогендер Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Методы получения нанопорошков
Методы получения нанопорошков Химия и искусство
Химия и искусство Строение атома
Строение атома Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Кристаллические решетки
Кристаллические решетки Фосфор и его соединения
Фосфор и его соединения Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Неметаллы
Неметаллы Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6 IV группа (побочная подгруппа)
IV группа (побочная подгруппа) Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Кислород и оксиген
Кислород и оксиген Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов Композиционные материалы: углепластик, стеклопластик
Композиционные материалы: углепластик, стеклопластик