Содержание
- 2. Верите ли Вы,что...
- 3. Металлы занимают верхний левый угол в ПСХЭ. В кристаллах атомы металла связаны металлической связью. Валентные электроны
- 4. Ме0 – ne → Me+n Ме0 – восстановитель Простые вещества (+О2, Сl2, S…) Сложные вещества (Н2О,
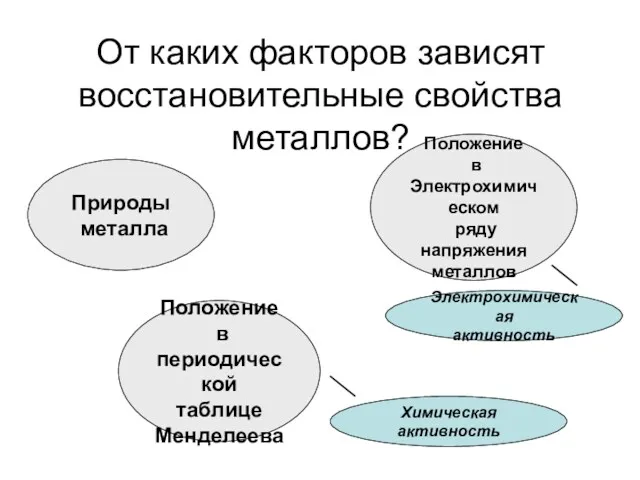
- 5. От каких факторов зависят восстановительные свойства металлов? Природы металла Положение в Электрохимическом ряду напряжения металлов Положение
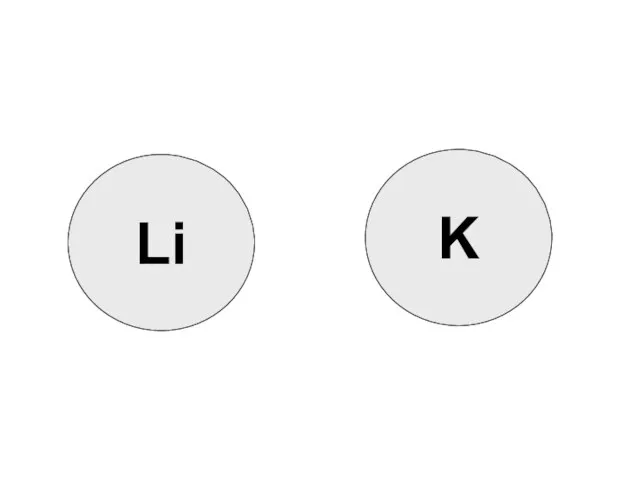
- 6. K Li
- 7. Химическая активность Изменение Rатома и Еионизации. Определяет восстановительную активность металлов в химических реакциях, протекающих в водных
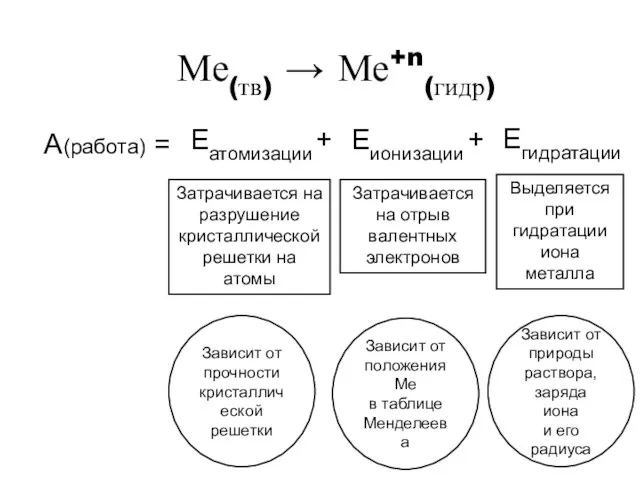
- 8. Ме(тв) → Ме+n(гидр) А(работа) = Еатомизации Еионизации Егидратации Затрачивается на разрушение кристаллической решетки на атомы +
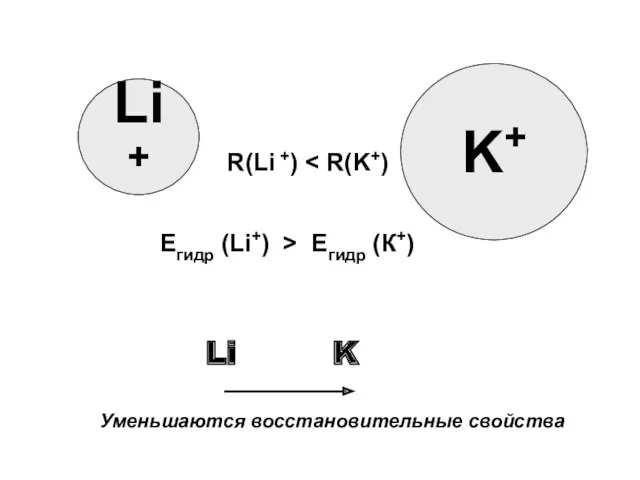
- 9. K+ Li+ R(Li +) Eгидр (Li+) > Eгидр (К+) K Уменьшаются восстановительные свойства Li
- 10. БЕКЕТОВ НИКОЛАЙ НИКОЛАЕВИЧ (1827–1911), русский физикохимик. 1863 год Вытеснительный ряд металлов академик Петербургской Академии наук. Применим
- 11. ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li K Ba Sr Ca Na Mg Al Zn Cr Fe Cd
- 12. Практическая работа. «Взаимодействие металлов с растворами солей.» 1. СuSO4 → FeSO4 2. СuSO4 → ZnSO4 “Единственный
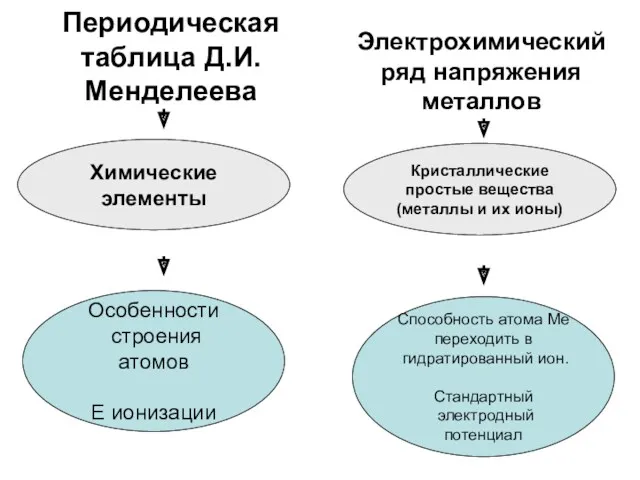
- 13. Периодическая таблица Д.И.Менделеева Электрохимический ряд напряжения металлов Химические элементы Кристаллические простые вещества (металлы и их ионы)
- 14. 6. Чтобы оценить реакционную способность металла в растворах солей достаточно посмотреть в электрохимический ряд напряжения металлов.
- 15. Домашнее задание. Повторить из курса физики понятие «ПОТЕНЦИАЛ»; Закончить уравнение реакции, написать уравнения электронного баланса: Сu
- 17. Скачать презентацию


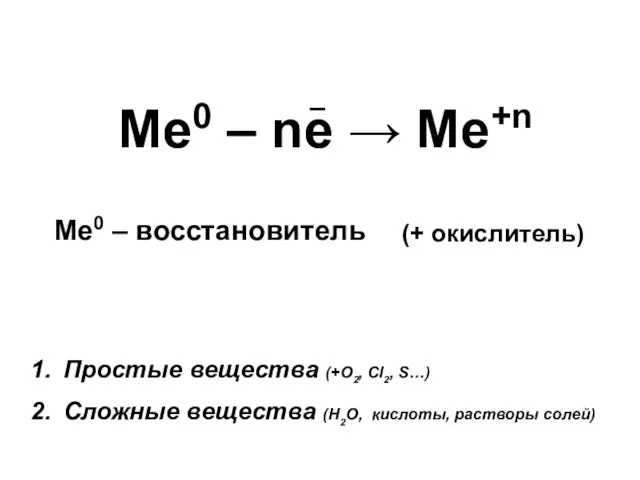






 Барий. Щелочноземельные металлы
Барий. Щелочноземельные металлы Типы химических реакций
Типы химических реакций Коллигативные свойства растворов
Коллигативные свойства растворов Характеристика элементов VIII-В группы. Семейство железа
Характеристика элементов VIII-В группы. Семейство железа Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас)
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас) Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Мир камня. Чувашский национальный музей
Мир камня. Чувашский национальный музей Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Камни и Скорпион
Камни и Скорпион Хімічні властивості кислот
Хімічні властивості кислот Твердые вещества
Твердые вещества Кислотно-основные свойства органических соединений
Кислотно-основные свойства органических соединений Симметрия в химии. Кристаллы
Симметрия в химии. Кристаллы Алюминий туралы мәлімет
Алюминий туралы мәлімет Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока Получение и химические свойства оснований
Получение и химические свойства оснований Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений Химическая кинетика
Химическая кинетика 20231012_metally.fizicheskie_svoystva
20231012_metally.fizicheskie_svoystva Кристаллическая решетка
Кристаллическая решетка Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Азот и его соединения
Азот и его соединения Химические элементы в организме человека
Химические элементы в организме человека Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Изучение зависимости между химическим составом, структурой и свойствами чугунов
Изучение зависимости между химическим составом, структурой и свойствами чугунов Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов