Содержание
- 2. ВОПРОСЫ К УРОКУ - определение «основание» - какие основания относятся к щелочам? - как составляются формулы
- 3. ЗАДАНИЕ Среди формул веществ выберите формулы оснований: HNO₃ , CaO , KOH , Na₂CO₃ , SO₃
- 4. ПОЛУЧЕНИЕ РАСТВОРИМЫХ ОСНОВАНИЙ (ЩЕЛОЧЕЙ) а) взаимодействие металла с водой (Li, K, Na, Ca, Ba) металл +
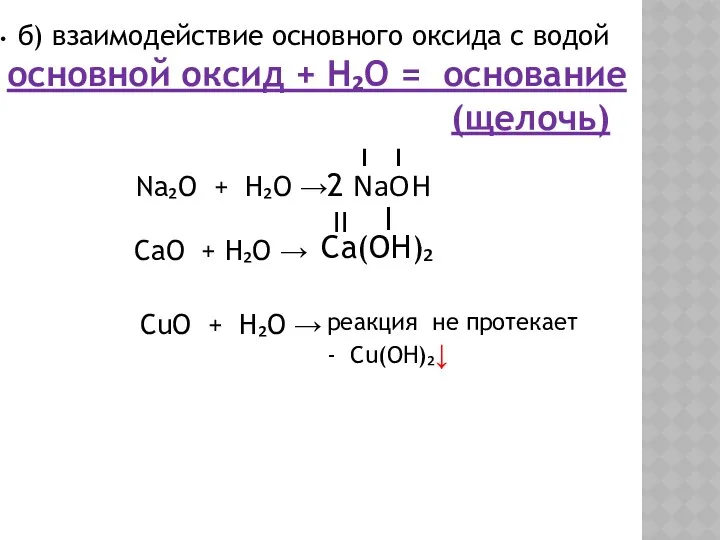
- 5. б) взаимодействие основного оксида с водой основной оксид + H₂O = основание (щелочь) Na₂O + H₂O
- 6. ПОЛУЧЕНИЕ НЕРАСТВОРИМЫХ ОСНОВАНИЙ соль + щелочь = новая соль + основание↓ CuCl₂ + KOH → KCl
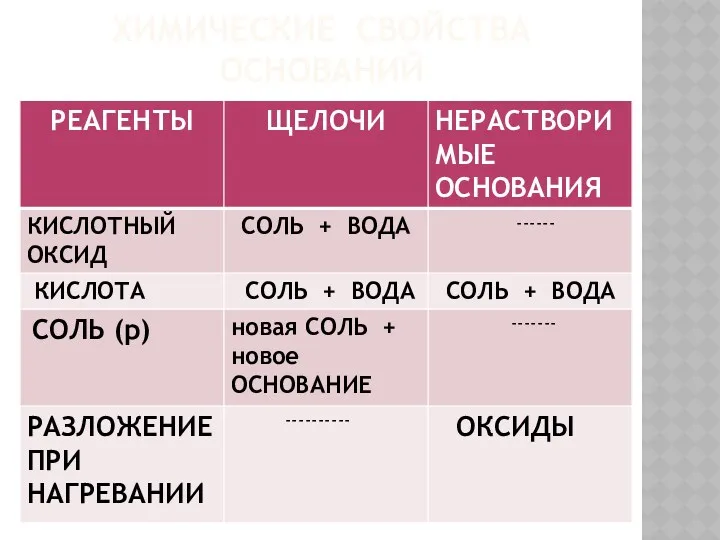
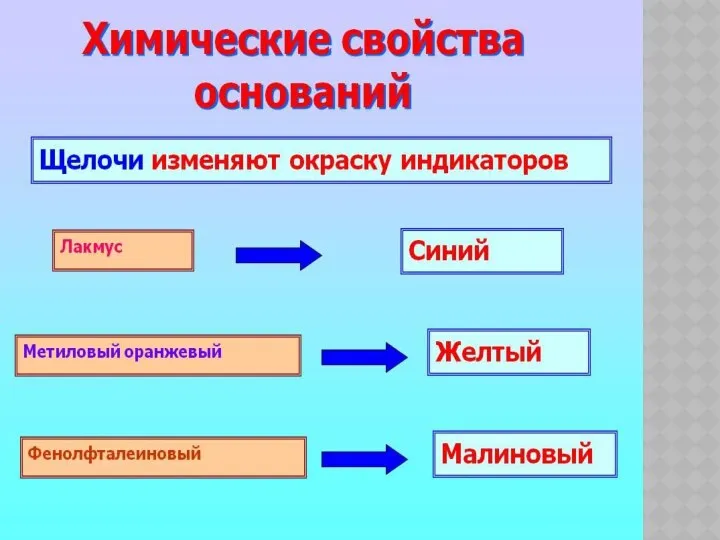
- 7. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
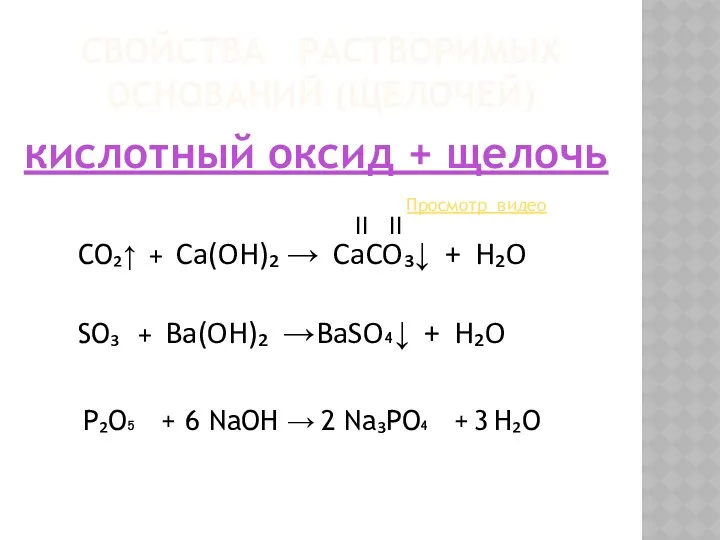
- 9. СВОЙСТВА РАСТВОРИМЫХ ОСНОВАНИЙ (ЩЕЛОЧЕЙ) кислотный оксид + щелочь Просмотр видео CO₂↑ + Ca(OH)₂ → CaCO₃↓ +
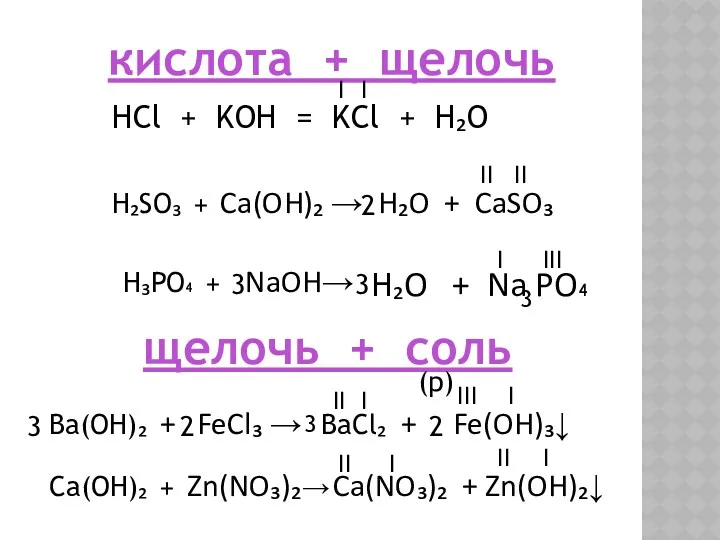
- 10. кислота + щелочь HCl + KOH = KCl + H₂O I I H₂SO₃ + Ca(OH)₂ →
- 11. СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ основание + кислота (сильная) (нерастворимое) Fe(OH)₂ + HCl → H₂O + FeCl II
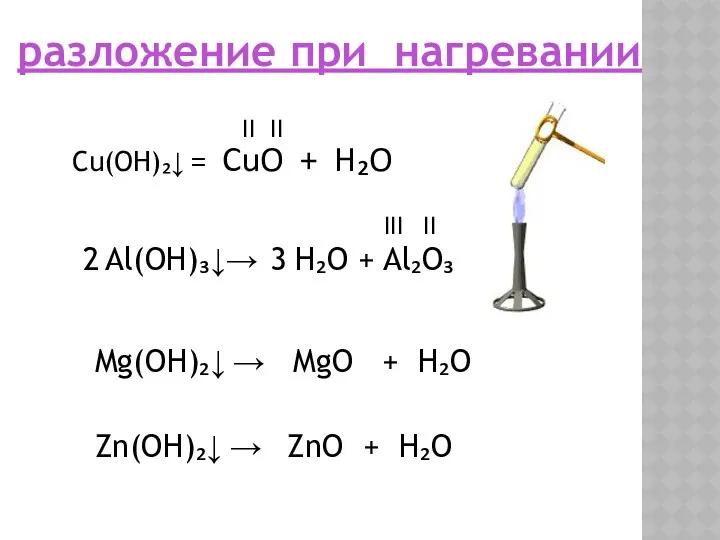
- 12. разложение при нагревании Cu(OH)₂↓ = CuO + H₂O II II Al(OH)₃↓→ H₂O + Al₂O₃ 2 3
- 13. ТЕСТ 1. К основаниям относится каждое из двух веществ: а) Na₂SO₄, H₂S б) KOH, CO₂ в)
- 15. Скачать презентацию






 Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс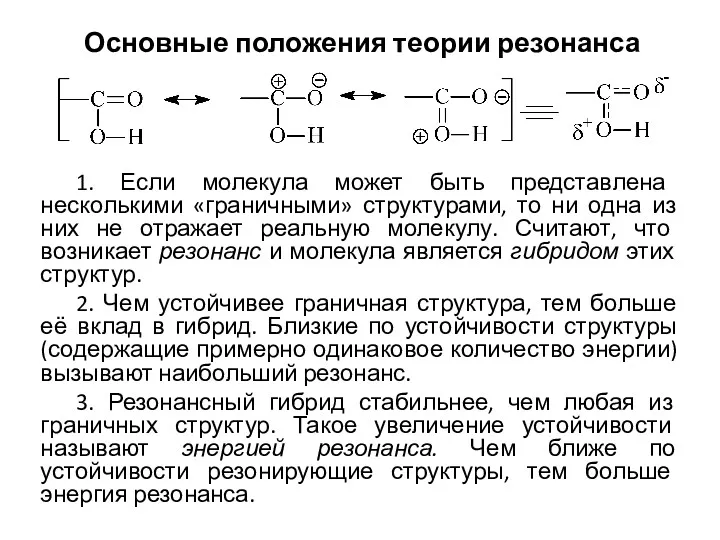 Основные положения теории резонанса
Основные положения теории резонанса Сера и ее соединения
Сера и ее соединения Массовая доля химического элемента
Массовая доля химического элемента Вяжущие вещества
Вяжущие вещества Химическая промышленность России
Химическая промышленность России Гідроліз солей
Гідроліз солей Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Химический элемент кремний
Химический элемент кремний Полимеры, бумага
Полимеры, бумага Количество вещества. Моль
Количество вещества. Моль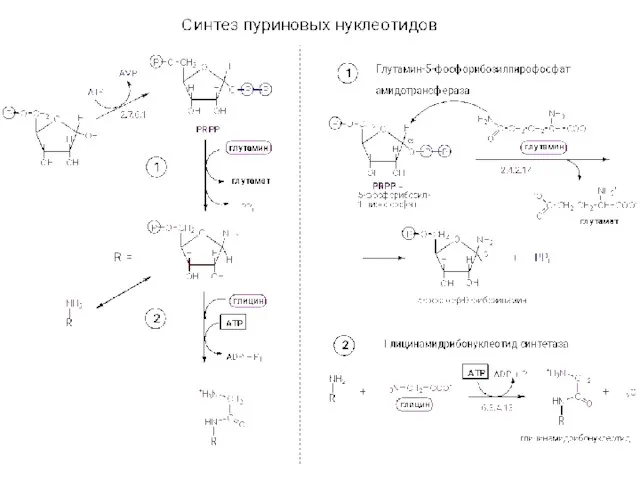 Синтез нуклеотидов
Синтез нуклеотидов Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Целлюлоза
Целлюлоза Алкины. Ацетилены
Алкины. Ацетилены Введение в химическую термодинамику
Введение в химическую термодинамику Biomass Feedstocks
Biomass Feedstocks Коллигативные свойства растворов
Коллигативные свойства растворов Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Тренинг. Практическая химия (8-9 классы)
Тренинг. Практическая химия (8-9 классы) Лекция 7. Кислотно-основное равновесие в растворах
Лекция 7. Кислотно-основное равновесие в растворах Алканы. Гомологи
Алканы. Гомологи Контроль качества пищевых товаров
Контроль качества пищевых товаров Электрохимические процессы
Электрохимические процессы