Содержание
- 2. Основания (гидроксиды) – это сложные вещества, состоящие из ионов металла и связанных с ними гидроксильных групп.
- 3. Валентность гидроксогруппы – Количество гидроксогрупп определяется валентностью металла, образующего основание.
- 4. Название оснований Гидроксид + Название металла в родительном падеже + Валентность-римскими цифрами
- 5. Дайте названия гидроксидам NaOH Ca(OH)2 Fe(OH)2 Fe(OH)3 Al(OH)3 Гидроксид натрия (I) Гидроксид железа (II) Гидроксид кальция
- 6. Классификация оснований Растворимые в воде (щелочи) Нерастворимые в воде NaOH Ba(OH)2 Al(OH)3 Сu(OH)2
- 7. Свойства оснований
- 8. Индикаторы – от лат. «indication» - указатели NaOH NaOH NaOH Лакмус Метиловый оранжевый Фенолфталеин
- 9. Взаимодействие с индикаторами Помни! Нерастворимые основания не меняют окраску индикаторов.
- 10. Основание + кислотный оксид → соль + вода 2KOH + N2O5 → 2KNO3 + H2O 2LiOH
- 11. Основание + кислота →соль + вода (нейтрализация) Растворимые основания: NaOH + HCl →NaCl + H2O Нерастворимые
- 12. Основание + соль → новое основание + новая соль 3NaOH+FeCl3→Fe(OH)3↓+ 3NaCl
- 13. Нераств. основание →оксид металла+ вода (разложение при нагревании) Mg(OH)2 → MgO + H2O 2Fe(OH)3 → Fe2O3
- 15. Скачать презентацию
 Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные
Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Исследование снега
Исследование снега Технология промышленных газов
Технология промышленных газов Химический элемент кремний
Химический элемент кремний Алканы в природе
Алканы в природе Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Хозяйственные товары из пластических масс
Хозяйственные товары из пластических масс Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Кислород. Атом кислорода
Кислород. Атом кислорода Начало нанотехнологической эры. Фуллерены
Начало нанотехнологической эры. Фуллерены Природный и искусственный камень
Природный и искусственный камень Амины. Классификация аминов. Характеристика метиламина и анилина
Амины. Классификация аминов. Характеристика метиламина и анилина Теория электролитической диссоциации
Теория электролитической диссоциации Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії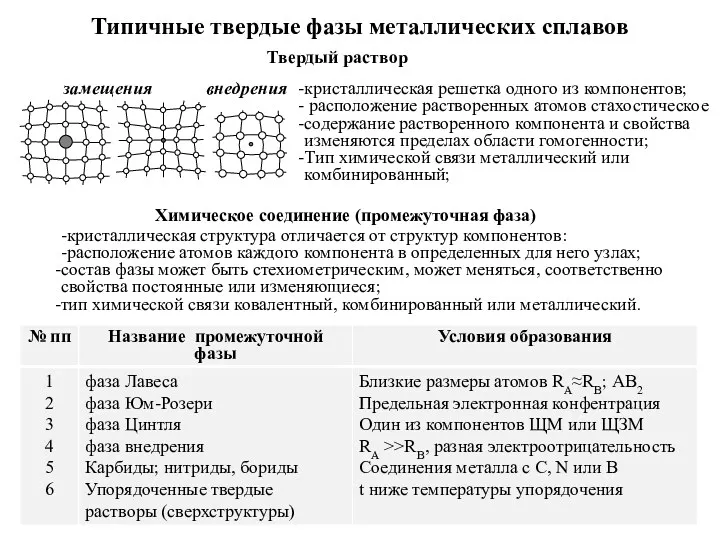 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Хром
Хром Кинетика химических реакций и химическое равновесие
Кинетика химических реакций и химическое равновесие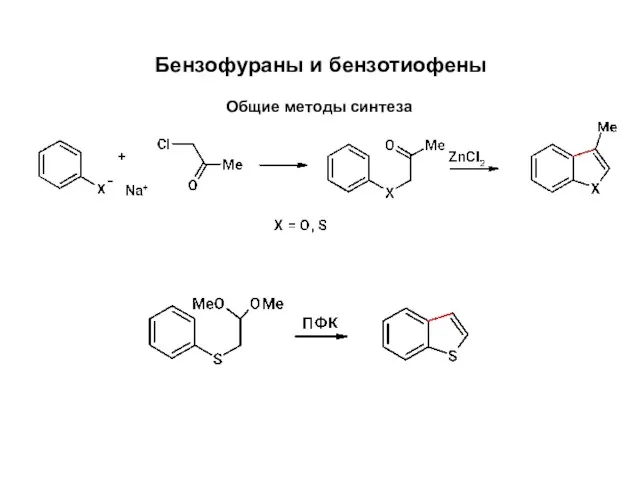 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Ненасыщенные (непредельные) алифатические углеводороды. Алкены
Ненасыщенные (непредельные) алифатические углеводороды. Алкены Бинарные соединения: оксиды, гидриды
Бинарные соединения: оксиды, гидриды Железо как химический элемент
Железо как химический элемент Предельные углеводороды. Алканы. 10 класс
Предельные углеводороды. Алканы. 10 класс Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Соляная кислота и её соли
Соляная кислота и её соли Переработка нефти. (10 класс)
Переработка нефти. (10 класс)