Содержание
- 2. Получение соляной кислоты 1.В промышленности получают сжиганием водорода в хлоре и растворением продукта реакции в воде.
- 3. Физические свойства соляной кислоты раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость,
- 4. Химические свойства: 1. Изменение окраски индикатора (лакмус- красный) 2. Взаимодействует с металлами Mg + 2HCl →
- 5. 3. Взаимодействует с основными и амфотерными оксидами: MgO + 2HCl → MgCl2 + H2O ZnO +
- 6. 5. Взаимодействует с солями: Ряд активности кислот HNO3 H2SO4, HCl, H2SO3, H2CO3, H2S, H2SiO3 ────────────────────────► H3PO4
- 7. 6. Взаимодействует с нитратом серебра HCl + AgNO3 → AgCl↓ + HNO3 выпадает осадок белого цвета,
- 8. 7. Взаимодействует с окислителями Окислители: (MnO2, KMnO4, KClO3) 6HCl + KClO3 = KCl + 3H2O +
- 9. Применение соляной кислоты Входит в состав желудочного сока и способствует перевариванию белковой пищи; Для протравки металлов;
- 11. Скачать презентацию








 Получение и свойства азота
Получение и свойства азота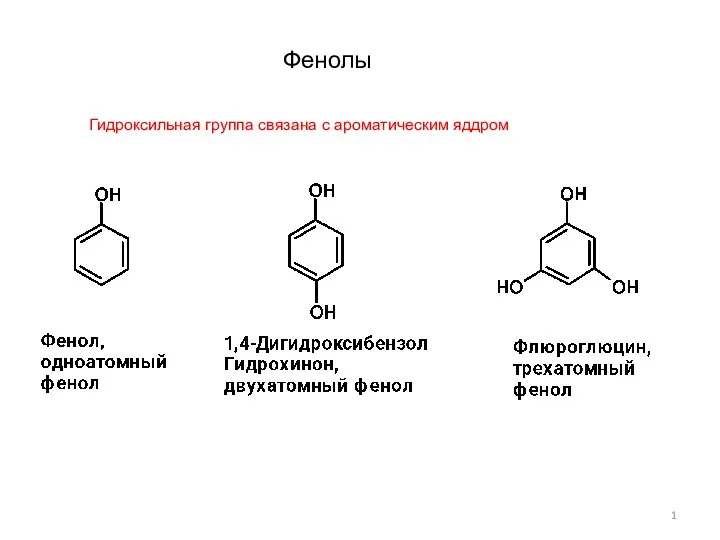 Фенолы-1
Фенолы-1 Свойства моторных топлив
Свойства моторных топлив Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Нахождение металлов в природе. Общие способы получения металлов. 9 класс Органическая химия. Пособие
Органическая химия. Пособие Степень окисления
Степень окисления Химические реакции. Классификация. Повторение
Химические реакции. Классификация. Повторение Основные электрохимические процессы
Основные электрохимические процессы Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Кислород
Кислород Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Реакционная способность соединений с карбонильной группой
Реакционная способность соединений с карбонильной группой Изомерия. Типы изомерии
Изомерия. Типы изомерии Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Конструкционные функциональные волокнистые композиты. Углеродные волокна
Конструкционные функциональные волокнистые композиты. Углеродные волокна Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Флотационные реагенты. Активаторы
Флотационные реагенты. Активаторы Природный газ
Природный газ Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ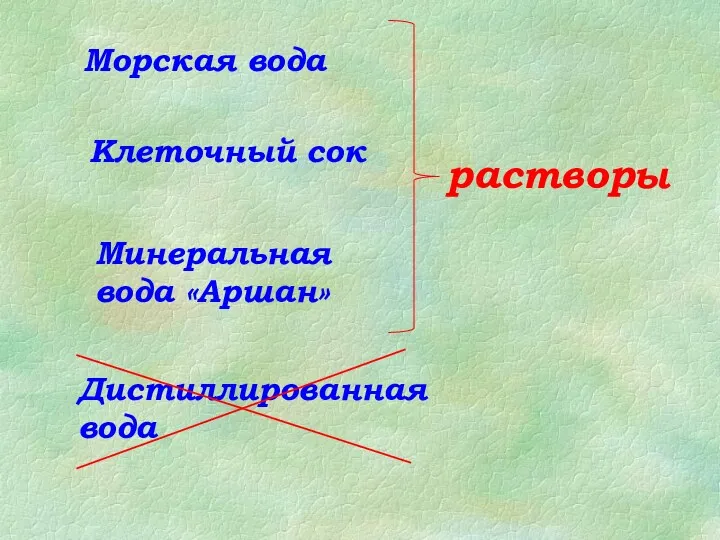 Растворы и растворители
Растворы и растворители Биологиялық қауіп: экопатогендер, қауіпті биологиялық агенттер, биорегуляторлар. Табиғи токсиндер
Биологиялық қауіп: экопатогендер, қауіпті биологиялық агенттер, биорегуляторлар. Табиғи токсиндер Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Арены. Бензол
Арены. Бензол Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Благородные металлы
Благородные металлы Степень окисления
Степень окисления