Слайд 2

История:
Неорганическое вещество, сольНеорганическое вещество, соль металла магнияНеорганическое вещество, соль металла магния
и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса.
Слайд 3

Физические свойства:
Температура плавления – 1137°C,
Плотность – 2,66 г/см3.
Растворимость в 100 г
воды:
при 20°C – 35,5 г,
при 100°C – 68,3 г.
Температура кипения насыщенного раствора (75 г MgSO4 в 100 г H2O) – 108°C.
Слайд 4

Химические свойства:
Сульфат магния хорошо растворяется в воде, гидролизуется по катиону:
MgSO4 (разб.)
+ 4H2 O → [Mg(H2 O)4 ]2+ + SO42- ,
[Mg(H2 O)4 ]2+ + H2 O → [Mg(H2 O)3 (OH)]+ + H3 O+;
2. Вступает в реакции обмена:
MgSO4 + BaCl2 → BaSO4 ↓ + MgCl2
3. Может взаимодействовать с концентрированной серной кислотой:
MgSO4 + H2 SO4 → Mg(HSO4 )2
4. Реагирует с щелочами:
MgSO4 + NaOHразб → Mg(OH)2 ↓ + Na2 SO4
5. Взаимодействует с концентрированным аммиаком:
MgSO4 +2 NH4 OHконц → Mg(OH)2 ↓ + (NH4 )2 SO4
Слайд 5

Получение:
1). Mg О+ Н2So4 =MgSo4+H2O
2)Mg + Н2So4 =MgSo4+H2
3).Mg (ОН)
2+ Н2So4 =MgSo4+2H2O
4).Mg + CuSo4 =MgSo4+Cu
5)MgСО3+ Н2So4 =MgSo4+H2O +СО2




 Массовая доля вещества в растворе
Массовая доля вещества в растворе Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Установка производства серы по методу Клауса
Установка производства серы по методу Клауса Кислород O2
Кислород O2 Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение Массообменные процессы
Массообменные процессы Введение в минералогию. Генезис минералов
Введение в минералогию. Генезис минералов Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Классификация химических реакций в органической химии
Классификация химических реакций в органической химии Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы
Кремнекислые породы группа гранитов-риолитов гранодиоритов-дацитов. Интрузивные породы Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері
Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері История открытия кислорода
История открытия кислорода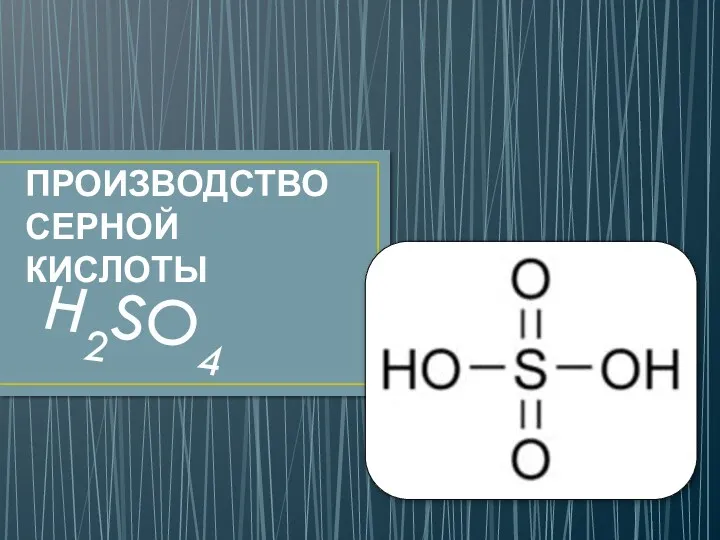 Производство серной кислоты
Производство серной кислоты Основания. (8 класс)
Основания. (8 класс) Хлорид натрия
Хлорид натрия Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка
Нефть и нефтепродукты. Происхождение. Состав. Свойства. Переработка История становления органической химии
История становления органической химии Физические явления в химии. Чистые вещества и смеси
Физические явления в химии. Чистые вещества и смеси Строение атома
Строение атома Металловедение. Классификация металлов
Металловедение. Классификация металлов Основные постулаты квантовой механики
Основные постулаты квантовой механики Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот Первоначальные представления об органических веществах. Органическая химия
Первоначальные представления об органических веществах. Органическая химия Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ
Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ Природные источники углеводородов
Природные источники углеводородов Відносна густина газів
Відносна густина газів