Содержание
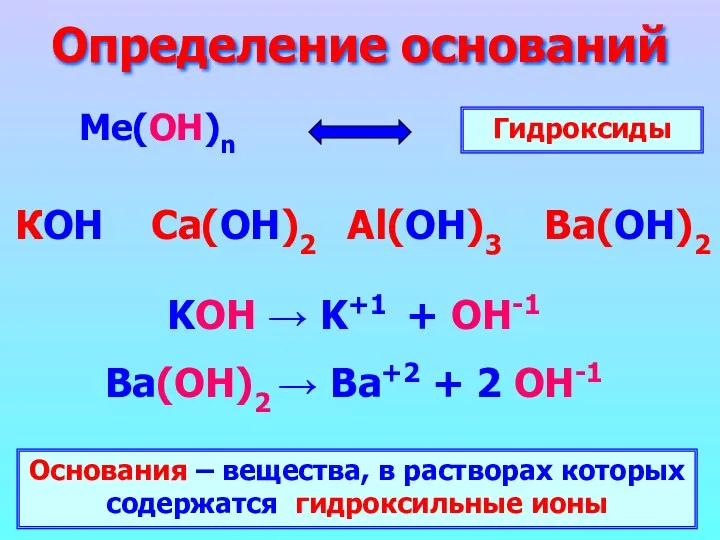
- 2. Определение оснований Ме(ОН)n КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2 Гидроксиды KOH → K+1 + OH-1 Ba(ОН)2 → Ba+2
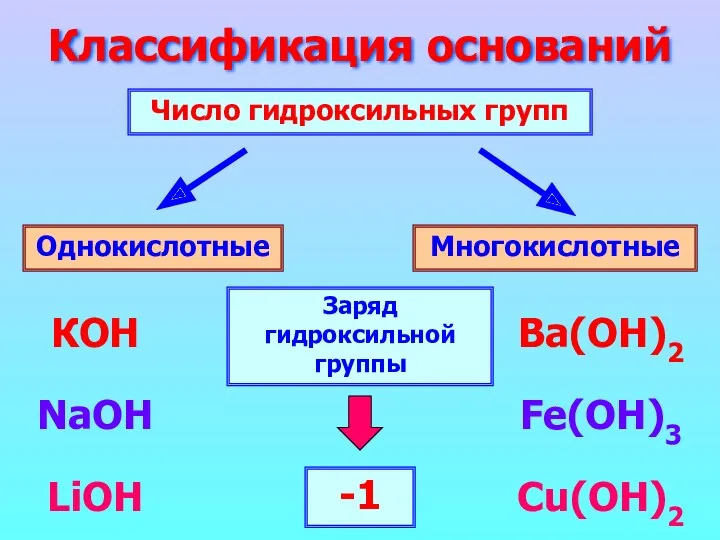
- 3. Классификация оснований Число гидроксильных групп Однокислотные Многокислотные КОН NaOH LiOH Ba(ОН)2 Fe(OH)3 Cu(OH)2 Заряд гидроксильной группы
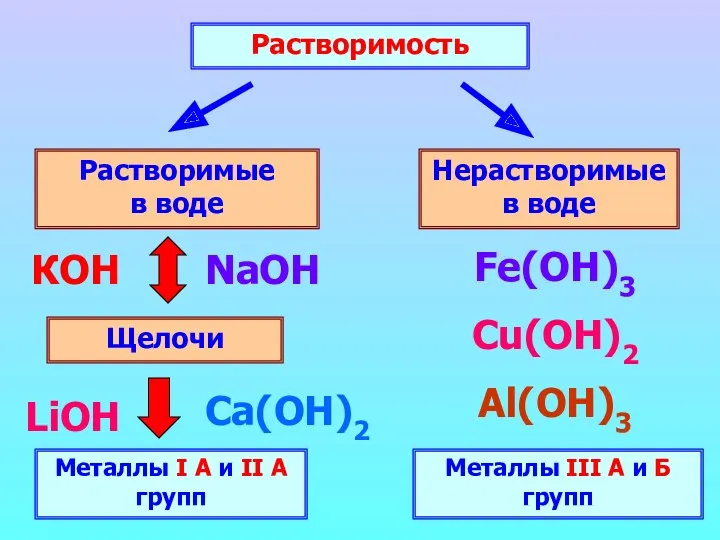
- 4. Растворимость Растворимые в воде Нерастворимые в воде Щелочи Металлы I А и II А групп КОН
- 5. Сильные и слабые основания
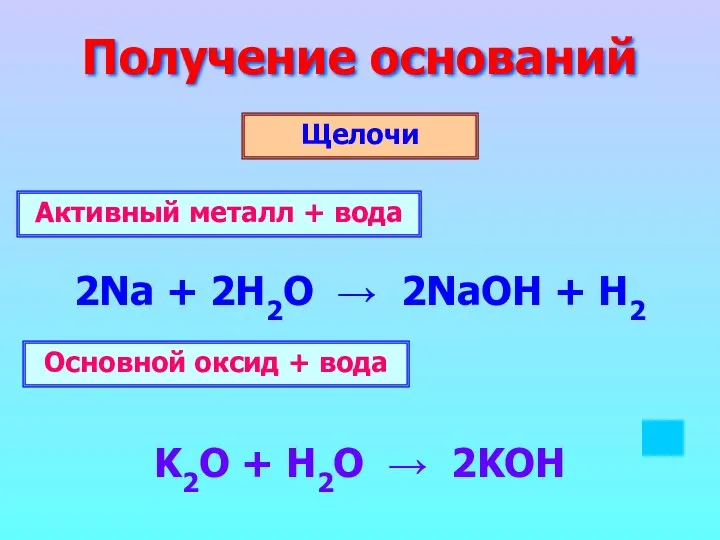
- 6. Получение оснований Щелочи 2Na + 2H2O → 2NaOH + H2 K2O + H2O → 2KOH Активный
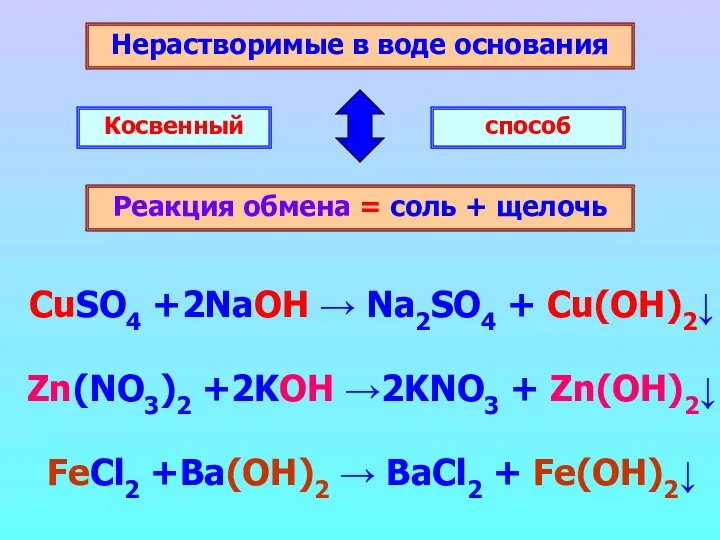
- 7. Нерастворимые в воде основания Реакция обмена = соль + щелочь Косвенный способ CuSO4 +2NaOH → Na2SO4
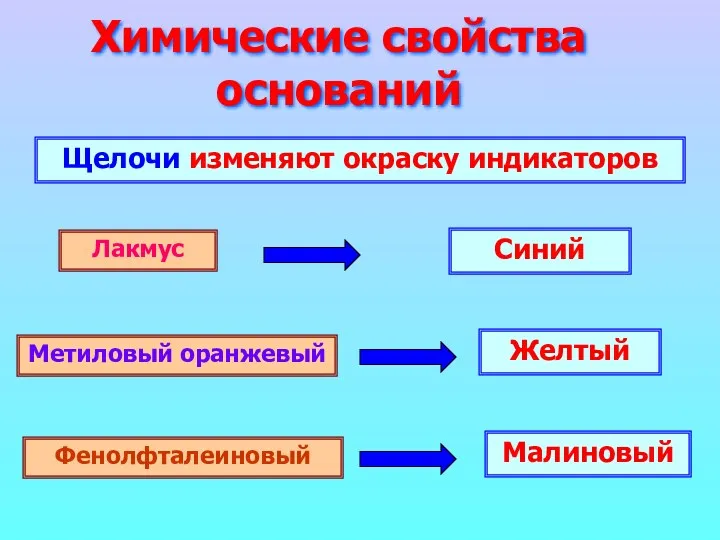
- 8. Химические свойства оснований Щелочи изменяют окраску индикаторов Лакмус Метиловый оранжевый Фенолфталеиновый Синий Желтый Малиновый
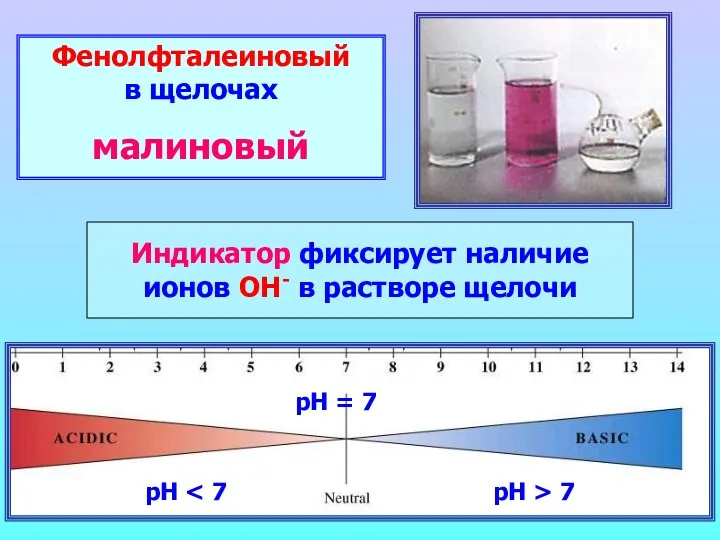
- 9. Фенолфталеиновый в щелочах малиновый Индикатор фиксирует наличие ионов ОН- в растворе щелочи рН рН = 7
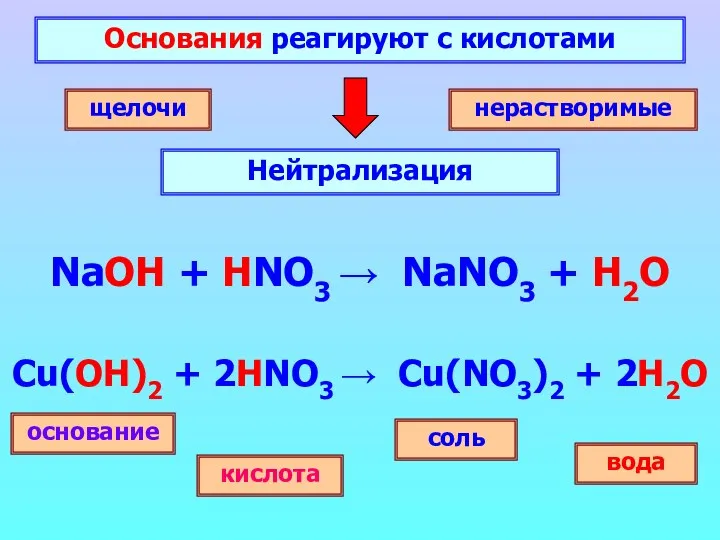
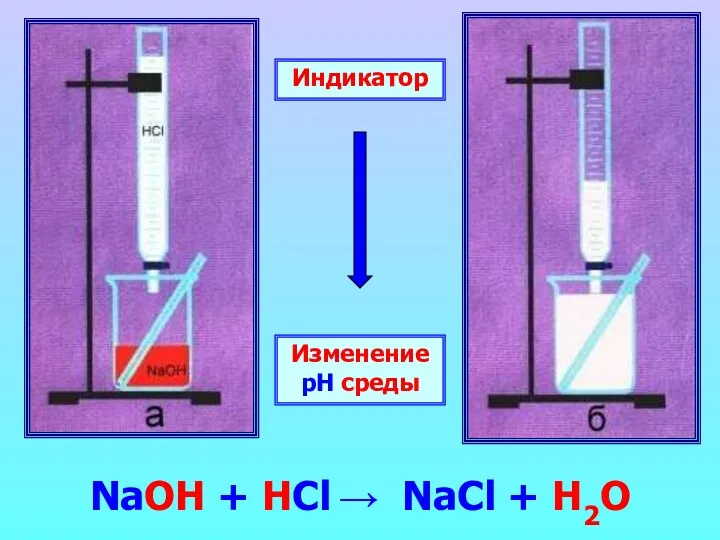
- 10. Основания реагируют с кислотами Нейтрализация щелочи нерастворимые основание соль кислота вода
- 12. Индикатор Изменение рН среды
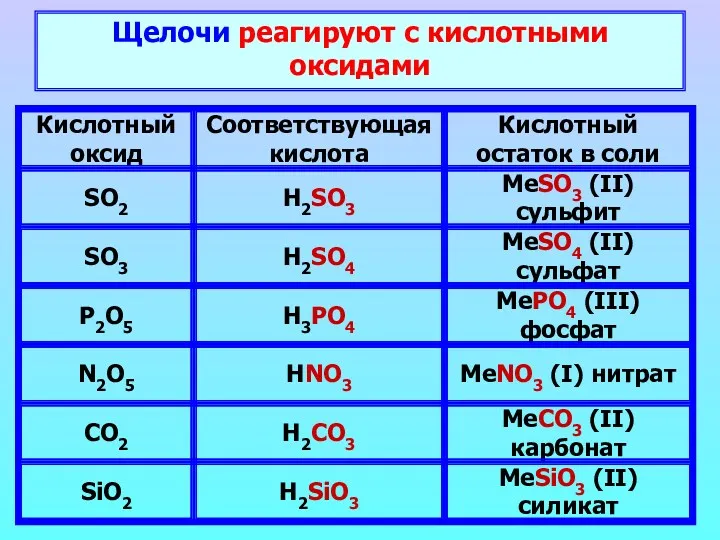
- 13. Щелочи реагируют с кислотными оксидами
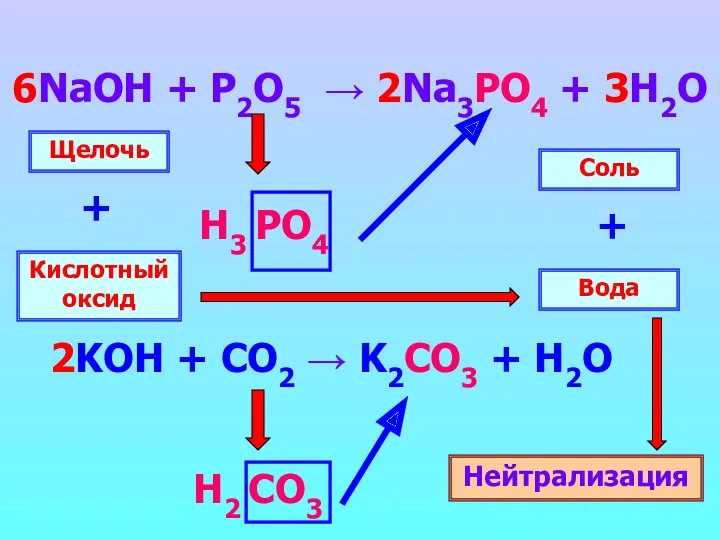
- 14. 6NaOH + P2O5 → 2Na3PO4 + 3H2O Н3 PO4 Н2 CO3 Щелочь Кислотный оксид + Вода
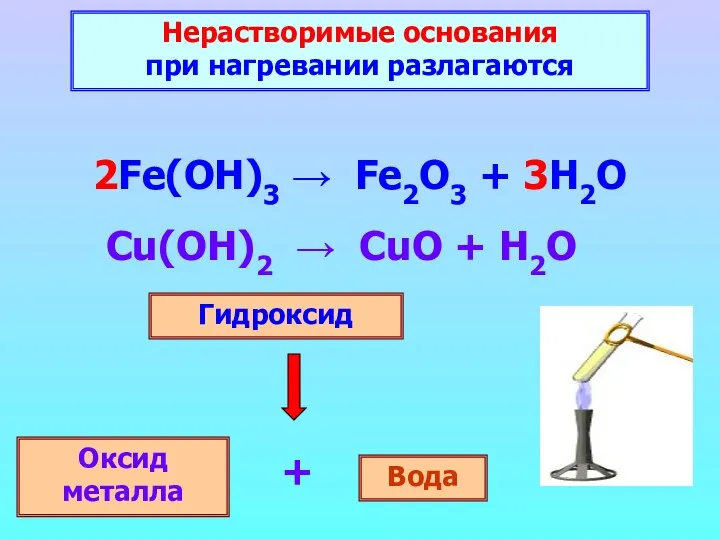
- 15. Нерастворимые основания при нагревании разлагаются 2Fe(OH)3 → Fe2O3 + 3H2O Гидроксид Оксид металла Вода +
- 17. Скачать презентацию


 Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Основные характеристи нефти и нефтеподуктов
Основные характеристи нефти и нефтеподуктов Задачи
Задачи Ненасыщенные (непредельные) алифатические углеводороды. Алкены
Ненасыщенные (непредельные) алифатические углеводороды. Алкены Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1 Свойства минералов
Свойства минералов Минералы и горные породы
Минералы и горные породы Розчин і його компоненти
Розчин і його компоненти Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Изомерия. Типы изомерии
Изомерия. Типы изомерии Минералдар
Минералдар c0198e3edf1db804a5527004a7864ed1
c0198e3edf1db804a5527004a7864ed1 ФОСФОР и его соединения
ФОСФОР и его соединения Предельные углеводороды
Предельные углеводороды Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар
Мына қосылыстардағы элементтердің тотығу дәрежелерін анықтаңдар Химические реакции. Классификация химических реакций
Химические реакции. Классификация химических реакций Водород
Водород Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Колоїдний захист
Колоїдний захист Предмет органической химии
Предмет органической химии Физические свойства металлов
Физические свойства металлов