Содержание
- 2. Демокрит (460–371 гг. н.э.) Древнегреческий ученый, философ-материалист. Ученик Левкиппа. Родился в Абдере (Фракия). Сочинения Демокрита по
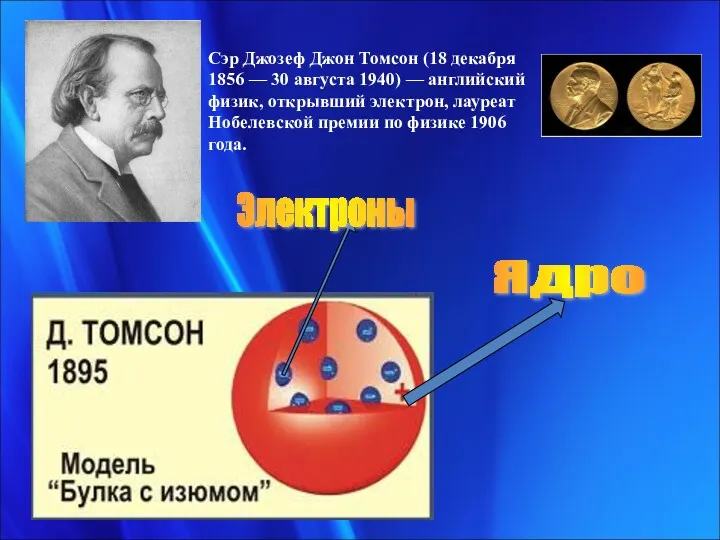
- 3. Электроны Ядро Сэр Джозеф Джон Томсон (18 декабря 1856 — 30 августа 1940) — английский физик,
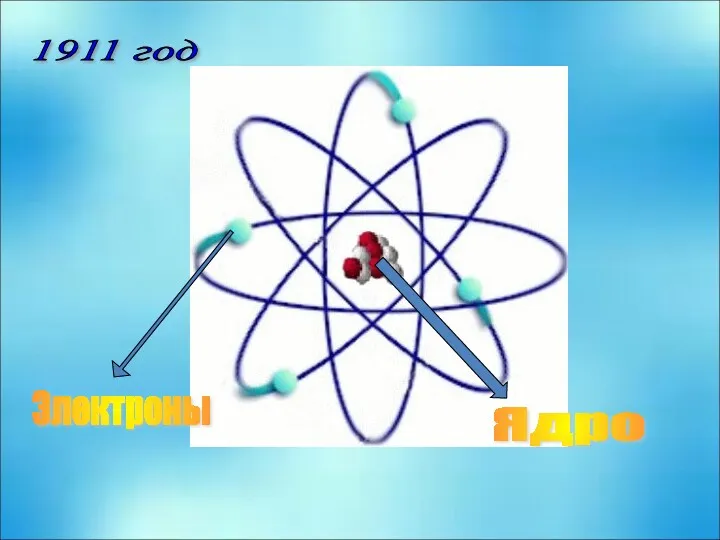
- 4. Электроны Ядро 1911 год модель атома Планетарная Эрнеста Резерфорда
- 5. Резерфорд Эрнст (1871–1937) Английский физик, с 1903 г. член Лондонского королевского общества, его президент в 1925–1930
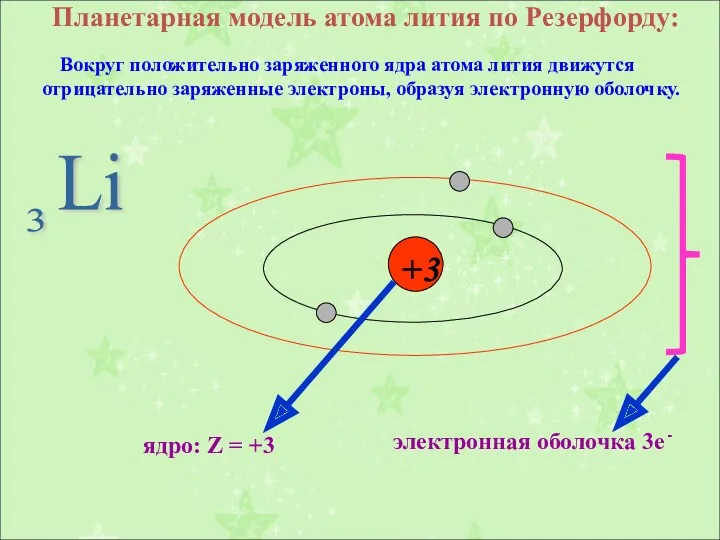
- 6. Планетарная модель атома лития по Резерфорду: Вокруг положительно заряженного ядра атома лития движутся отрицательно заряженные электроны,
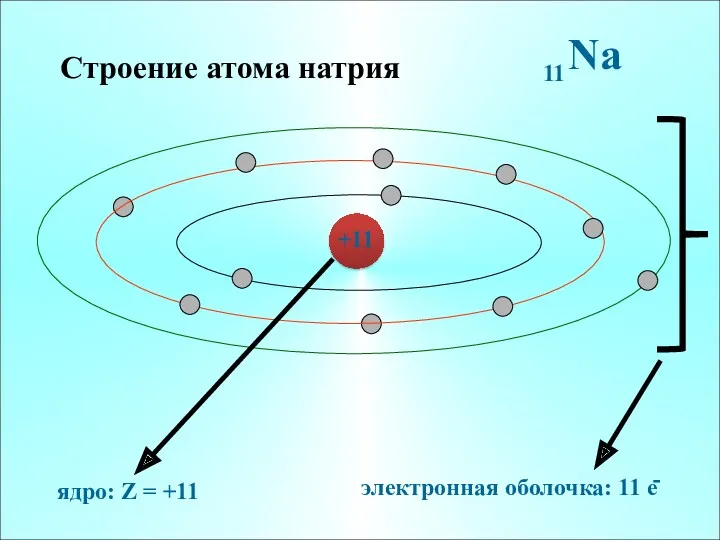
- 7. Строение атома натрия +11
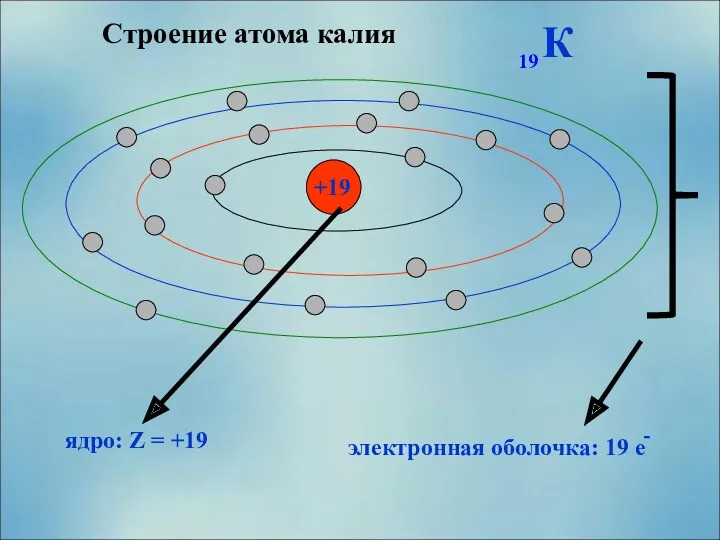
- 8. Строение атома калия +19
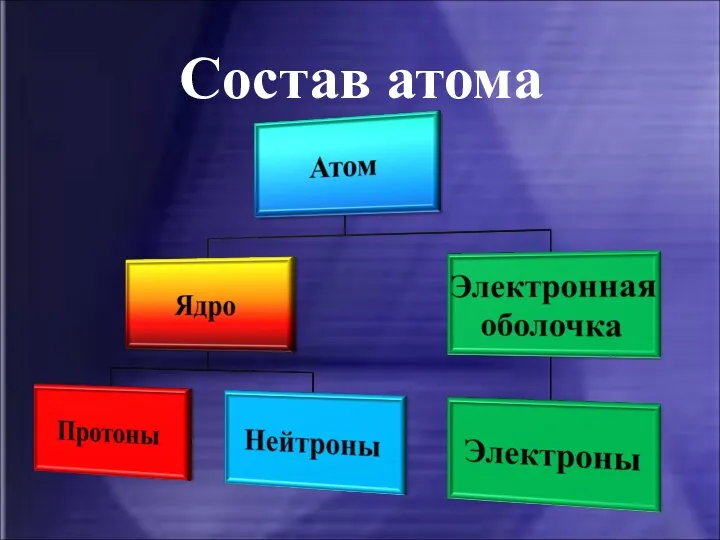
- 9. Атом Наименьшая электронейтральная частица химического элемента, являющаяся носителем его свойств.
- 10. Состав атома
- 11. Атомное ядро Практически вся масса атома (более 99,95%) сосредоточена в очень малом объеме – в ядре
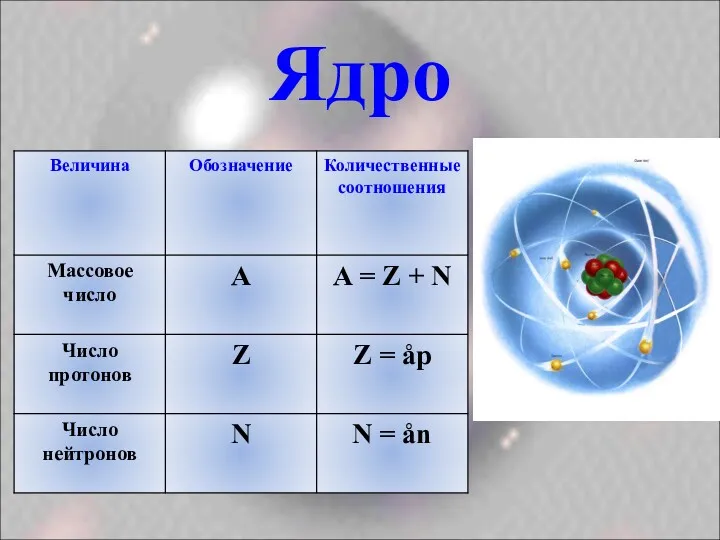
- 12. Ядро
- 13. Электроны В состав атома, кроме положительно заряженного ядра, входят отрицательно заряженные частицы – электроны. Электрический заряд
- 14. 1913 – английский физик Генри Мозли на основании экспериментальных данных (исследование рентгеновских спектров химических элементов) установил,
- 15. Из закона Мозли следует, что порядковый номер элемента соответствует положительному заряду ядра атома. Атом характеризуют три
- 16. А соответствует относительной атомной массе элемента,которые приведены в п.с.: A=Ar . Число протонов равно порядковому номеру:
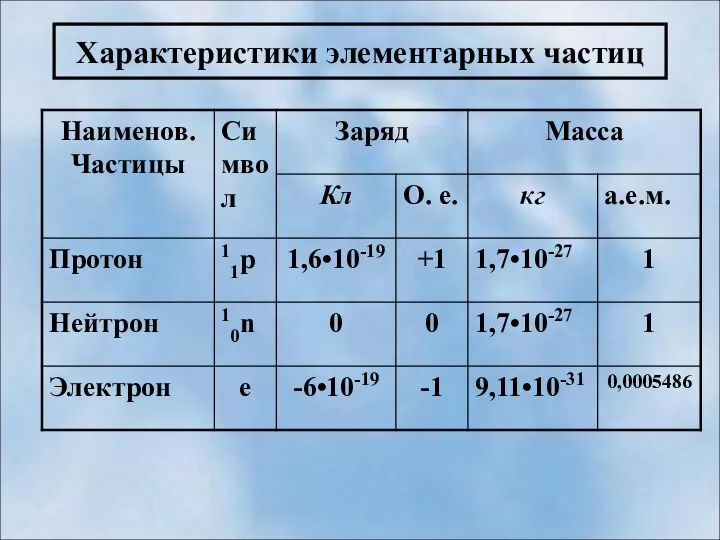
- 17. Характеристики элементарных частиц
- 18. ЗАПОМНИТЕ : Все известные химические элементы приведены в таблице Д. И. Менделеева. В ней они располагаются
- 19. Современная формулировка периодического закона Свойства химических элементов, а также формы и свойства соединений элементов находятся в
- 20. Атомы одного элемента, имеющие одинаковый заряд ядра, но разные массовые числа называются изотопами. Изотопы содержат одинаковое
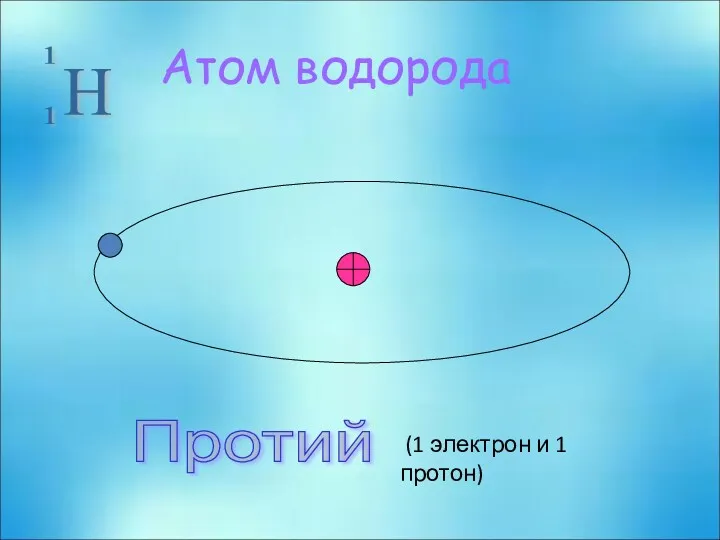
- 21. Атом водорода Протий (1 электрон и 1 протон)
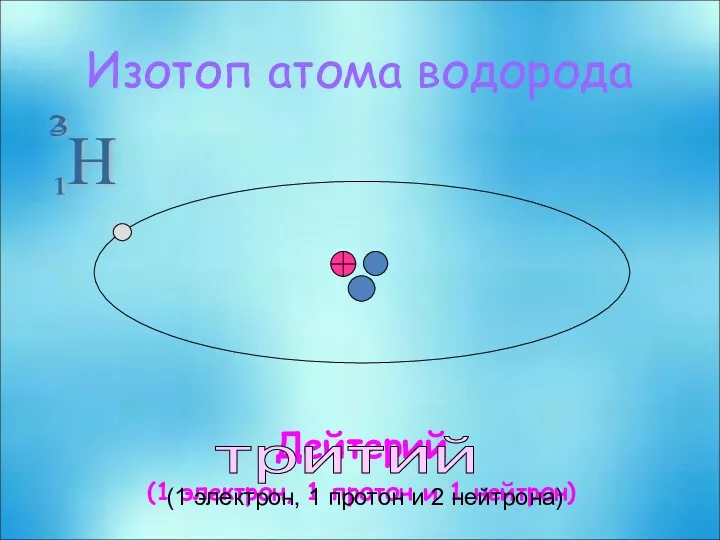
- 22. H 2 1 Изотоп атома водорода Дейтерий (1 электрон, 1 протон и 1 нейтрон) 3 тритий
- 23. Частицы, которые получились при отдаче (потере) и принятии (присоединении) и приобрели заряд, называются ионами. Вид атома
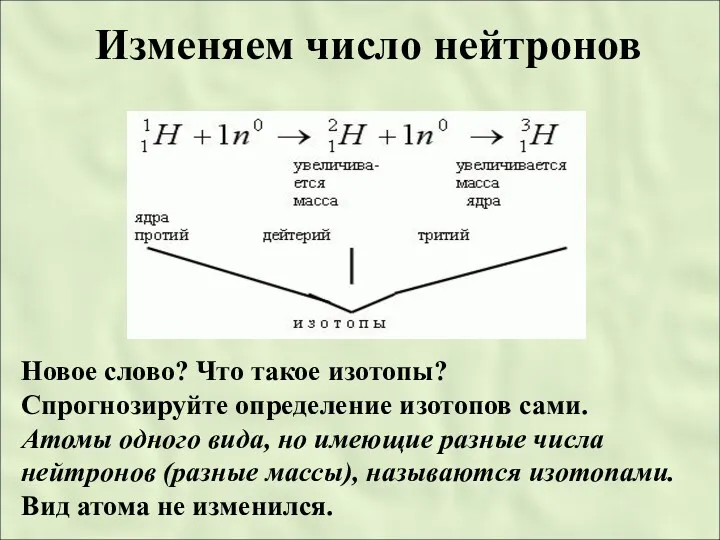
- 24. Изменяем число нейтронов Новое слово? Что такое изотопы? Спрогнозируйте определение изотопов сами. Атомы одного вида, но
- 25. Изменяем число протонов Получили новый химический элемент. Итак, получили новые химические элементы, новый вид атома. Подведем
- 26. 1. Атом делим или неделим. 2. Электрический заряд электрона. 3. Как называется частица, присоединившая электрон? 4.
- 28. Скачать презентацию














 Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Обмен нуклеопротеинов
Обмен нуклеопротеинов Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Геохимия
Геохимия Электрохимические процессы
Электрохимические процессы Аммиак
Аммиак Предмет и история геохимии
Предмет и история геохимии Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Предмет органической химии
Предмет органической химии Материаловедение-2
Материаловедение-2 Лекция 3. Гидроксисоединения. Карбонильные соединения
Лекция 3. Гидроксисоединения. Карбонильные соединения Алюминий и его соединения
Алюминий и его соединения 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI)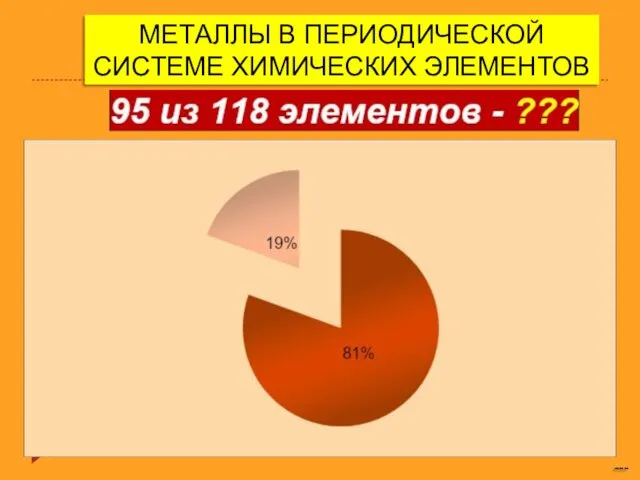 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Требования к осадителю
Требования к осадителю Protein Chemistry
Protein Chemistry Газообразное состояние вещества
Газообразное состояние вещества Кислоты. Состав кислот
Кислоты. Состав кислот 5.Алкины
5.Алкины Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Chemical kinetics
Chemical kinetics Фенол қосылыстары
Фенол қосылыстары Кевлар. Структура кевлара
Кевлар. Структура кевлара Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Подгруппа азота
Подгруппа азота Фосфор
Фосфор