Содержание
- 2. Состав кислот H Cl H2SO4 H3PO4 1. Кислоты – это простые или сложные вещества? 2. Что
- 3. H Cl = H+ + Cl – H2 SO 4 = 2 H+ + SO42- Кислоты
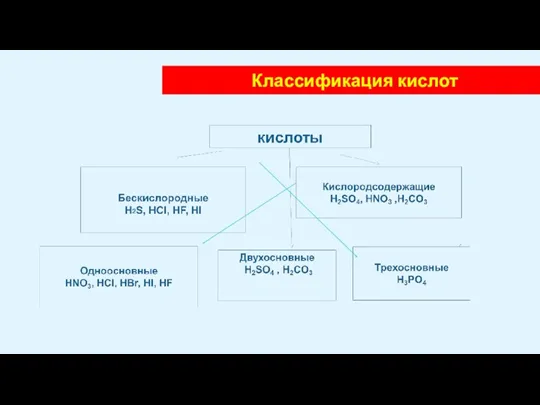
- 4. Классификация кислот
- 5. Нахождение кислот в природе Лимонная кислота содержится в лимонах, яблочная кислота - в яблоках, щавелевая кислота
- 6. Физические свойства Жидкости, неограниченно смешивающиеся с водой: H2SO4, HNO3, HCI и др. Твёрдые вещества, растворимые в
- 7. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора кислоты
- 8. Правила техники безопасности при работе с кислотами При растворении серной кислоты нужно вливать ее тонкой струей
- 9. Химические свойства кислот: Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с основаниями;
- 10. Изменение окраски индикаторов. Нерастворимые кислоты не меняют окраску индикаторов.
- 11. Действие кислот на растворы индикаторов фиолетовый красный оранжевый розовый лакмус метилоранж обусловлено наличием в них ионов
- 12. Взаимодействие кислот с металлами Zn + 2 HCI = ZnCI2 + H2 + Q Zn +2H+
- 13. Na OH +H CI = Na CI + H2O Na+ + OH - + H +
- 14. основный оксид + кислота = соль + вода MeO + HR = MeR + H2O CuO
- 15. Взаимодействие кислот с растворами солей BaCI2+H2SO4 = BaSO4 + 2HCI Ba2+ + 2CI- + 2Н+ +
- 16. H2CO3 = H2O + CO2 H2SO3 = H2O + SO2 H2SiO3 = H2O + SiO2 CO2
- 17. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой: P2O5+ 3H2O = 2H3PO4 SO3 + H2O
- 18. Проверьте свои знания (№1) 1.С какими из перечисленных веществ реагирует соляная кислота: Ba(OH)2, AgNO3, NaCl, Hg,
- 20. Скачать презентацию
















 Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия
Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия 20230419_kolichestvo_veshchestva_mol
20230419_kolichestvo_veshchestva_mol Теория электролитической диссоциации
Теория электролитической диссоциации Алкадиены. Каучуки
Алкадиены. Каучуки Установление структуры биополимеров
Установление структуры биополимеров Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Неизотермический процесс в химическом реакторе. Лекция 8
Неизотермический процесс в химическом реакторе. Лекция 8 Омыватель лобового стекла автомобиля
Омыватель лобового стекла автомобиля Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы Периодический закон Менделеева
Периодический закон Менделеева Періодична система
Періодична система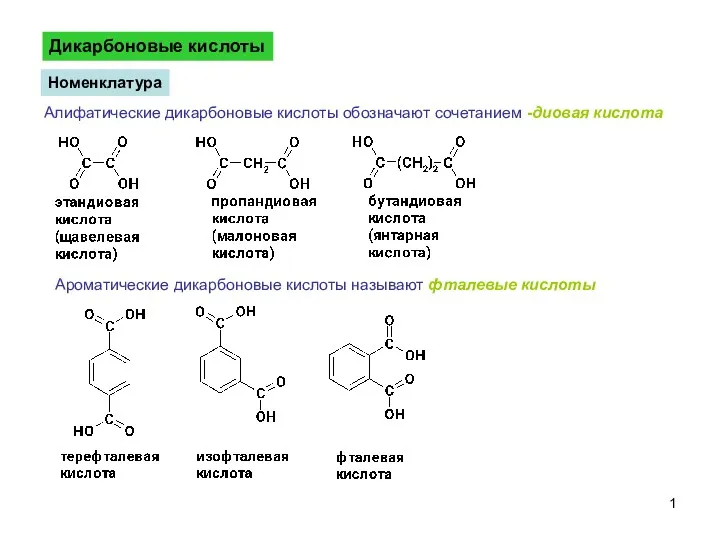 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 Зерттеу әдістері
Зерттеу әдістері Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации
Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Аммиак
Аммиак Алюминий
Алюминий Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Классификация процессов и производств в химической технологии
Классификация процессов и производств в химической технологии Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Непредельные углеводороды
Непредельные углеводороды Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Классификация химических элементов
Классификация химических элементов Контроль результатов обучения химии
Контроль результатов обучения химии Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс 20230204_ekzo_i_endo2_0
20230204_ekzo_i_endo2_0 ЕГЭ по химии, задание 2
ЕГЭ по химии, задание 2