Слайд 2

Строение атомов
Общая электронная формула ns2
Валентность II
Степень окисления +2
Восстановительные свойства
Менее реакционно-способны, чем
щелочные металлы
Слайд 3

Слайд 4

Физические свойства
серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов.
Слайд 5

Be
3BeO • Al2O3 • 6SiO2 –
берилл
Слайд 6

Mg
MgCO3 – магнезит
CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3H2O
– каинит
KCl • MgCl2 • 6H2O – карналлит
Слайд 7

Ca
CaCO3 – кальцит
(известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 •
2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат
(флюорит)
Слайд 8

SrSO4 – целестин
SrCO3 – стронцианит
BaSO4 – барит
BaCO3 – витерит
во всём мире
удалось
добыть всего 1,5 кг
чистого радия
Sr, Ba и Ra
Слайд 9

Химические свойства
1. Все металлы образуют оксиды RO, барий-пероксид – BaO2
2Me +O2 → 2MeO
2. Бериллий и магний сравнительно медленно реагируют с неметаллами
Me +H2 → MeH2
Me +Cl2 → MeCl2
Me +S → MeS
Слайд 10

Химические свойства
3. Растворяются в кислотах:
Me +2HCl → MeCl2 +
H2
Бериллий растворяется в водных растворах щелочей
4. В обычных условиях поверхность Be и Mg покрыта инертной оксидной пленкой, поэтому они устойчивы по отношению к воде.
Ca, Sr и Ba растворяются в воде с образованием гидроксидов Me +2HOH → Me(OH)2 +Н2
Слайд 11

Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие
цвета:
Ca2+ - темно-оранжевый
Sr2+- темно-красный
Ba2+ - светло-зеленый
Слайд 12
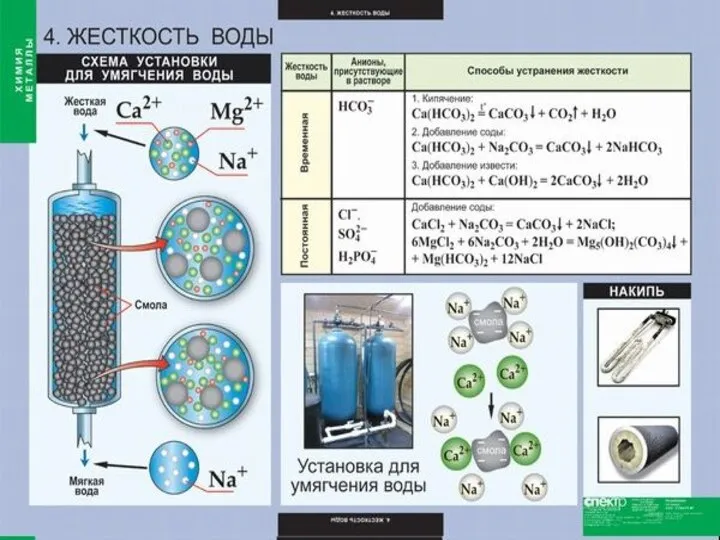
Слайд 13
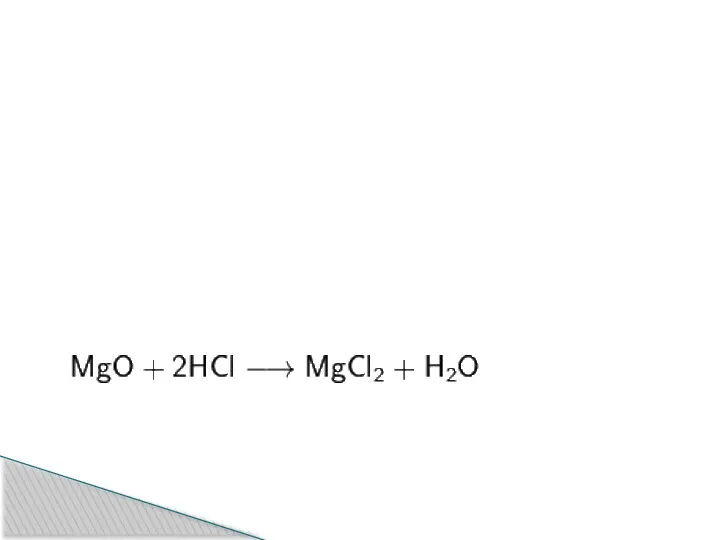
Слайд 14
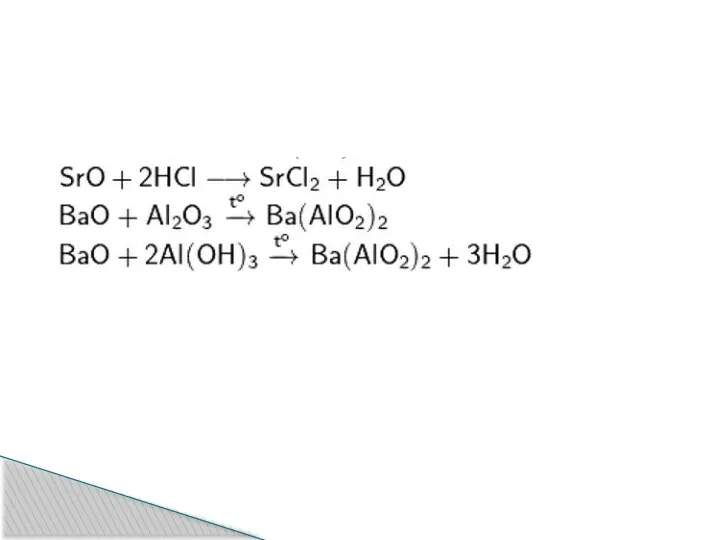
Слайд 15
Слайд 16
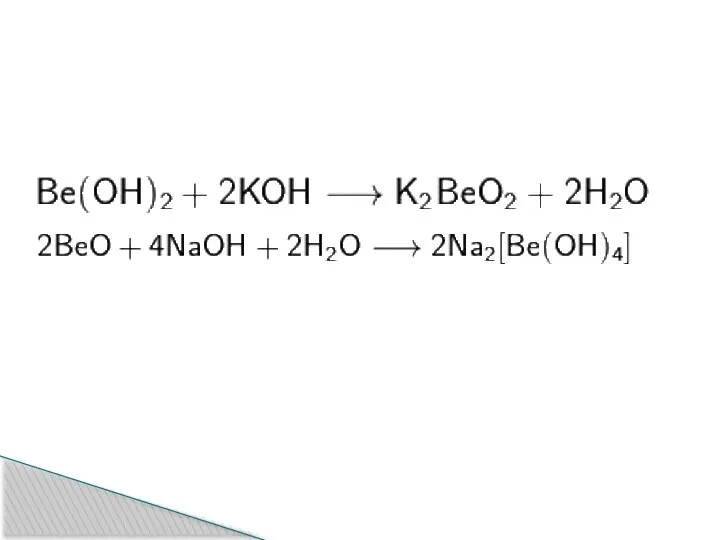
Слайд 17
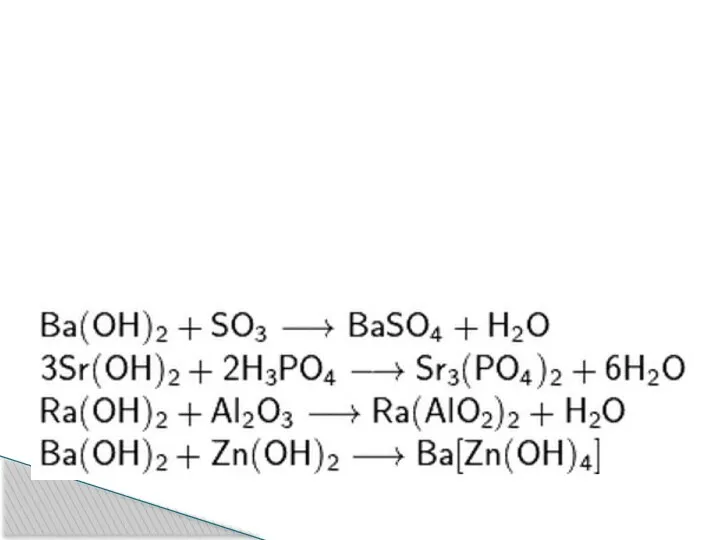
Слайд 18

Слайд 19

Слайд 20

Слайд 21




















 Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь Основные классы неорганических соединений. Химические свойства неорганических веществ
Основные классы неорганических соединений. Химические свойства неорганических веществ Алканы
Алканы Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) 20230419_eds
20230419_eds Каменный уголь. Переработка и применение угля
Каменный уголь. Переработка и применение угля Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Циклоалканы
Циклоалканы Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Спирты. Классификация спиртов
Спирты. Классификация спиртов Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химические свойства солей
Химические свойства солей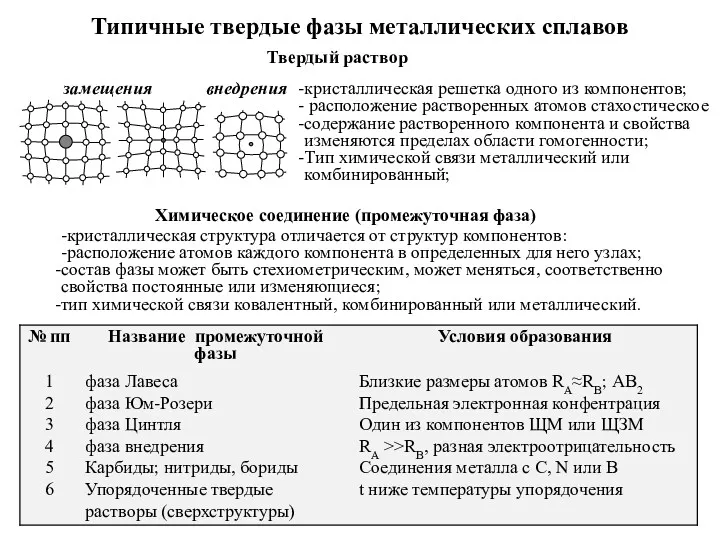 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Лужні метали
Лужні метали Химия p-элементов (лекция 12)
Химия p-элементов (лекция 12) Растворение. Растворы. Физическая теория
Растворение. Растворы. Физическая теория Химические формулы веществ (8 класс)
Химические формулы веществ (8 класс) Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Химия титанорганических соединений
Химия титанорганических соединений S-элементтердің жалпы сипаттамасы
S-элементтердің жалпы сипаттамасы Получение и применение алканов
Получение и применение алканов Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химия. D-элементтер
Химия. D-элементтер Вольтамперометрические методы анализа
Вольтамперометрические методы анализа Класифікація, будова та номенклатура органічних сполук
Класифікація, будова та номенклатура органічних сполук Сульфидтер. Аз еруші сульфидтер
Сульфидтер. Аз еруші сульфидтер Индикаторы окислительно-восстановительного титрования. Их применение в анализе
Индикаторы окислительно-восстановительного титрования. Их применение в анализе