Содержание
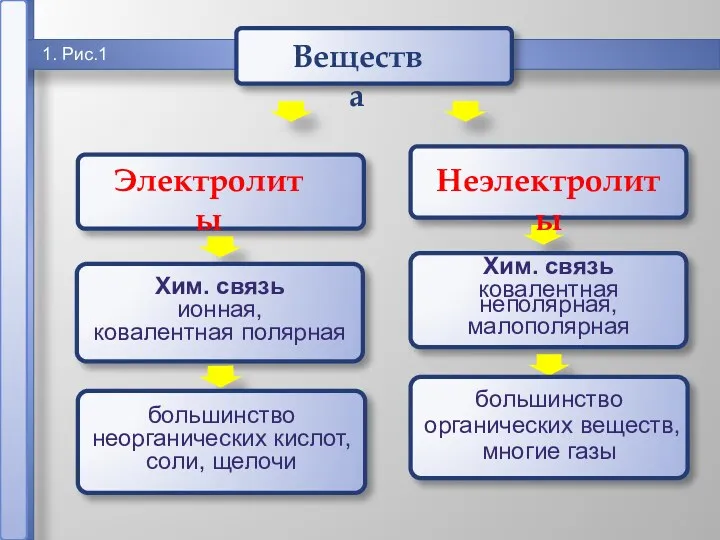
- 2. 1 1. Рис.1 Электролиты Неэлектролиты
- 3. 1. Электролиты и неэлектролиты Вода – хороший растворитель, т.к. молекулы воды полярны. слабый амфотерный электролит. ион
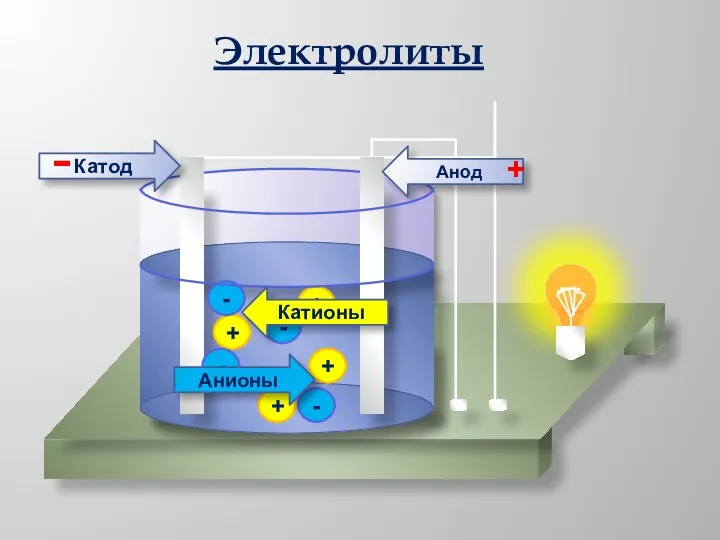
- 4. 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты -
- 5. + + + + - - - - Анионы Катионы Анод Катод - + Электролиты
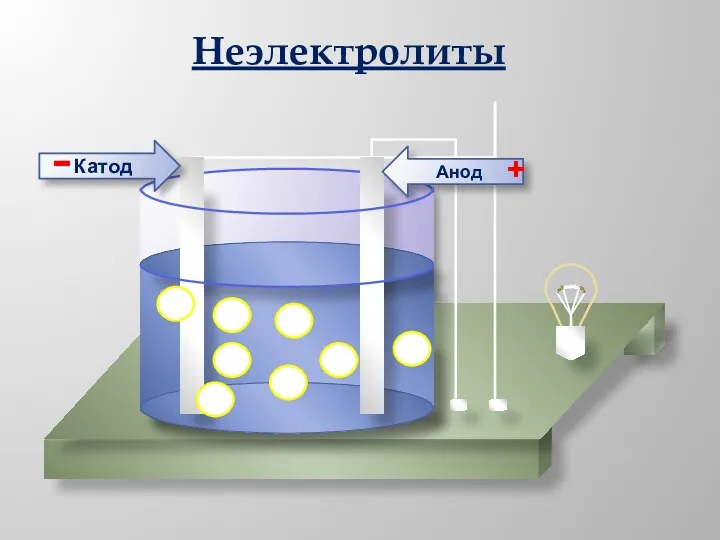
- 6. 18.12.2018 Русецкая О.П. 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический
- 7. Анод Катод - + Неэлектролиты
- 8. 2.Электролитическая диссоциация процесс распада молекул электролита на ионы в растворе или расплаве. С.Аррениус Электролитическая диссоциация -
- 9. 2.Электролитическая диссоциация Аррениус Сванте Август Шведский ученый, академик. В 1887 году сформулировал основные положения теории электролитической
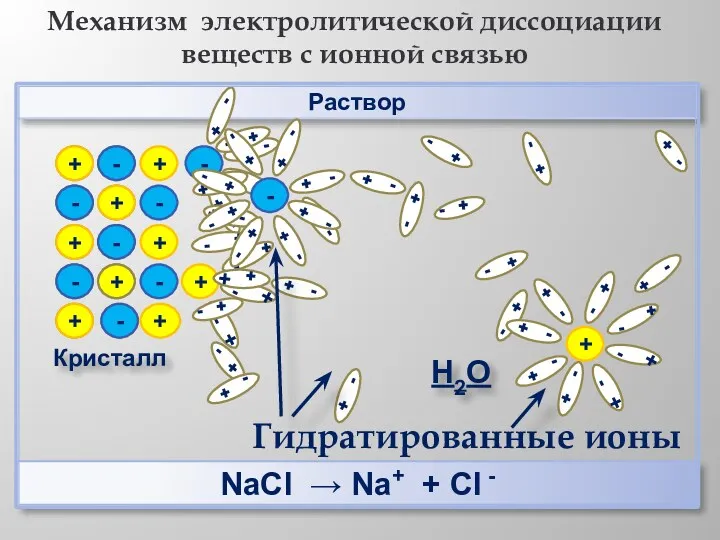
- 10. + + - - + + - - Раствор Кристалл - + + + - -
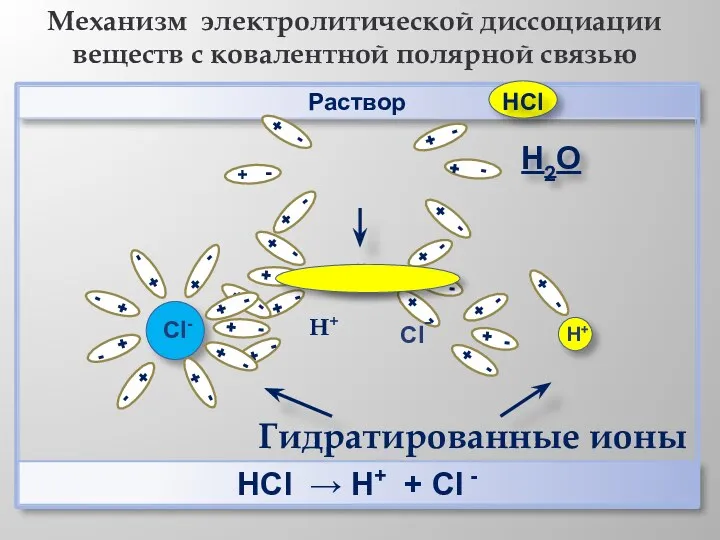
- 11. Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О
- 12. 2.Сильные и слабые электролиты HCl + + + Сильные и слабые электролиты
- 13. отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Степень электролитической диссоциации (α) -
- 14. 2.Сильные и слабые электролиты Электролиты
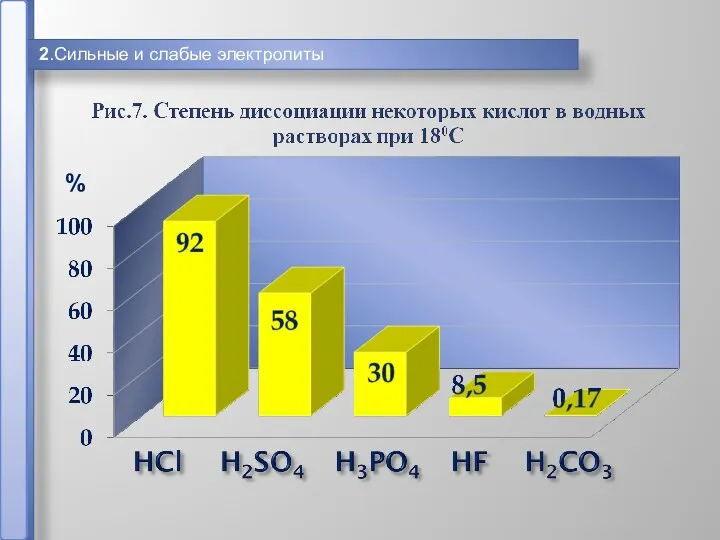
- 15. 2.Сильные и слабые электролиты %
- 16. это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы водорода.
- 17. это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы. Основания
- 18. это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. Соли
- 19. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 21. Скачать презентацию











 Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Кислород и озон
Кислород и озон Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы Соли аммония
Соли аммония Химические свойства алканов
Химические свойства алканов Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Углерод. Оксиды углерода
Углерод. Оксиды углерода Применение соляной кислоты и её солей
Применение соляной кислоты и её солей Антибиотики как ЛС
Антибиотики как ЛС Соли. CaSO4 - Сульфат кальция
Соли. CaSO4 - Сульфат кальция Class micro and macro elements
Class micro and macro elements Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Простые вещества – неметаллы
Простые вещества – неметаллы Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Ювелирное дело. Империя самоцветов
Ювелирное дело. Империя самоцветов Ферменты в биотехнологии
Ферменты в биотехнологии Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Мило та миловаріння
Мило та миловаріння Почему мыло пенится
Почему мыло пенится Основные классы неорганических соединений
Основные классы неорганических соединений Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Химия элементов. Общая характеристика элементов
Химия элементов. Общая характеристика элементов Вклад М.В. Ломоносова в развитие химии
Вклад М.В. Ломоносова в развитие химии Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні