Содержание
- 2. ТЕСТ Решите альтернативный тест – выбор правильного ответа из множества. I вариант выбирает правильные ответы для
- 3. 1. Газообразный при обычных условиях. 2.Не имеет запаха. 3.Бесцветный. 4.Степень окисления азота -3 5. Взаимодействует с
- 4. Взаимопроверка
- 5. Первая мировая война. Морское сражение немцев с англичанами.
- 6. Тема урока «Соли аммония» Во время I мировой войны английский крейсер вел преследование поврежденного в бою
- 7. Тема урока «Соли аммония»
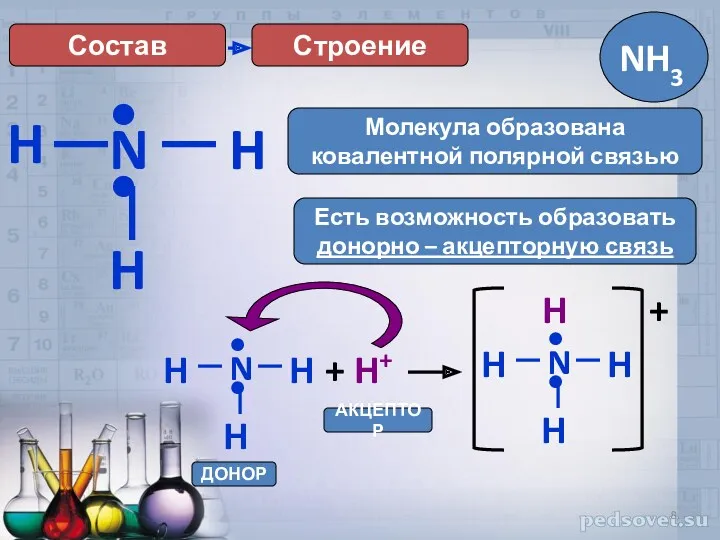
- 8. H Строение N H H •• Есть возможность образовать донорно – акцепторную связь Молекула образована ковалентной
- 9. Соли аммония Составьте молекулярную формулу солей
- 10. Физические свойства солей аммония. а) твёрдые вещества; б) имеют кристаллическое строение (ионные кристаллические решётки); в) хорошо
- 11. Химические свойства солей аммония Вспомните правила Т/Б!
- 12. Химические свойства солей аммония. Взаимодействие с солями. хлорид аммония + нитрат серебра NH4Cl + AgNO3 ?
- 13. Сульфат аммония + хлорид бария (NH4)2SO4 + BaCl2 ? 2NH4Cl + BaSO4 2NH4 ++SO42- + Ba2+
- 14. 2. Взаимодействие с кислотами. Карбонат аммония + соляная кислота (NH4 )2СО3 + 2HCl ? 2NH4Cl +
- 15. 3. Взаимодействие с щелочами. NH4Cl+ NaOH ? NH3 + H2O + NaCl Взаимодействие с щелочами –
- 16. Получение аммиака в лаборатории NH4Cl Ca(OH)2 NH3
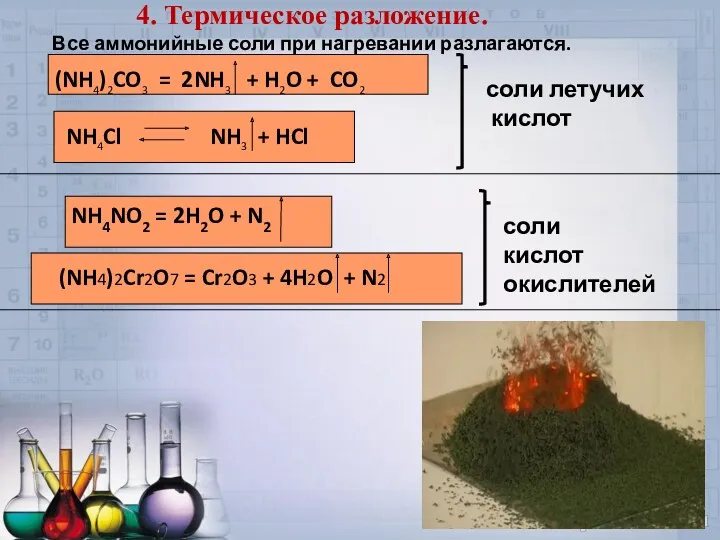
- 17. 4. Термическое разложение. Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O + CO2
- 18. Получение солей аммония Получают их при взаимодействии NH3 или NH4 OH с кислотами: NH3 + HCl
- 19. Применение солей аммония.
- 20. Русский химик Д.Н Прянишников Соли аммония Азотные удобрения
- 21. Аммиачная селитра (нитрат аммония) - прекрасное азотное удобрение. NH4NO3
- 22. Аммиачная селитра (нитрат аммония) – взрывчатое вещество.
- 23. Смесь нитрата аммония с алюминием и углем - аммонал (взрывные работы, в пиротехнике)
- 24. Нашатырь (хлорид аммония) Паяние, лужение металлов Изготовление гальванических элементов Хлорид аммония NH4Cl используют при паянии, так
- 25. Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском деле, так как они легко разлагаются
- 26. Знаете ли вы... Теннисные мячи не надувают, а вводят в них «вздуватели» - специальные вещества, которые
- 27. Задания на развитие творческого мышления Объясните, можно ли весной вносить в почву аммиачную селитру (нитрат аммония)
- 28. Повторим: 1.Выбрать и назвать соли аммония 2. Перечислите химические свойства солей аммония. 3. Назовите физические свойства
- 30. Скачать презентацию

























 Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Атомы и молекулы. Простые и сложные вещества (8 класс)
Атомы и молекулы. Простые и сложные вещества (8 класс) Углерод. Элемент IV группы
Углерод. Элемент IV группы Оксиды
Оксиды Алены. Строение, изомерия, номенклатура
Алены. Строение, изомерия, номенклатура ПРОСТЫЕ ВЕЩЕСТВА -НЕМЕТАЛЛЫ
ПРОСТЫЕ ВЕЩЕСТВА -НЕМЕТАЛЛЫ Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Трифенилметановые красители
Трифенилметановые красители Оксиды. 8 класс
Оксиды. 8 класс AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Галогены
Галогены Методы восстановления и окисления
Методы восстановления и окисления Современные представления о катализе. Общие закономерности гетерогенного катализа
Современные представления о катализе. Общие закономерности гетерогенного катализа Железо и его сплавы
Железо и его сплавы КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Влияние моющих средств на организм человека
Влияние моющих средств на организм человека Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Физические методы стабилизации масел
Физические методы стабилизации масел Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие р-элементы V группы (пниктогены) N, P, As, Sb, Bi
р-элементы V группы (пниктогены) N, P, As, Sb, Bi Аналитическая химия
Аналитическая химия Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Трансмиссионные масла
Трансмиссионные масла Простые вещества
Простые вещества