Содержание
- 2. Степень окисления — это тот условный заряд атома, который возникает на нем при условии, что электронные
- 3. МЕТОДЫ ВОССТАНОВЛЕНИЯ И ОКИСЛЕНИЯ Выбор восстановителя или окислителя определяется целевым продуктом, видом сырья, экономическими факторами, технологичностью
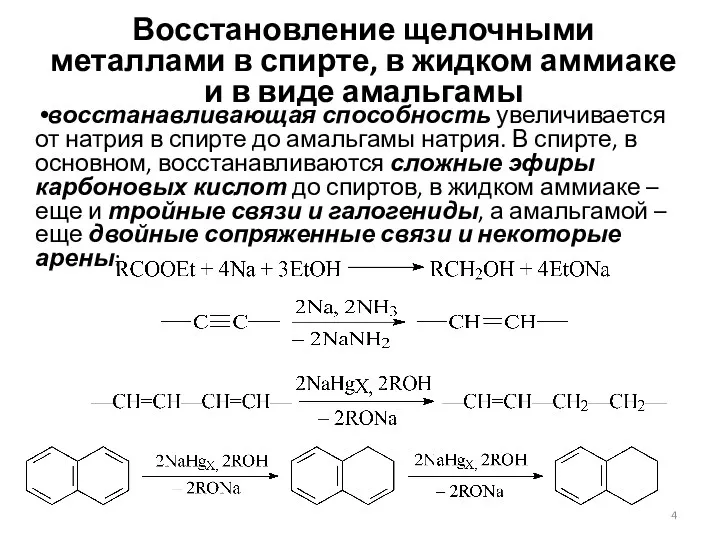
- 4. Восстановление щелочными металлами в спирте, в жидком аммиаке и в виде амальгамы восстанавливающая способность увеличивается от
- 5. Механизм восстановления натрием во всех случаях одинаков: атомы натрия отдают электроны, источником протонов является спирт, аммиак
- 6. Технология восстановления щелочными металлами в спирте, в жидком аммиаке и в виде амальгамы Методики восстановления простые,
- 7. Восстановление оловом, хлоридом олова (II) и железом в кислой среде, цинком в кислой и щелочной средах
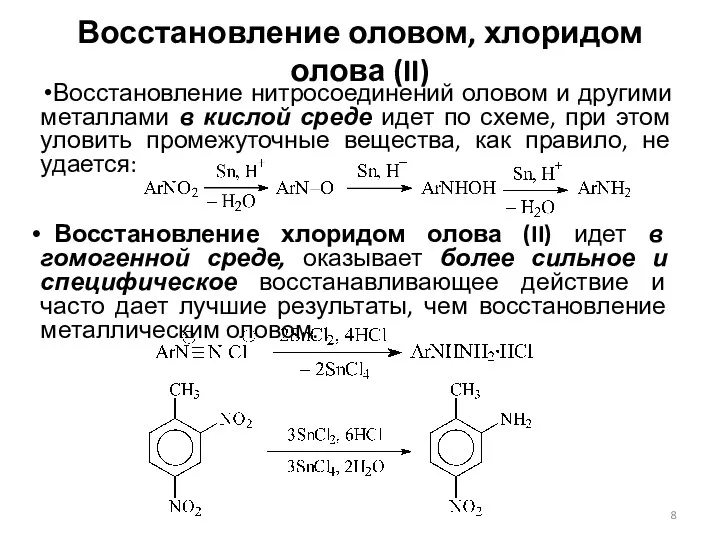
- 8. Восстановление оловом, хлоридом олова (II) Восстановление нитросоединений оловом и другими металлами в кислой среде идет по
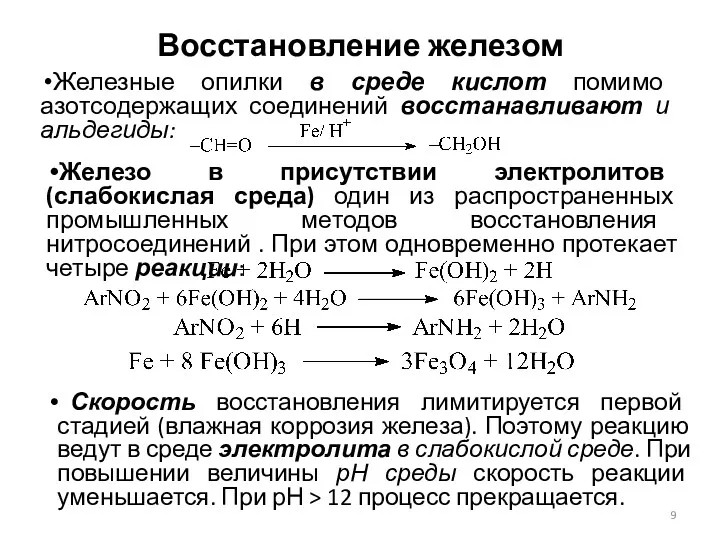
- 9. Восстановление железом Железные опилки в среде кислот помимо азотсодержащих соединений восстанавливают и альдегиды: Железо в присутствии
- 10. Технология восстановления железом в электролитах Электролиты (хлорид аммония, железа (II), и др.) можно получать в самом
- 11. Технология восстановления железом в электролитах В производстве восстановление проводят в стальных или чугунных аппаратах (редукторах), футерованных
- 12. Восстановление цинком более сильное восстанавливающее действие, чем у Fe в кислой среде цинком помимо азотсодержащих групп
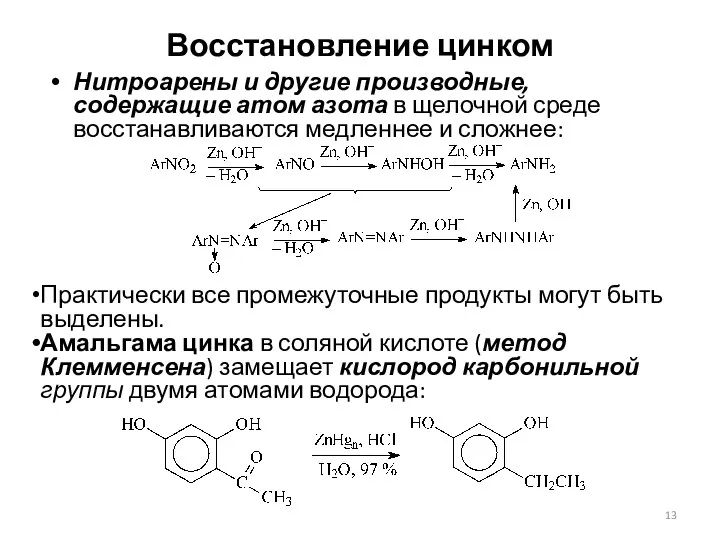
- 13. Восстановление цинком Нитроарены и другие производные, содержащие атом азота в щелочной среде восстанавливаются медленнее и сложнее:
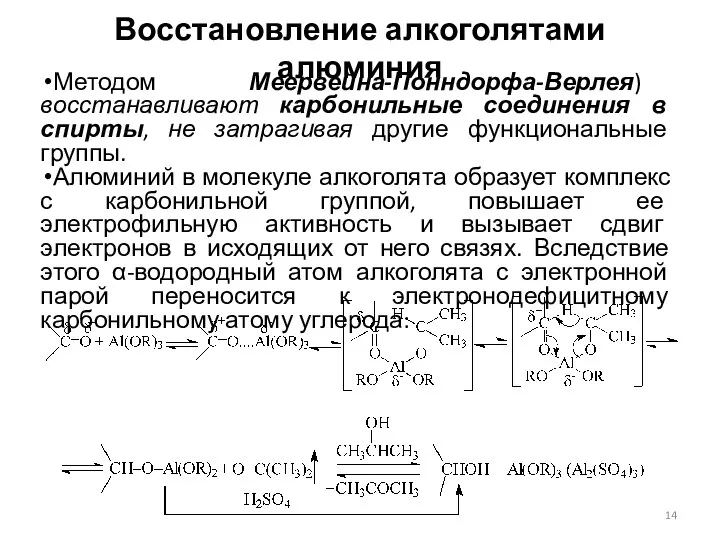
- 14. Восстановление алкоголятами алюминия Методом Меервейна-Понндорфа-Верлея) восстанавливают карбонильные соединения в спирты, не затрагивая другие функциональные группы. Алюминий
- 15. Восстановление гидридами металлов сильные восстановители (LiAlH4 и NaBH4), используются для восстановления полярных двойных связей углерод–гетероатом, в
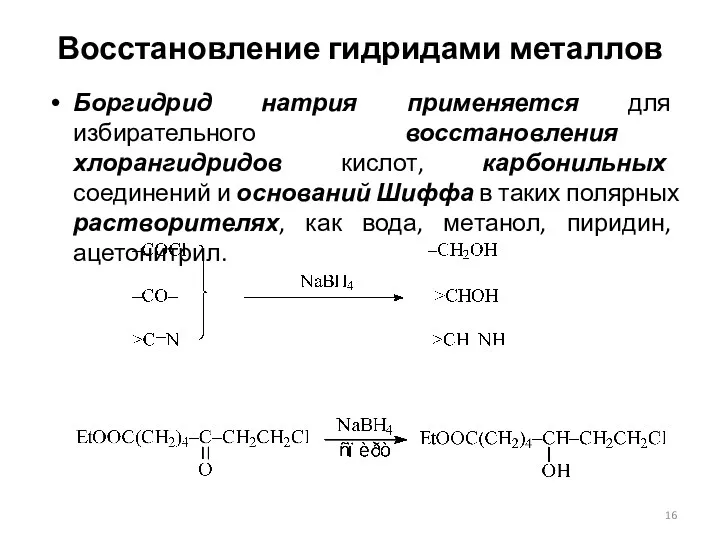
- 16. Восстановление гидридами металлов Боргидрид натрия применяется для избирательного восстановления хлорангидридов кислот, карбонильных соединений и оснований Шиффа
- 17. Каталитическое восстановление водородом Достоинства: универсальность, высокая скорость процесса, чистота получаемых продуктов и простота их выделения. Недостатки:
- 18. Катализаторы В химико-фармацевтической промышленности широко применяют скелетный катализатор никель Ренея при нагревании в автоклавах, реже платиновые
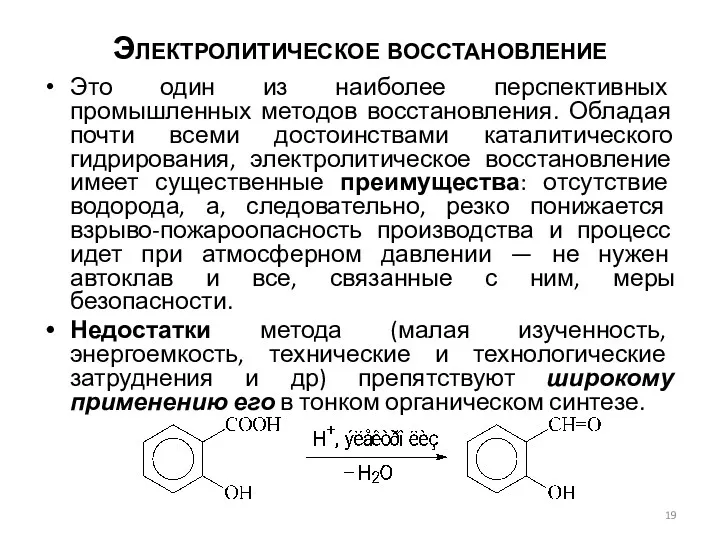
- 19. Электролитическое восстановление Это один из наиболее перспективных промышленных методов восстановления. Обладая почти всеми достоинствами каталитического гидрирования,
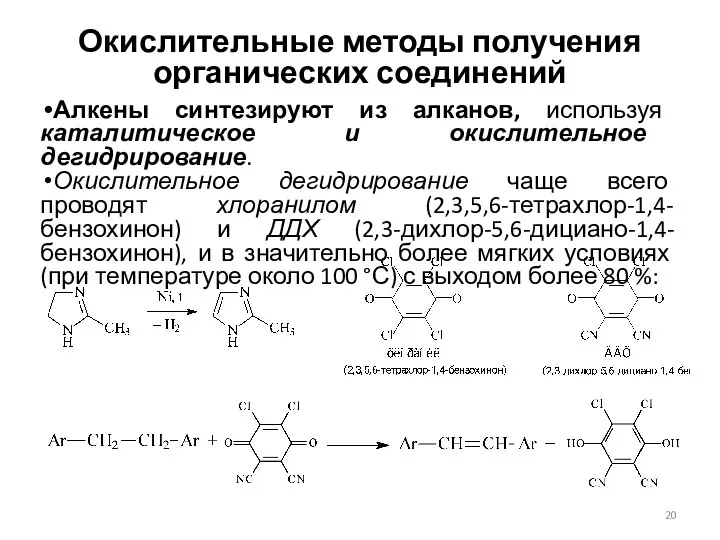
- 20. Окислительные методы получения органических соединений Алкены синтезируют из алканов, используя каталитическое и окислительное дегидрирование. Окислительное дегидрирование
- 21. Получение карбонильных соединений Альдегиды, как правило, окисляются легче, чем субстрат, полимеризуются и конденсируются, поэтому их лучше
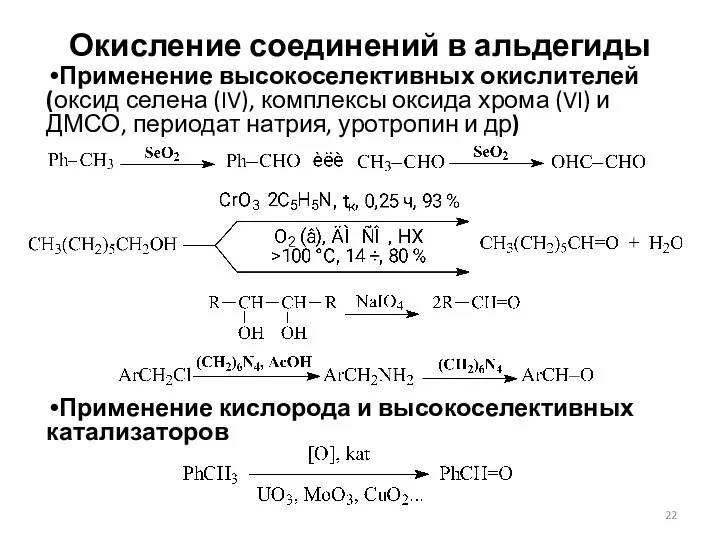
- 22. Окисление соединений в альдегиды Применение высокоселективных окислителей (оксид селена (IV), комплексы оксида хрома (VI) и ДМСО,
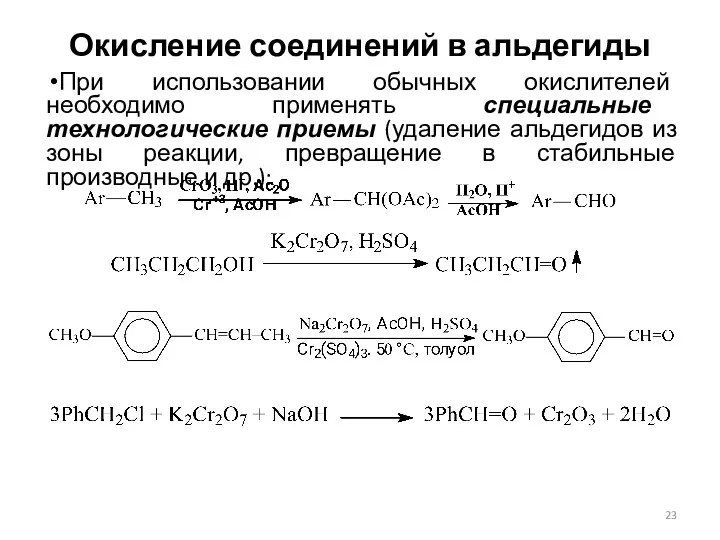
- 23. Окисление соединений в альдегиды При использовании обычных окислителей необходимо применять специальные технологические приемы (удаление альдегидов из
- 24. Окисление алканов и активированные группы в карбоновые кислоты Алканы окисляют кислородом на катализаторе. Активированные алкильные группы
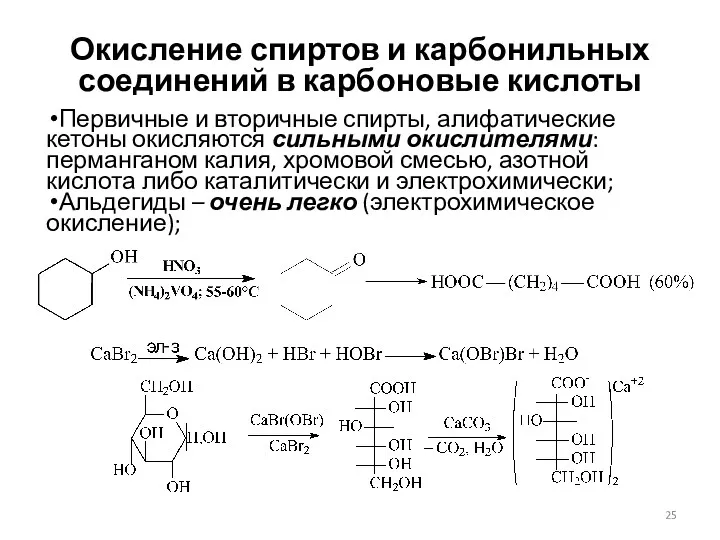
- 25. Окисление спиртов и карбонильных соединений в карбоновые кислоты Первичные и вторичные спирты, алифатические кетоны окисляются сильными
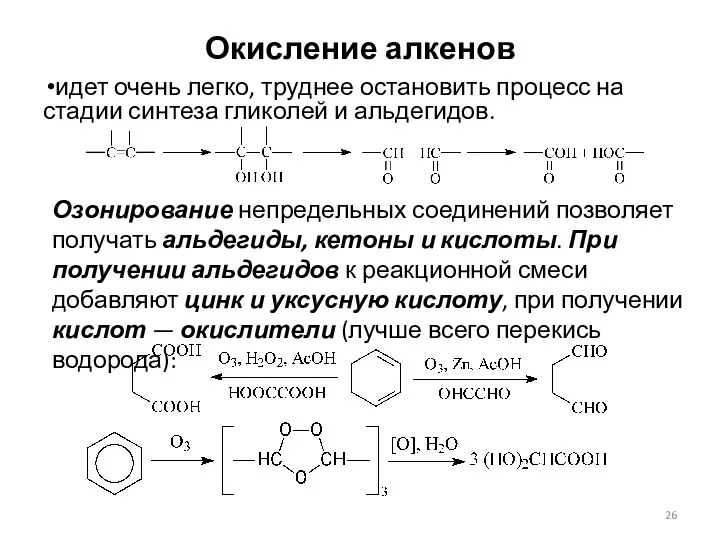
- 26. Окисление алкенов идет очень легко, труднее остановить процесс на стадии синтеза гликолей и альдегидов. Озонирование непредельных
- 28. Скачать презентацию













 Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Решение задач. Органическая химия
Решение задач. Органическая химия Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Химическая наука и промышленность в годы Великой Отечественной войны
Химическая наука и промышленность в годы Великой Отечественной войны Метал конструкциялық материалдар
Метал конструкциялық материалдар Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов
Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов Solutions and solubilities
Solutions and solubilities Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Супрамолекулярные системы – мост между неживой и живой материей
Супрамолекулярные системы – мост между неживой и живой материей Комплексные соединения
Комплексные соединения Углеводы (сахариды)
Углеводы (сахариды) Амфотерные соединения
Амфотерные соединения Предмет органической химии
Предмет органической химии Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Водород. Н2
Водород. Н2 Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Минералы и формы существования марганца
Минералы и формы существования марганца Жидкостная хроматография
Жидкостная хроматография Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химия - тұрмыста
Химия - тұрмыста Строение и физические свойства металлов
Строение и физические свойства металлов Натуральный каучук
Натуральный каучук Классификация и свойства оксидов
Классификация и свойства оксидов Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання