Содержание
- 2. 9 класс
- 3. Амфотерными называются вещества, которые в зависимости от условий проявляют кислотно-основную двойственность. Рассмотрим взаимодействие хлорида цинка с
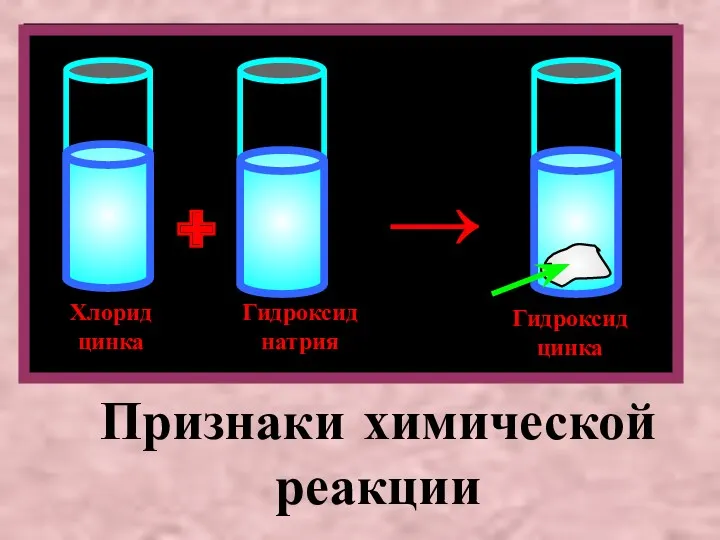
- 4. Хлорид цинка Гидроксид натрия Гидроксид цинка + → Признаки химической реакции
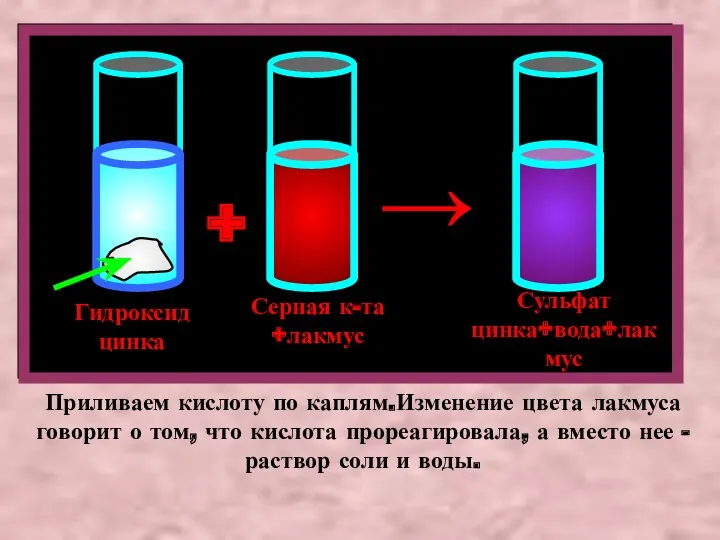
- 5. Прильем к взвеси гидроксида цинка (основанию) раствор серной кислоты.Произойдет реакция нейтрализации.Чтобы лучше наблюдать признак этой реакции,
- 6. Гидроксид цинка Серная к-та +лакмус + Сульфат цинка+вода+лакмус → Приливаем кислоту по каплям.Изменение цвета лакмуса говорит
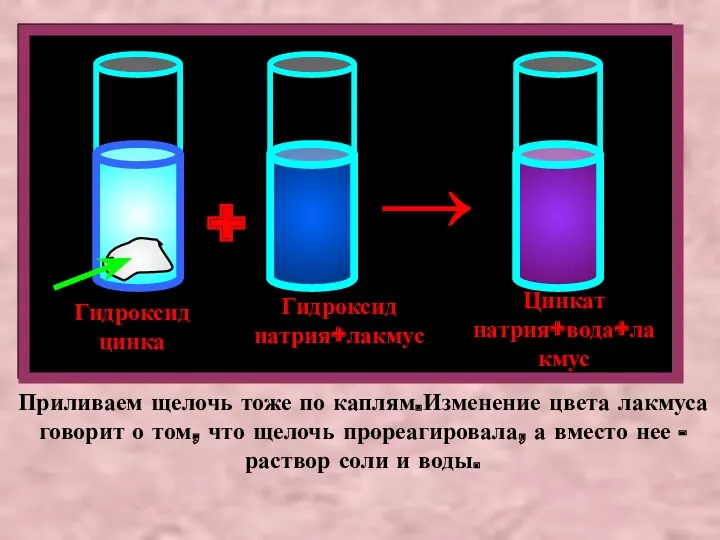
- 7. А теперь прильем к взвеси гидроксида цинка избыток раствора щелочи, также подкрашенный лакмусом. Осадок растворится, а
- 8. Гидроксид цинка Гидроксид натрия+лакмус + Цинкат натрия+вода+лакмус → Приливаем щелочь тоже по каплям.Изменение цвета лакмуса говорит
- 9. вывод: Гидроксид цинка ведет себя двояко: с кислотой- как основание, а со щелочью- как кислота. В
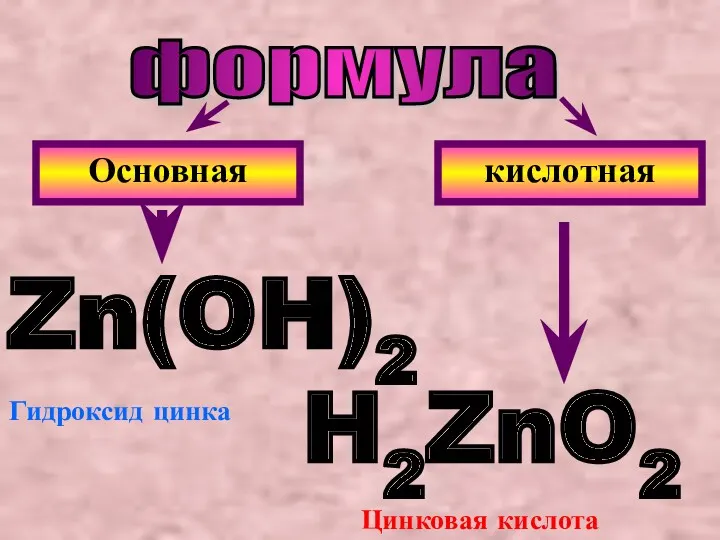
- 10. формула Основная кислотная Zn(OH)2 H2ZnO2 Гидроксид цинка Цинковая кислота
- 11. Амфотерные соединения образуют металлы. Те Ме, которым соответствуют амфотерные гидроксиды, называются переходными.Это металлы главных подгрупп с
- 12. Алюминий (главная подгруппа 3 группы) гидроксид Al(ОН)3 Н3AlО3(соль - алюминат) Хром (побочная подгруппа 6 группы) гидроксид
- 13. Химические свойства амфотерных оксидов С кислотами с образованием соли и воды Cr2O3 +2H3PO4 = 2CrPO4 +3H2O
- 14. Со щелочами с образованием соли и воды Cr2O3 +6NaOH = 2Na3CrO3 +3H2O Оксид хрома (III) Хромит
- 15. С кислотами с образованием соли и воды Ве(ОН)2 + 2НСl = ВеСl2 + 2Н2О Гидроксид бериллия
- 16. Со щелочами с образованием соли и воды Ве(ОН)2 + 2NaOH = Na2ВеO2 + 2Н2О Гидроксид бериллия
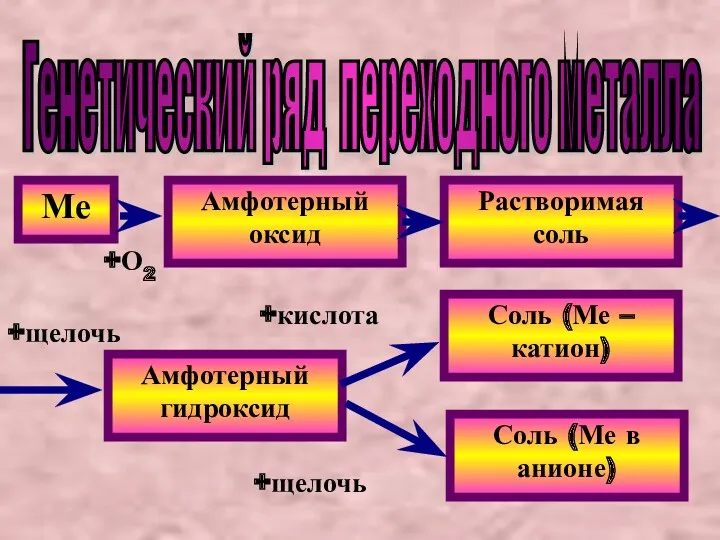
- 17. Генетический ряд переходного металла Ме Амфотерный оксид Растворимая соль Амфотерный гидроксид Соль (Ме – катион) Соль
- 18. 11 класс
- 19. Диссоциация амфотерных соединений Согласно теории С.Аррениуса , амфотерное соединение при диссоциации образует как протоны Н+, так
- 20. Н2О Н++ОН- Протолитическая теория Бренстед Согласно протолитической теории Бренстеда - Лоури, кислота – донор протона, а
- 21. Н2SO4→2H++SO42- Это доноры протонов⇒ это кислоты(серная и уксусная) СН3СOОН→H++СН3СОО- NН3+H+→[NH4]+ CH3NН2+H+→[ CH3NН3]+ Аммиак и метиламин акцепторы
- 22. Рассмотрим поведение в растворе аминоуксусной кислоты(глицина) H2N-CH2-COOH В этом веществе имеется и донор протона(карбоксильная группа), и
- 23. Вывод формул амфотерных гидроксидов по соответствующим оксидам Напоминаем, что многие амфотерные соединения ∈металлам побочных подгрупп с
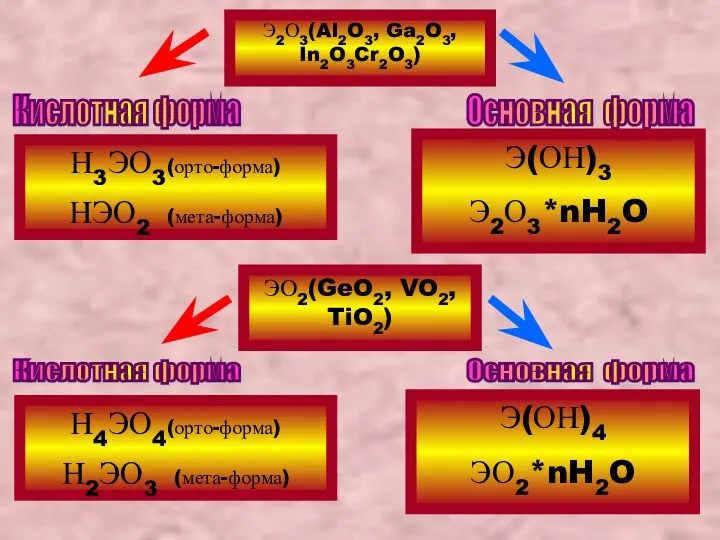
- 24. ЭО2(GeO2, VO2, TiO2) Кислотная форма Основная форма Э2О3(Al2O3, Ga2O3, In2O3Cr2O3) Кислотная форма Основная форма Н3ЭО3(орто-форма) НЭО2
- 26. Скачать презентацию














![Н2SO4→2H++SO42- Это доноры протонов⇒ это кислоты(серная и уксусная) СН3СOОН→H++СН3СОО- NН3+H+→[NH4]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240831/slide-20.jpg)


 Химические свойства кислот в свете теории электролитической диссоциации
Химические свойства кислот в свете теории электролитической диссоциации Расчет материального и теплового баланса процесса пиролиза гексана
Расчет материального и теплового баланса процесса пиролиза гексана Активационный анализ
Активационный анализ Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Непредельные углеводороды
Непредельные углеводороды Моноядерні арени
Моноядерні арени Титриметрический метод анализа
Титриметрический метод анализа Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Особенности дисперсных систем
Особенности дисперсных систем Решение задачи №4. Старость - на радость. Команда Карбораны
Решение задачи №4. Старость - на радость. Команда Карбораны Сплавы и коррозия металлов
Сплавы и коррозия металлов Основания. Значение оснований
Основания. Значение оснований Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Дослідження методів очищення висококольорових поверхневих вод
Дослідження методів очищення висококольорових поверхневих вод Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Свинец
Свинец Separation amp confirmation
Separation amp confirmation Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Тепловой эффект химической реакции
Тепловой эффект химической реакции Вода з точки зору хімії
Вода з точки зору хімії Циклоалкандар
Циклоалкандар Основи. Хімія
Основи. Хімія Металлы. Определения. Положение в периодической системе. Металлы в алхимии
Металлы. Определения. Положение в периодической системе. Металлы в алхимии Соли (12 класс)
Соли (12 класс) Крахмал. Строение вещества. Физические и химические свойства
Крахмал. Строение вещества. Физические и химические свойства Гидрокарбонат натрия NaHCO₃
Гидрокарбонат натрия NaHCO₃ Натуральный каучук
Натуральный каучук Требования к осадителю
Требования к осадителю