Слайд 2
![Количество моль эквивалента добавленного реагента R n[fэкв (R)] Количество моль](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-1.jpg)
Количество моль эквивалента добавленного реагента R
n[fэкв (R)]
Количество моль определяемого компонента Х
n[fэкв
(Х)]
Условие эквивалентности:
n[fэкв (R)] = n[fэкв (Х)]
Слайд 3

Закон эквивалентности
растворы одинаковой концентрации эквивалентов взаимодействуют в равных объёмах
Слайд 4

Слайд 5

Слайд 6

Требования к реакциям в титриметрии
Слайд 7

Слайд 8
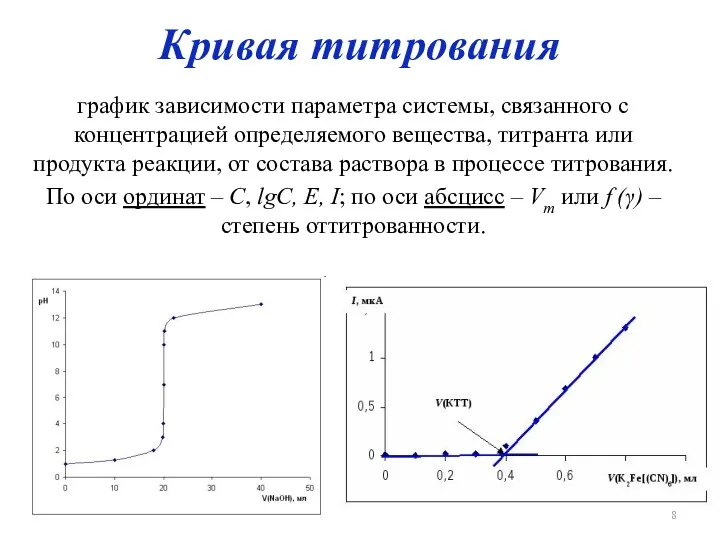
Кривая титрования
график зависимости параметра системы, связанного с концентрацией определяемого вещества,
титранта или продукта реакции, от состава раствора в процессе титрования.
По оси ординат – C, lgC, Е, I; по оси абсцисс – Vт или f (γ) – степень оттитрованности.
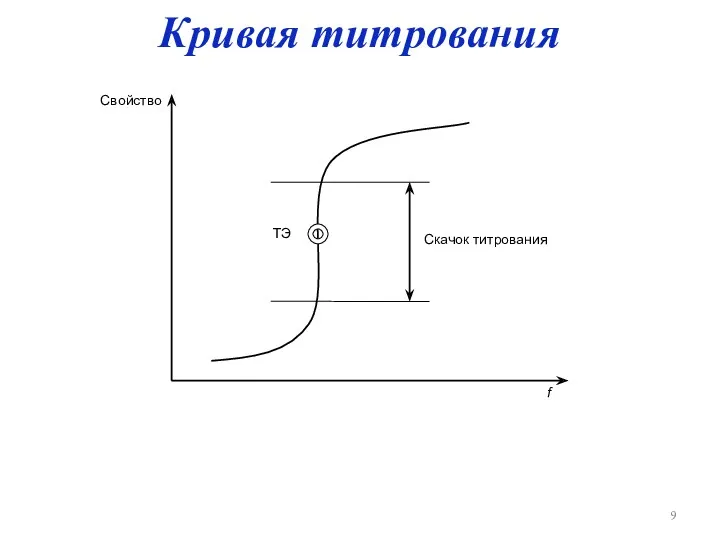
Слайд 9
Слайд 10

Первичные и вторичные стандарты
Первичные стандартные вещества должны отвечать ряду требований:
Быть
химически чистыми, строго соответствовать химической формуле;
Иметь определенный состав и не изменять его на воздухе при комнатной температуре;
Иметь достаточно большую эквивалентную массу, чтобы уменьшить влияние неизбежной погрешности взвешивания;
Реакция между определяемым веществом и титрантом должна протекать быстро и стехиометрично;
Хорошо растворяться в воде или подходящем органическом растворителе.
Примеры: Na2B4O7∙10H2O, Na2CO3, H2C2O4∙2H2O, С6Н5СООН, H2C4H4O4 (янтарная кислота), K2Cr2O7, CaCO3, ZnO, KBrO3, NaCl.
Примеры вторичных стандартов: NaOH, HCl, H2SO4, KOH, KMnO4, Na2S2O3 и др.
Слайд 11

Методы титриметрического анализа
Слайд 12

Слайд 13

Слайд 14
![Обратное титрование n[fэкв (Х)] = n[fэкв (R)] - n[fэкв(R/)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-13.jpg)
Обратное титрование
n[fэкв (Х)] = n[fэкв (R)] - n[fэкв(R/)]
Слайд 15
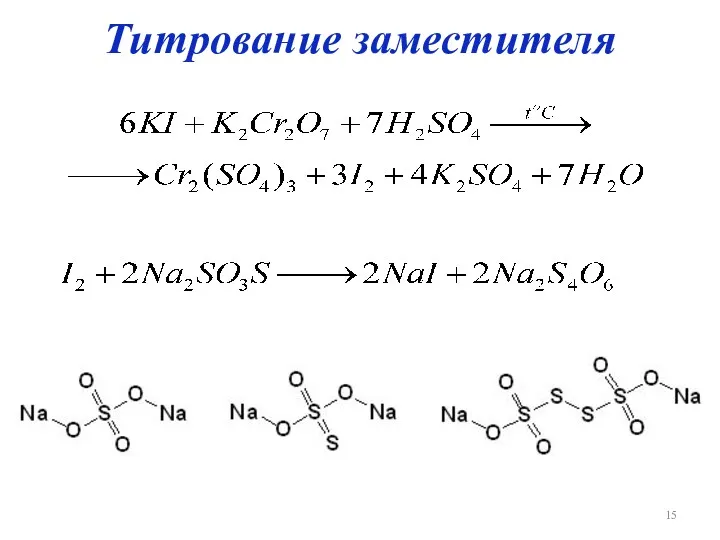
Слайд 16
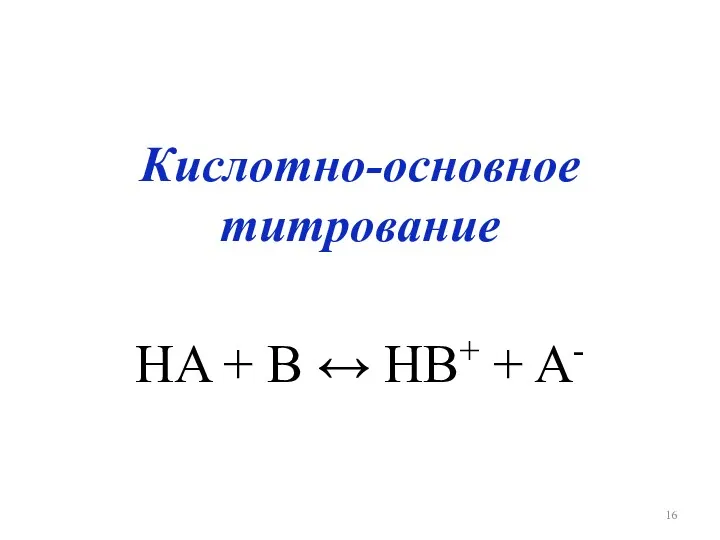
Кислотно-основное титрование
HA + B ↔ HB+ + A-
Слайд 17

Слайд 18

Слайд 19
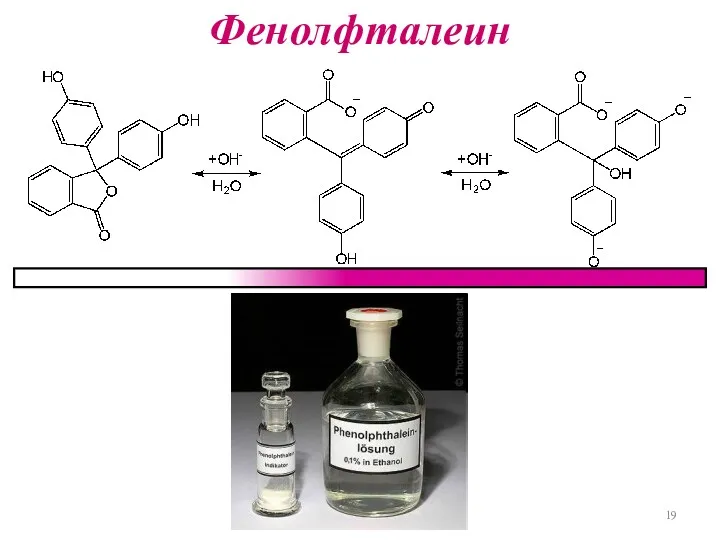
Слайд 20

Показатель титрования
рТ – показатель титрования
рН = рКа
Слайд 21
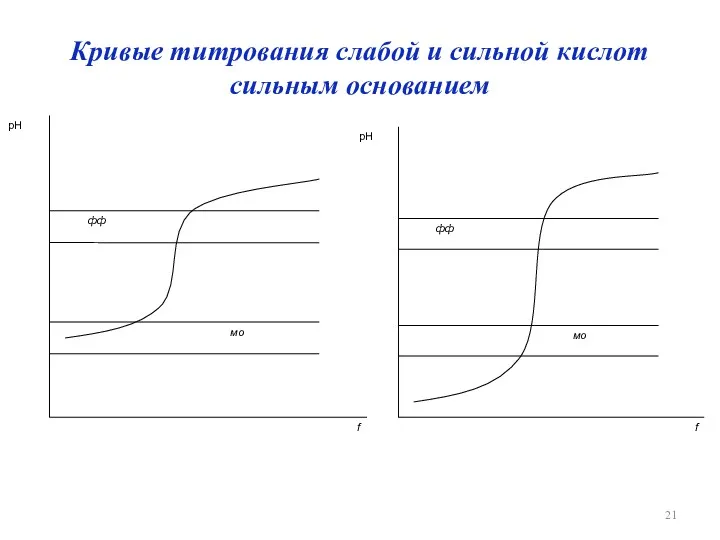
Кривые титрования слабой и сильной кислот сильным основанием
Слайд 22

Комплексонометрическое титрование
Слайд 23

Комплексонометрическое титрование
– метод количественного анализа, основанный на аналитическом использовании реакций
комплексообразования ионов металлов с полидентатными хелатообразующими органическими аналитическими реагентами – комплексонами.
Слайд 24
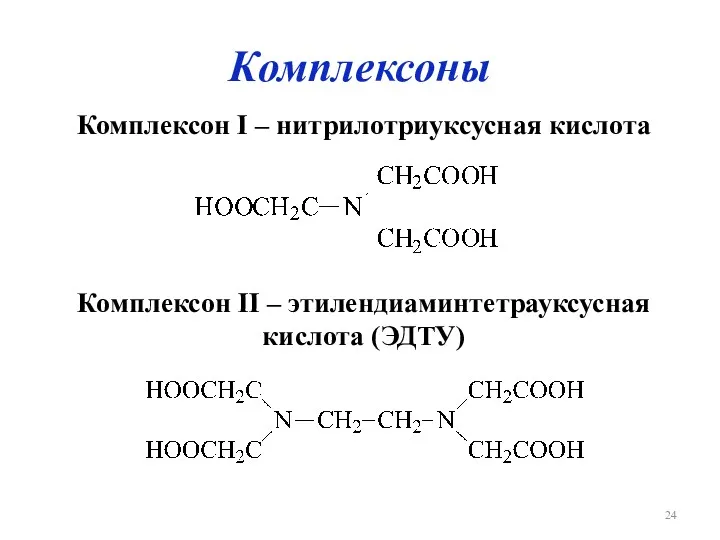
Комплексоны
Комплексон I – нитрилотриуксусная кислота
Комплексон II – этилендиаминтетрауксусная кислота (ЭДТУ)
Слайд 25

Комплексоны
Комплексон III – двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА)
Слайд 26

Слайд 27

Приемы повышения избирательности комплексонометрического титрования
Селективность комплексонометрического титрования обеспечивается:
1) в результате предварительного
разделения ионов определяемого иона и мешающих ионов различными методами (осаждение, экстракция, ионный обмен и др.);
2) выбором оптимальных условий титрования: регулирование рН среды и подбор подходящего маскирующего агента.
Слайд 28

Металлохромные индикаторы
Слайд 29
![натриевая соль 3-окси-4-[(1-окси-2-нафтил)азо]-7-нитронафталин-1-сульфокислоты ЭХЧТ Эриохромовый черный Т](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-28.jpg)
натриевая соль 3-окси-4-[(1-окси-2-нафтил)азо]-7-нитронафталин-1-сульфокислоты
ЭХЧТ
Эриохромовый черный Т
Слайд 30

Слайд 31
Слайд 32

Мурексид
Аммонийная соль пурпурной кислоты
Слайд 33
![натриевая соль 3,3/-бис-[N,N-ди-(карбоксиметил)-аминометил]-о-крезолсульфофталеина Ксиленоловый оранжевый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-32.jpg)
натриевая соль 3,3/-бис-[N,N-ди-(карбоксиметил)-аминометил]-о-крезолсульфофталеина
Ксиленоловый оранжевый
Слайд 34

Окислительно-восстановительное титрование
Слайд 35

Перманганатометрия
MnO4- + 8H3O+ + 5ē ↔ Mn2+ + 12H2O,
MnO4- + 4H3O+
+ 3ē ↔ MnO2 ↓ + 6H2O.
В качестве первичных стандартов для стандартизации раствора KMnO4 используют H2C2O4∙2Н2О, Na2C2O4, оксид мышьяка (III), соль Мора ((NH4)2[Fe(SO4)2]·6H2O), желтую кровяную соль K4[Fe(CN)6], Fe особой чистоты и др.
Слайд 36
![Дихроматометрия Cr2O72- + 14H3O+ + 6ē ↔ 2[Cr(H2O)6]3+ + 9H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-35.jpg)
Дихроматометрия
Cr2O72- + 14H3O+ + 6ē ↔ 2[Cr(H2O)6]3+ + 9H2O
3С + 2K2Cr2O7
+ 8H2SO4 + 16H2O ↔ 3CO2 ↑ + 2[Cr(H2O)6]2(SO4)3 + 2K2SO4,
K2Cr2O7 + 6FeSO4 + 7H2SO4 + 5H2O ↔ [Cr(H2O)6]2(SO4)3 + 3Fe2(SO4)3 + K2SO4.
Слайд 37
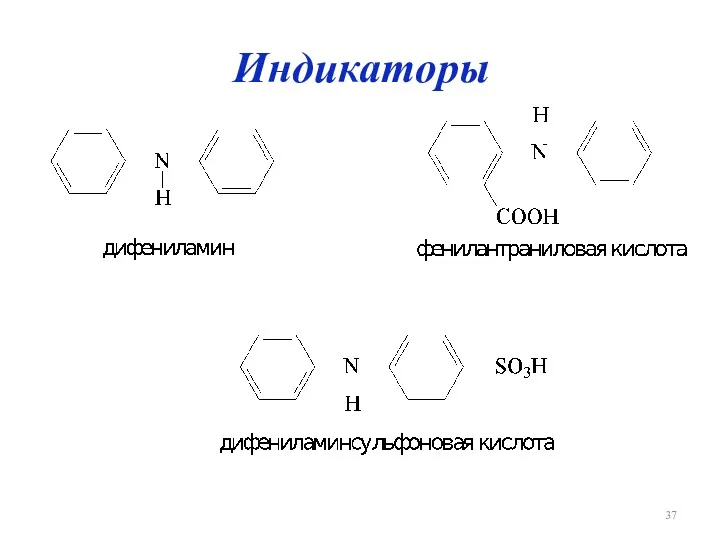
Слайд 38
![Церийметрия (NH4)2[Ce(NO3)6] Первичные стандарты: As2O3, Na2C2O4, Fe В качестве индикатора используют ферроин, а также нитроферроин.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-37.jpg)
Церийметрия
(NH4)2[Ce(NO3)6]
Первичные стандарты: As2O3, Na2C2O4, Fe
В качестве индикатора используют ферроин, а также
нитроферроин.
Слайд 39
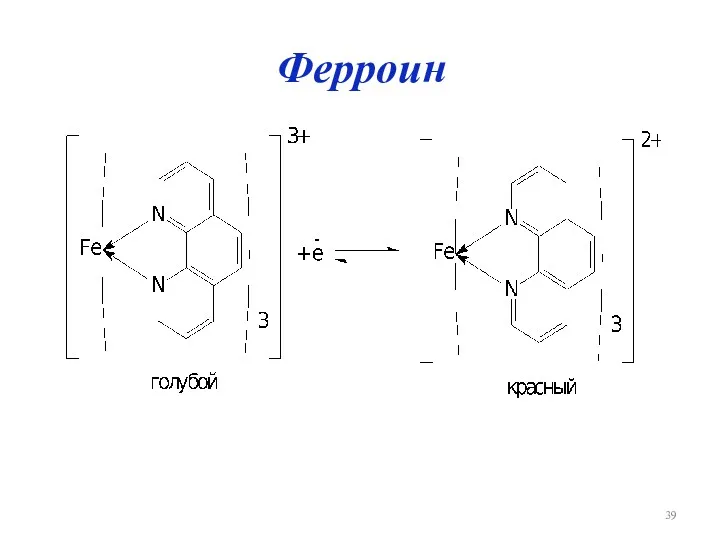
Слайд 40
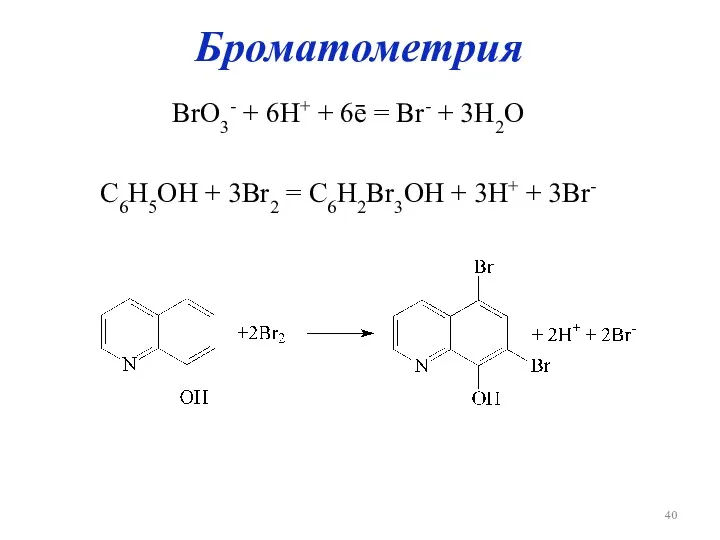
Броматометрия
BrO3- + 6H+ + 6ē = Br- + 3H2O
C6H5OH + 3Br2
= C6H2Br3OH + 3H+ + 3Br-
Слайд 41

Йодометрия
I2 + 2ē ↔ 2I-
I2 + 2OH- ↔ IO- + I-
+ H2O
4I- + O2 + 4H3O+ ↔ 2I2 + 6H2O
Слайд 42
![Йодометрия As2O3 ↓ + 6NaOH + H2O ↔ 2Na3[AsO(OH)4] I2 + 2S2O3- ↔ 2I- + S4O62-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-41.jpg)
Йодометрия
As2O3 ↓ + 6NaOH + H2O ↔ 2Na3[AsO(OH)4]
I2 + 2S2O3- ↔
2I- + S4O62-
Слайд 43

Значащие цифры
В числах 0,12 и 0,012 находится по две значащие цифры.
В
числах 106 и 0,0106 находится по три значащих цифры.
Слайд 44

Наименьшие разряды числовых значений результата измерений и погрешности должны быть одинаковы:
20,56 ± 0,25 или 2,1 ± 0,1.
Слайд 45

Правила округления
1. результат 3,2800 при погрешности 0,001 округляют до 3,280;
2. число
267 245 при сохранении четырех значащих цифр должно быть округлено до 267 200; число 165,245 до165,2;
3. 14597→14600; 123,58→124.
Слайд 46

Правила вычислений с участием приближенных значений
Сложение или вычитание
4,462 + 2,38 +
1,17273 - 1,0262 = 6,99
Умножение или деление
![Количество моль эквивалента добавленного реагента R n[fэкв (R)] Количество моль](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-1.jpg)











![Обратное титрование n[fэкв (Х)] = n[fэкв (R)] - n[fэкв(R/)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-13.jpg)

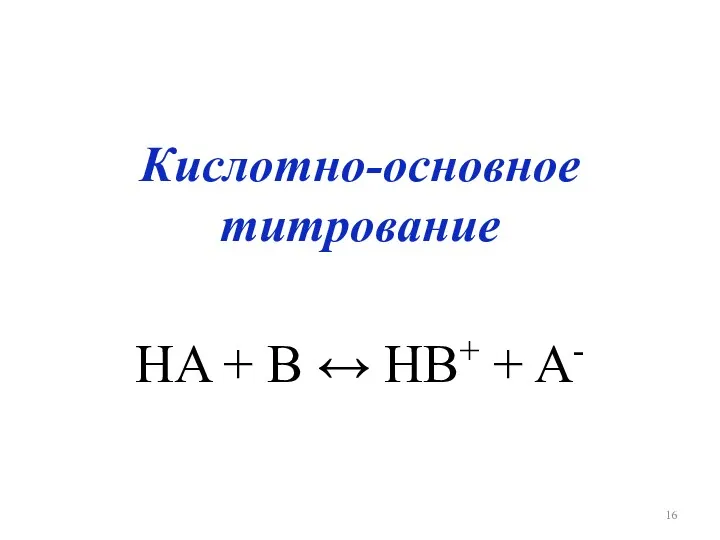












![натриевая соль 3-окси-4-[(1-окси-2-нафтил)азо]-7-нитронафталин-1-сульфокислоты ЭХЧТ Эриохромовый черный Т](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-28.jpg)



![натриевая соль 3,3/-бис-[N,N-ди-(карбоксиметил)-аминометил]-о-крезолсульфофталеина Ксиленоловый оранжевый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-32.jpg)


![Дихроматометрия Cr2O72- + 14H3O+ + 6ē ↔ 2[Cr(H2O)6]3+ + 9H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-35.jpg)

![Церийметрия (NH4)2[Ce(NO3)6] Первичные стандарты: As2O3, Na2C2O4, Fe В качестве индикатора используют ферроин, а также нитроферроин.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-37.jpg)



![Йодометрия As2O3 ↓ + 6NaOH + H2O ↔ 2Na3[AsO(OH)4] I2 + 2S2O3- ↔ 2I- + S4O62-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/216768/slide-41.jpg)




 Коллоидные ПАВ
Коллоидные ПАВ Теории кислот и оснований
Теории кислот и оснований α-Аминокислоты и белки
α-Аминокислоты и белки Реакции ионного обмена
Реакции ионного обмена Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Природные источники углеводородов
Природные источники углеводородов Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Атом – сложная частица
Атом – сложная частица Каликсарены
Каликсарены Основания. 8 класс
Основания. 8 класс 20230419_izomery
20230419_izomery Газовая хроматография
Газовая хроматография Кислоты и их свойства
Кислоты и их свойства Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Классы неорганических веществ
Классы неорганических веществ Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Гидролиз солей
Гидролиз солей Високомолекулярні сполуки
Високомолекулярні сполуки Общая характеристика неметаллов
Общая характеристика неметаллов Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Три элемента таблицы Менделеева
Три элемента таблицы Менделеева Роль хімії у житті суспільства
Роль хімії у житті суспільства Подгруппа меди. Элементы 11 группы (Cu,Ag,Au)
Подгруппа меди. Элементы 11 группы (Cu,Ag,Au)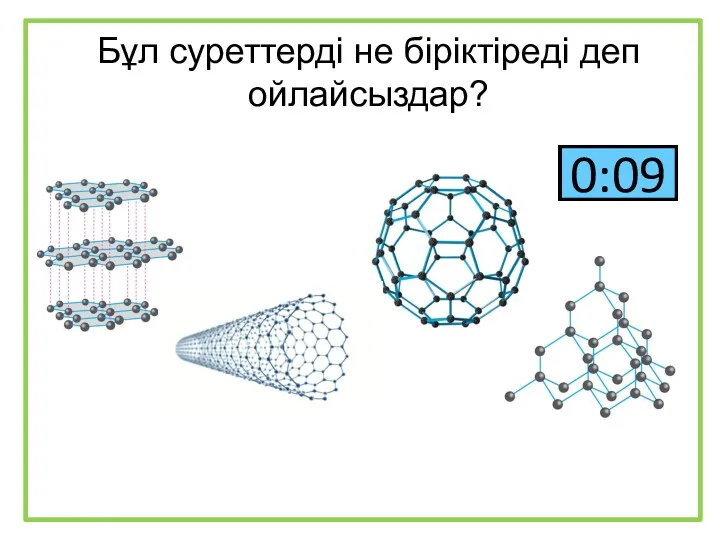 Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар? Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Классификация, строение и номенклатура органически. Предмет органической химии
Классификация, строение и номенклатура органически. Предмет органической химии Органикалық заттардың ерекшелігі
Органикалық заттардың ерекшелігі Сложные эфиры. Жиры
Сложные эфиры. Жиры