Содержание
- 2. План Требования к реакциям осадительного титрования Классификация методов осадительного титрования Кривые осадительного титрования Способы определения КТТ
- 3. Классификация: аргентометрия (АgNO3); тиоцианатометрия (NH4SCN); меркурометрия (Hg2(NO3)2 или Hg2(ClO4)2); гексацианоферратометрия (K4[Fe(CN)6]); сульфатометрия (H2SO4); бариометрия (BaCl2); плюмбометрия
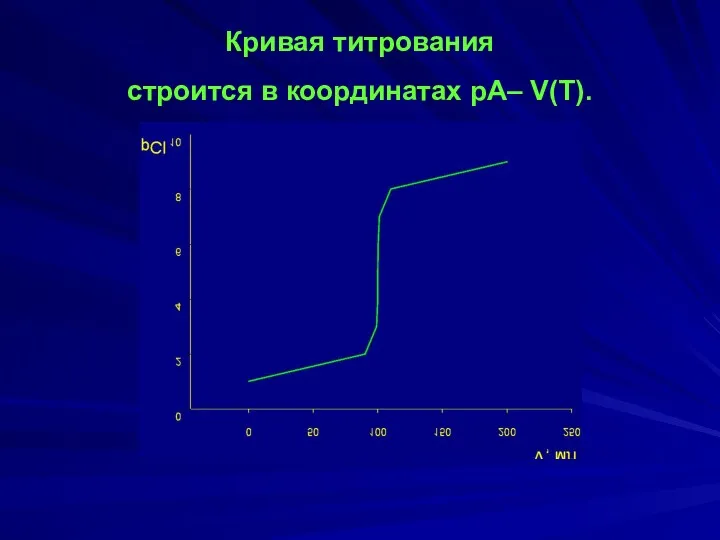
- 4. Кривая титрования строится в координатах рА– V(T).
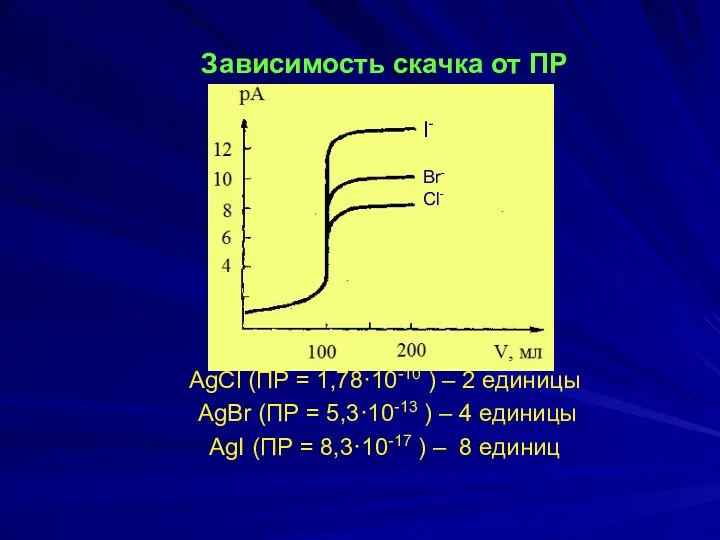
- 5. Зависимость скачка от ПР AgCl (ПР = 1,78·10-10 ) – 2 единицы AgBr (ПР = 5,3·10-13
- 6. Осадительные индикаторы Ag+ + Cl- ⇆ AgCl↓ 2 Ag+ + CrO42- ⇆ Ag2CrO4↓ Определение проводят при
- 7. Металлохромные индикаторы железоаммонийные квасцы FeNH4(SO4)2·12H2O Ag+ + SCN- → AgSCN↓ После ТЭ, когда все катионы серебра
- 8. Адсорбционные индикаторы НInd ⇆ Н+ + Ind- Ag+ + Br - → AgBr↓ До ТЭ: {m
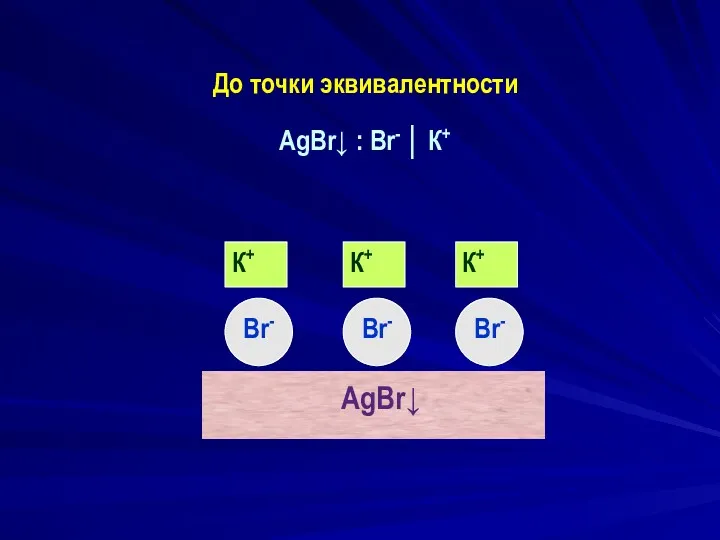
- 9. До точки эквивалентности AgBr↓ : Br- │ К+ AgBr↓ К+ Br- Br- Br- К+ К+
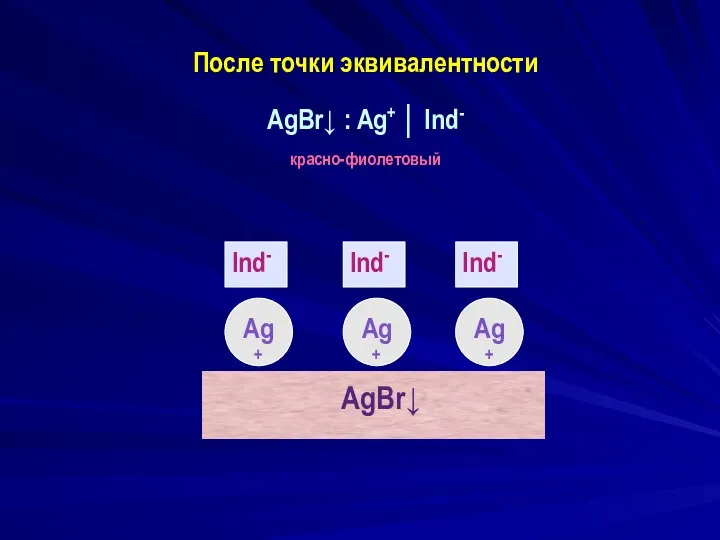
- 10. После точки эквивалентности AgBr↓ : Ag+ │ Ind- красно-фиолетовый AgBr↓ Ind- Ag+ Ag+ Ag+ Ind- Ind-
- 11. Аргентометрия Ag+ + Х- ⇆ AgХ↓, где Х- = Cl-, Br -, I-, CN-, SCN- и
- 12. МЕТОДЫ АРГЕНТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ Метод Гей-Люссака Метод Мора Метод Фаянса-Фишера-Ходакова Метод Фольгарда
- 13. При определении хлоридов по методу Фольгарда возможен перерасход титранта. ПРAgCl = 1,78·10-10 > ПРAgSCN = 1,1·10-12
- 14. При определении йодидов по методу Фольгарда при несоблюдении порядка прибавления реагентов возможна реакция: 2 I- +
- 15. Тиоцианатометрия Ag+ + SCN- ⇄ AgSCN↓ Hg22+ + 2 SCN- ⇄ Hg2(SCN)2↓ После ТЭ титруемый раствор
- 16. Меркурометрия Hg22+ + 2 Х- ⇄ Hg2Х2↓, где Х- = Cl-, Br -, I-, SCN-
- 17. Hg2+ + Hg ⇄ Hg22+
- 18. Hg22+ + 2 Cl- ⇄ Hg2Cl2↓ После ТЭ Hg22+ + 2 [Fe(SCN)]2+ ⇄ Hg2(SCN)2↓ + 2
- 20. Скачать презентацию













 Отличие дизельных и бензиновых двигателей
Отличие дизельных и бензиновых двигателей Профессия электромонтера
Профессия электромонтера Основное неравенство и основное уравнение термодинамики. Понятие о термодинамических потенциалах
Основное неравенство и основное уравнение термодинамики. Понятие о термодинамических потенциалах Сравнение количеств теплоты при смешивании воды разной температуры
Сравнение количеств теплоты при смешивании воды разной температуры Ядролык гамма резонанс. Мёссбауэр эффектісі
Ядролык гамма резонанс. Мёссбауэр эффектісі Основные свойства диэлектриков. Сегнетоэлектрики
Основные свойства диэлектриков. Сегнетоэлектрики Развитие взглядов на природу света
Развитие взглядов на природу света Фізичні та хімічні явища. (7 клас)
Фізичні та хімічні явища. (7 клас) Оборудование для смазочно-заправочных работ
Оборудование для смазочно-заправочных работ Деление ядер урана. Цепная ядерная реакция
Деление ядер урана. Цепная ядерная реакция Релейно-контактные схемы
Релейно-контактные схемы Презентация к уроку Диффузия в газах, жидкостях и твёрдых телах. Движение молекул
Презентация к уроку Диффузия в газах, жидкостях и твёрдых телах. Движение молекул Сообщающиеся сосуды
Сообщающиеся сосуды Сложные и нестандартные задачи ЕГЭ по физике
Сложные и нестандартные задачи ЕГЭ по физике Презентация по астрономии Меркурий
Презентация по астрономии Меркурий Кинематика. Равномерное движение
Кинематика. Равномерное движение Система учета расхода природного газа на основе волоконно-оптических датчиков
Система учета расхода природного газа на основе волоконно-оптических датчиков Гиперболический хаос
Гиперболический хаос Кузнечно-сварочная практика. Специальность 190604 Техническое обслуживание и ремонт автомобильного транспорта
Кузнечно-сварочная практика. Специальность 190604 Техническое обслуживание и ремонт автомобильного транспорта Цепные передачи
Цепные передачи Векторлар өрісінің циркуляциясы, роторы
Векторлар өрісінің циркуляциясы, роторы Плотность тела. формулы
Плотность тела. формулы ГИА по физике. Экспериментальные задания
ГИА по физике. Экспериментальные задания 4172dad3be7c4b86b096b96c9d21ee61
4172dad3be7c4b86b096b96c9d21ee61 Термоэлектрические материалы. Предмет, задачи и области применения термоэлектриков
Термоэлектрические материалы. Предмет, задачи и области применения термоэлектриков Электрический ток в металлах
Электрический ток в металлах План конспект урока по теме Испарение и конденсация 8 класс
План конспект урока по теме Испарение и конденсация 8 класс Связь физики с профессией
Связь физики с профессией