Основное неравенство и основное уравнение термодинамики. Понятие о термодинамических потенциалах презентация
Содержание
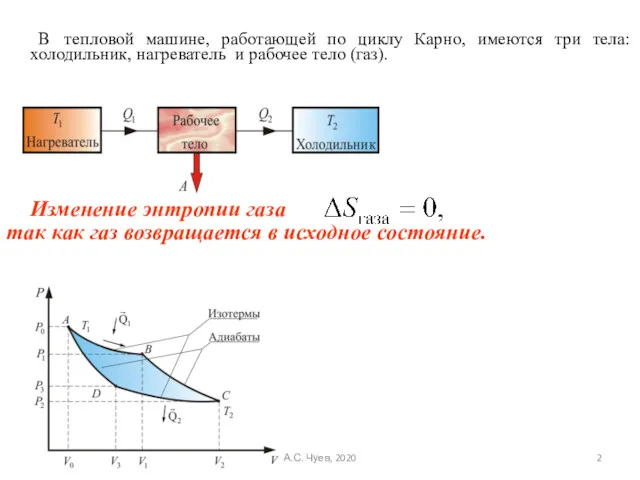
- 2. В тепловой машине, работающей по циклу Карно, имеются три тела: холодильник, нагреватель и рабочее тело (газ).
- 3. Рассмотрим обратимый и необратимый циклы Карно Обратимый цикл Карно. Для обратимого цикла коэффициент полезного действия можно
- 4. Так как любой замкнутый цикл можно представить как сумму бесконечного числа циклов Карно, то для любого
- 5. Математическое доказательство Оба интеграла равны независимо от пути интегрирования. А.С. Чуев, 2020
- 6. Это неравенство Клаузиуса Оно характеризует необратимые циклы При наличии тепловых потерь А.С. Чуев, 2020
- 7. или Вывод: При любом необратимом процессе в замкнутой системе энтропия возрастает (dS > 0). А.С. Чуев,
- 8. При обратимом процессе При необратимом процессе, как доказал Клаузиус − изменение энтропии больше приведенной теплоты. Тогда
- 9. Первое и второе начала термодинамики в объединенной форме имеют вид: Это основное соотношение термодинамики А.С. Чуев,
- 10. Понятие о термодинамических потенциалах Все расчеты в термодинамике основываются на использовании функций состояния, называемых термодинамическими потенциалами.
- 11. Понятие о термодинамических потенциалах Из сравнения двух формул получаем: Таким образом, энтропия представима как функция двух
- 12. А.С. Чуев, 2020
- 13. А.С. Чуев, 2020
- 14. А.С. Чуев, 2020
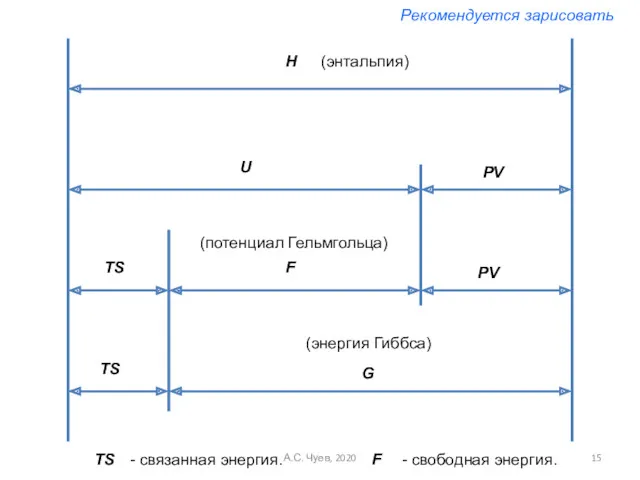
- 15. H U PV TS TS PV F G TS - связанная энергия. F - свободная энергия.
- 16. Свободная и связанная энергии Как следует из первого и второго начала термодинамики в объединенной форме в
- 17. Обозначим, , где F – разность двух функций состояний, поэтому сама является также функцией состояния. Ее
- 18. следовательно свободная энергия есть та работа, которую могло бы совершить тело в обратимом изотермическом процессе или,
- 19. Связанная энергия – та часть внутренней энергии, которая не может быть превращена в работу – это
- 20. 1. Прибавляя к обеим частям получим т.е. 2. Вычитая из обеих частей получим т.е. 3. Вычитая
- 21. Пять параметров состояния ТДС: U, P, V, T, S нет T,S и P,V А.С. Чуев, 2020
- 22. Соотношения Максвелла А.С. Чуев, 2020 Конец факультативного раздела
- 23. Если идеальный газ адиабатно расширяется и совершает при этом работу, то он охлаждается, так как работа
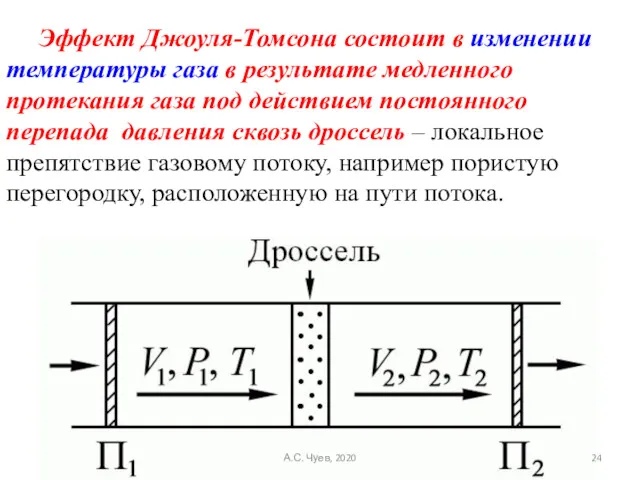
- 24. Эффект Джоуля-Томсона состоит в изменении температуры газа в результате медленного протекания газа под действием постоянного перепада
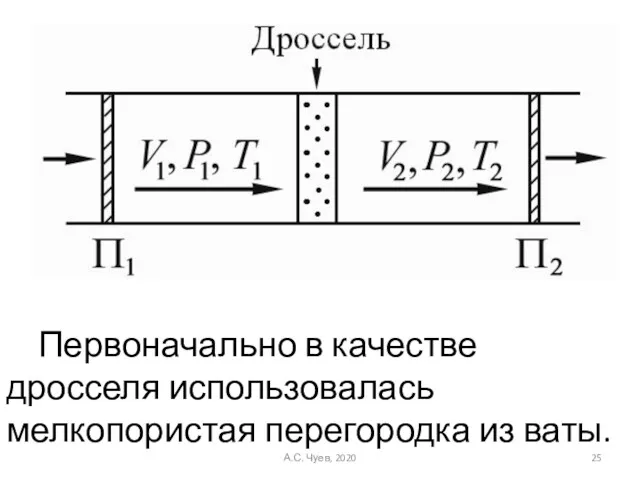
- 25. Первоначально в качестве дросселя использовалась мелкопористая перегородка из ваты. А.С. Чуев, 2020
- 26. Эффект Джоуля-Томсона свидетельствует о наличии в газе сил межмолекулярного взаимодействия. Газ совершает внешнюю работу – последующие
- 27. Совершенная над газом результирующая внешняя работа равна В адиабатических внешних условиях эта работа идет на изменение
- 28. Таким образом, в опыте Джоуля-Томсона сохраняется (остается неизменной) величина Она является функцией состояния и называется энтальпией.
- 29. Эффект Джоуля-Томсона принято называть положительным, если газ в процессе дросселирования охлаждается и отрицательным, если газ нагревается
- 30. Превращение любого газа в жидкость – сжижение газа – возможно лишь при температуре ниже критической. Критические
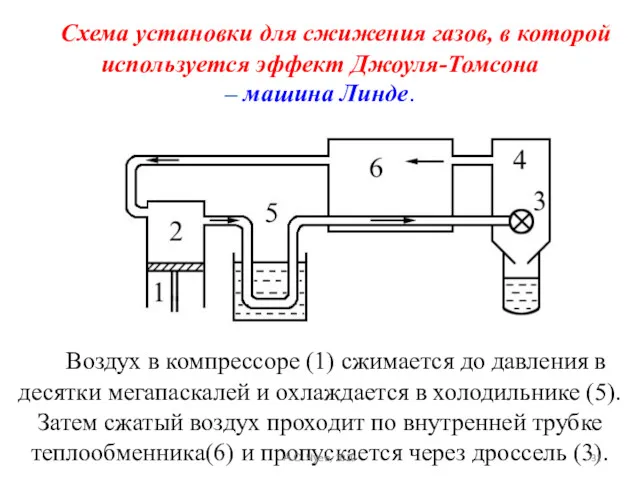
- 31. Схема установки для сжижения газов, в которой используется эффект Джоуля-Томсона – машина Линде. Воздух в компрессоре
- 32. Второй метод сжижения газов основан на охлаждении газа при совершении им работы. Сжатый газ, поступая в
- 33. Принцип Ле-Шателье - Брауна Термодинамическая система устойчива, если т. е. (первая вариация), необходимое условие (вторая вариация),
- 34. Введение в термодинамику необратимых процессов Принцип локального (детального) равновесия: внутри малых объемов выполняются основные уравнения ТД
- 35. Ключевую роль в термодинамике неравновесных процессов играет величина, численно равная скорости увеличения энтропии в единице объема
- 36. При небольших отклонениях от равновесного состояния между термодинамическими потоками и термодинамическими силами может быть установлена линейная
- 37. А.С. Чуев, 2020 Коэффициенты называются кинетическими Эти коэффициенты характеризуют интенсивность явлений переноса. В 1931 г. американский
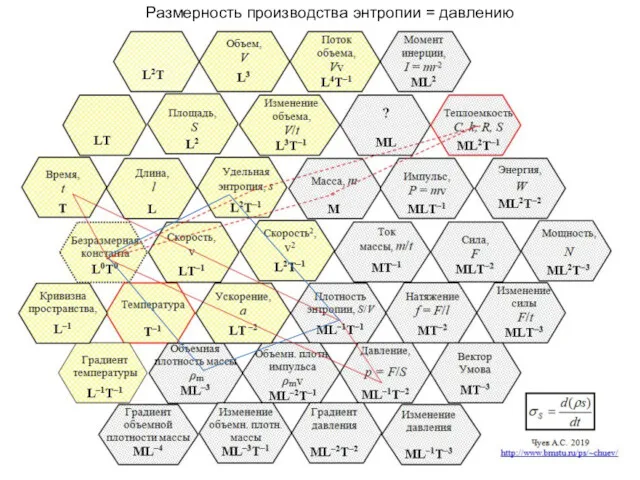
- 38. А.С. Чуев, 2020 Размерность производства энтропии = давлению
- 40. Скачать презентацию































 Презентация по теме Давление твердых тел
Презентация по теме Давление твердых тел Задачи по квантовой механике
Задачи по квантовой механике Холодильні машини
Холодильні машини Применение интерференции в технике
Применение интерференции в технике Презентация Радиация
Презентация Радиация Сила тяжести. Явление тяготения - презентация к уроку для 8 класса коррекционной школы для детей с ОВЗ
Сила тяжести. Явление тяготения - презентация к уроку для 8 класса коррекционной школы для детей с ОВЗ Действие произвольной возмущающей нагрузки
Действие произвольной возмущающей нагрузки Разработка алгоритмов диагностики электросистем легкового автомобиля
Разработка алгоритмов диагностики электросистем легкового автомобиля Рентгеновское излучение
Рентгеновское излучение Метод Годунова для численного моделирования газодинамических течений
Метод Годунова для численного моделирования газодинамических течений Статические свойства атомных ядер. Ядерные модели
Статические свойства атомных ядер. Ядерные модели Презентация по физике на тему В мире звуков
Презентация по физике на тему В мире звуков Философские проблемы науки и техники. Наука, ее сущность и особенности возникновения. (Лекции 1-2)
Философские проблемы науки и техники. Наука, ее сущность и особенности возникновения. (Лекции 1-2) Математические модели процессов тепломассообмена
Математические модели процессов тепломассообмена Принцип действия тепловых двигателей КПД. Урок № 35. 10 класс
Принцип действия тепловых двигателей КПД. Урок № 35. 10 класс Внеклассное мероприятие Физика вокруг нас.
Внеклассное мероприятие Физика вокруг нас. Движение заряженных частиц в магнитном поле
Движение заряженных частиц в магнитном поле Кипение. Влажность воздуха. Способы определения влажности воздуха
Кипение. Влажность воздуха. Способы определения влажности воздуха Жұдырықшалы механизмдерді жіктеу
Жұдырықшалы механизмдерді жіктеу Превращение энергии. (Окружающий мир, 3 класс)
Превращение энергии. (Окружающий мир, 3 класс) Устройство тормозной системы автомобиля
Устройство тормозной системы автомобиля Подготовка к ЕГЭ и ГИА по физике (вариант 1, задания 13-32)
Подготовка к ЕГЭ и ГИА по физике (вариант 1, задания 13-32) Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10)
Рентгеновские аппараты. Цифровые рентгенодиагностические комплексы. (Лекция 10) Элементы ядерной физики
Элементы ядерной физики Давление. Урок повторения и обобщения. 7 класс
Давление. Урок повторения и обобщения. 7 класс физика в сказках
физика в сказках Исследовательское проектирование прибрежных волноэнергетических систем
Исследовательское проектирование прибрежных волноэнергетических систем Неделя физики: Физика в мультфильмах
Неделя физики: Физика в мультфильмах