Слайд 2

Цели и задачи
Цель: развитие знаний обучающихся о необратимых реакциях на примере
реакций ионного обмена (РИО) и условий их протекания
Для достижения поставленной цели требуется решить следующие задачи:
ознакомиться с РИО
изучить экспериментально условия протекания РИО
закрепить полученные знания
Слайд 3

Основные понятия
Реакция называется необратимой, если один из продуктов реакции является
нерастворимым, газообразным или малодиссоциирующим веществом
Реакция называется обратимой, если не происходит связывания ионов в нерастворимые, газообразные или малодиссоциирующие вещества
Слайд 4

Основные понятия
Реакциями ионного обмена называются реакции, протекающие между ионами в растворах
электролитов
Сущность РИО заключается в связывании ионов электролитов в нерастворимые, газообразные и малодиссоциирующие вещества
Реакции ионного обмена являются необратимыми
Слайд 5
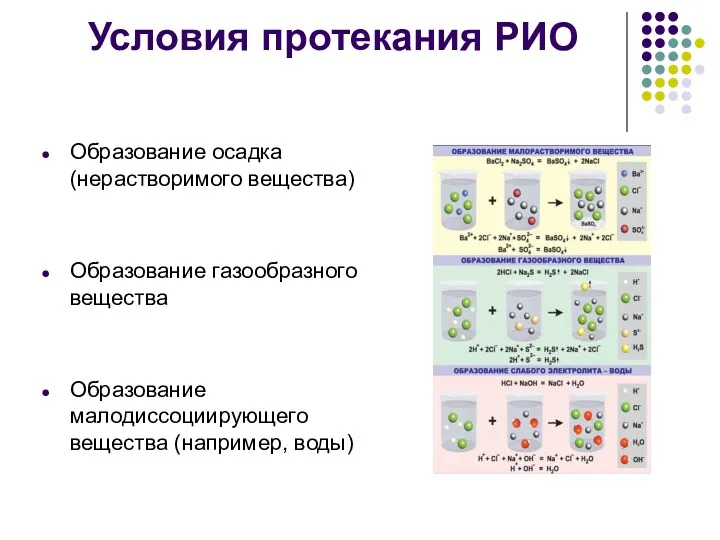
Условия протекания РИО
Образование осадка (нерастворимого вещества)
Образование газообразного вещества
Образование малодиссоциирующего вещества (например,
воды)
Слайд 6
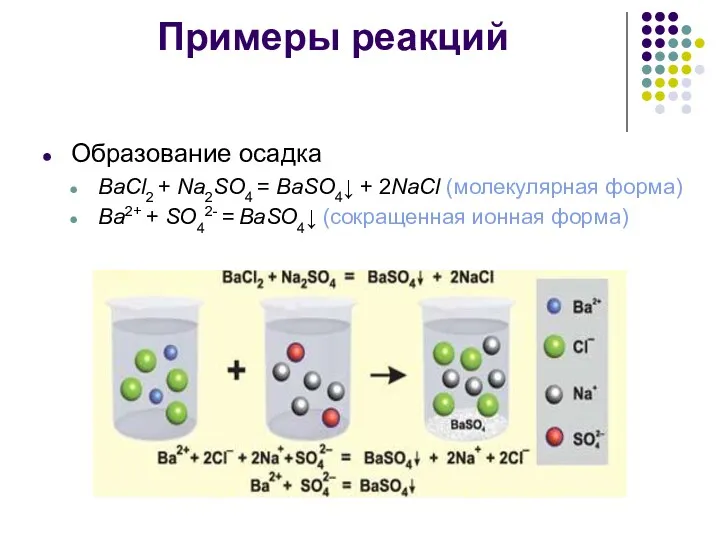
Примеры реакций
Образование осадка
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl (молекулярная форма)
Ba2+
+ SO42- = BaSO4↓ (сокращенная ионная форма)
Слайд 7
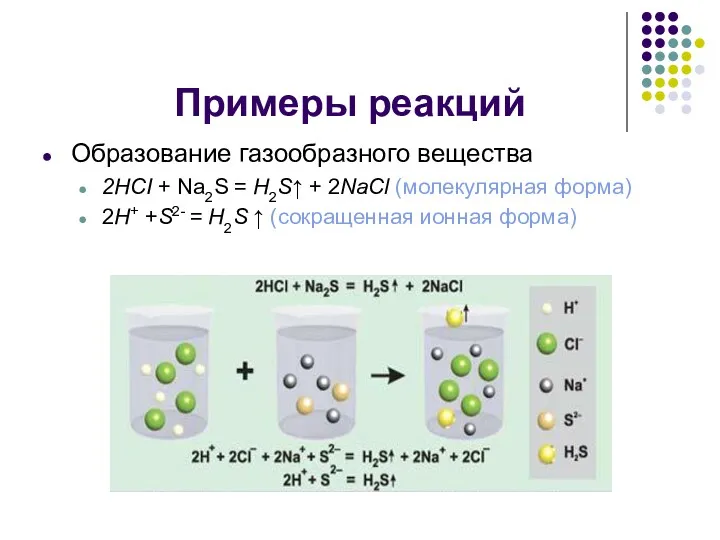
Примеры реакций
Образование газообразного вещества
2HCI + Na2S = H2S↑ + 2NaCl (молекулярная
форма)
2H+ +S2- = H2S ↑ (сокращенная ионная форма)
Слайд 8
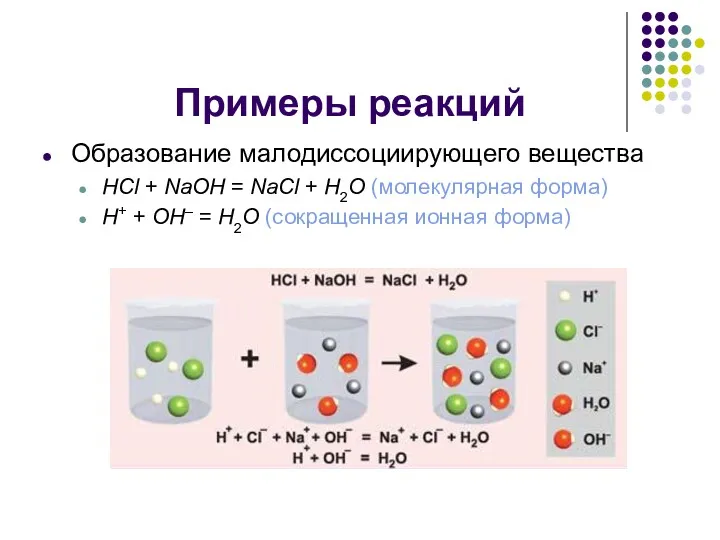
Примеры реакций
Образование малодиссоциирующего вещества
HCl + NaOH = NaCl + H2O (молекулярная
форма)
H+ + OH– = H2O (сокращенная ионная форма)
Слайд 9

Примеры заданий для самостоятельной работы
Какие из перечисленных реакций относятся к
РИО? Ответ обоснуйте
AgNO3 + NaCl = AgCl + NaNO3
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Na2CO3 + 2HCl = 2NaCl + CO2 +H2O
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3
K2S + H2SO4 = K2SO4 + H2S
2KCl + Na2SO4 = 2NaCl + K2SO4
Слайд 10

Примеры заданий для самостоятельной работы
По схемам сокращенных ионных уравнений составить
молекулярные и полные ионные уравнения
2H+ + 2OH- → 2H2O
3Ca2+ + 2PO43- → Ca3(PO4)2
Pb2+ + S2- → PbS
SO32- + 2H+ → SO2 + H2O
CO32- + 2H+ → CO2 + H2O
Cu2+ +2OH- → Cu(OH)2
Слайд 11

Примерный перечень контрольных вопросов
Какие реакции называются необратимыми и обратимыми?
Какие реакции
называются реакциями ионного обмена?
Являются ли реакции ионного обмена обратимыми?
В чем заключается сущность реакций ионного обмена?
Слайд 12

Примерный перечень контрольных вопросов
Приведите примеры реакций ионного обмена в молекулярной
и сокращенной ионной формах
с образованием осадка
с образованием газообразного вещества
с образованием малодиссоциирующего вещества
Слайд 13

Рефлексия
С какими новыми понятиями вы познакомились на уроке?
Какие трудности усвоения материала
по данной теме у вас возникли?
Понимание каких реакций ионного обмена вызвало у вас затруднение?
Что на данном занятии было вам интересно?












 Пища, с точки зрения химика
Пища, с точки зрения химика 20230419_kolichestvo_veshchestva_mol
20230419_kolichestvo_veshchestva_mol Типы кристаллических решеток, cингонии. (Лекция 2)
Типы кристаллических решеток, cингонии. (Лекция 2) Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Химические свойства серной кислоты
Химические свойства серной кислоты Типы химических реакций
Типы химических реакций Минералы группы кварца
Минералы группы кварца Состав и классификация магматических горных пород
Состав и классификация магматических горных пород Марганец и его соединения
Марганец и его соединения Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Значення періодичного закону
Значення періодичного закону Гідроліз солей
Гідроліз солей Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Неметаллы
Неметаллы Производство водорода
Производство водорода Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий
Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий Кислород. Открытие кислорода
Кислород. Открытие кислорода Обмен липидов
Обмен липидов Solutions and solubilities
Solutions and solubilities Химические реакции. Классификация. Повторение
Химические реакции. Классификация. Повторение Химические уравнения
Химические уравнения 20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_
20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_ Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Цеоліти як адсорбенти та основа сучасних каталізаторів. Структура, здатність до модифікування
Цеоліти як адсорбенти та основа сучасних каталізаторів. Структура, здатність до модифікування Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Реакции ионного обмена
Реакции ионного обмена