Содержание
- 2. Осуществить цепочку превращений P2O5 → H3PO4 → Na3PO4 → Ca3(PO4)2 → H3PO4
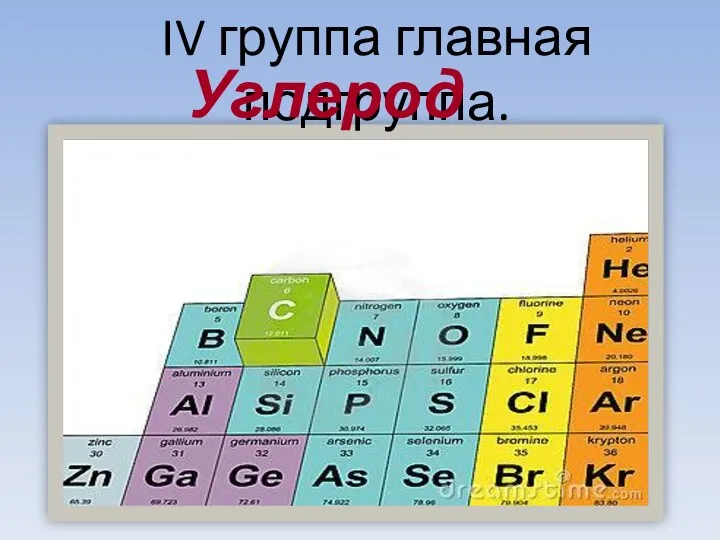
- 3. IV группа главная подгруппа. Углерод
- 6. Углерод- простое вещество Образует аллотропные модификации Причина аллотропии: различное строение кристаллической решетки: алмаз – объемная тетраэдрическая
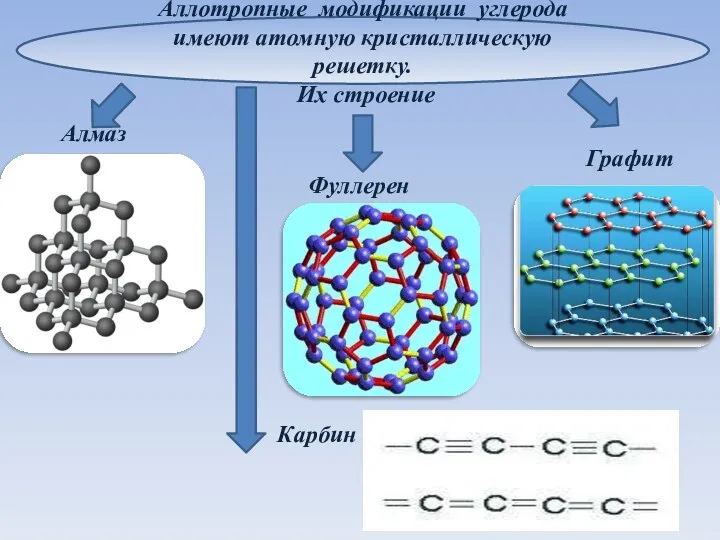
- 8. Аллотропные модификации углерода имеют атомную кристаллическую решетку. Их строение Алмаз Графит Фуллерен Карбин
- 9. Алмаз Применяется в: Обрабатывающей промышленности Электротехнике Горной промышленности Ювелирном производстве …это самое твердое вещество на Земле,
- 10. Графит …это мягкое серо-черное вещество, тугоплавкое , являющееся полупроводником со слоистой структурой. Применяется в: Графитовых стержнях-электродах
- 11. Фуллерен Фуллерены планируют использовать: 1. Для создания фотоприемников 2. Для создания сверхпроводящих материалов 3. В качестве
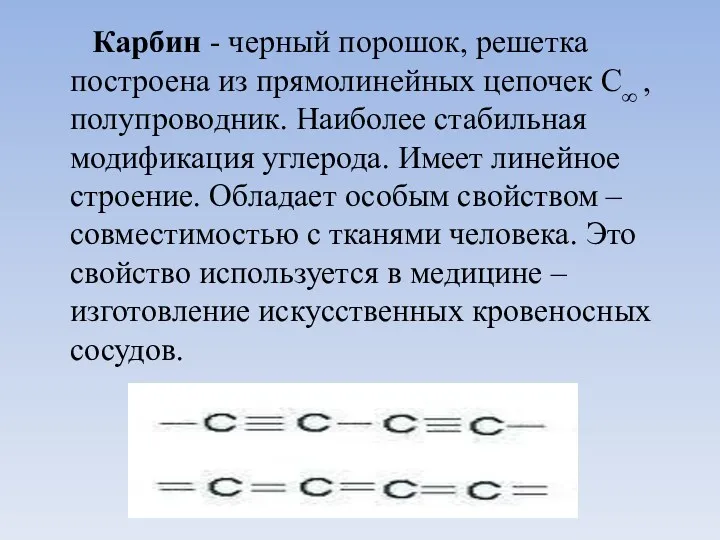
- 12. Карбин - черный порошок, решетка построена из прямолинейных цепочек С∞ ,полупроводник. Наиболее стабильная модификация углерода. Имеет
- 13. Нахождение в природе Мел, известняк, мрамор CaCO3 Магнезит MgCO3 Сидерит FeCO3 В самородном виде: алмаз и
- 15. В составе растений и животных (~18 %). В организме человека достигает около 21 % (15 кг
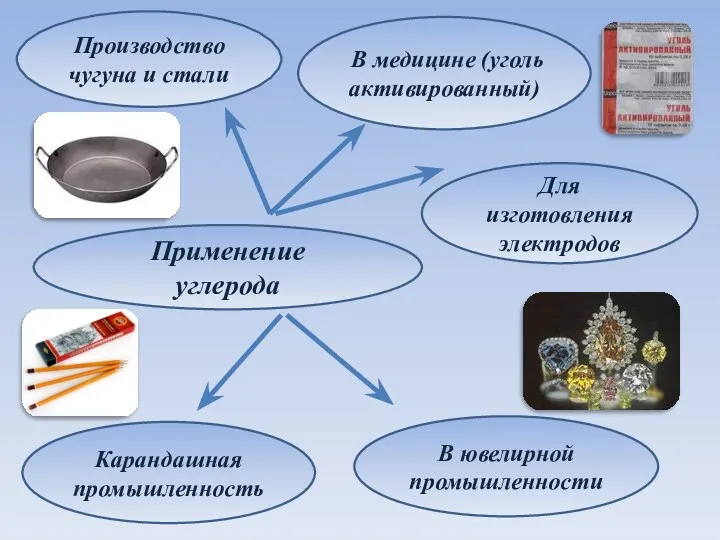
- 18. Применение углерода Производство чугуна и стали В медицине (уголь активированный) Карандашная промышленность Для изготовления электродов В
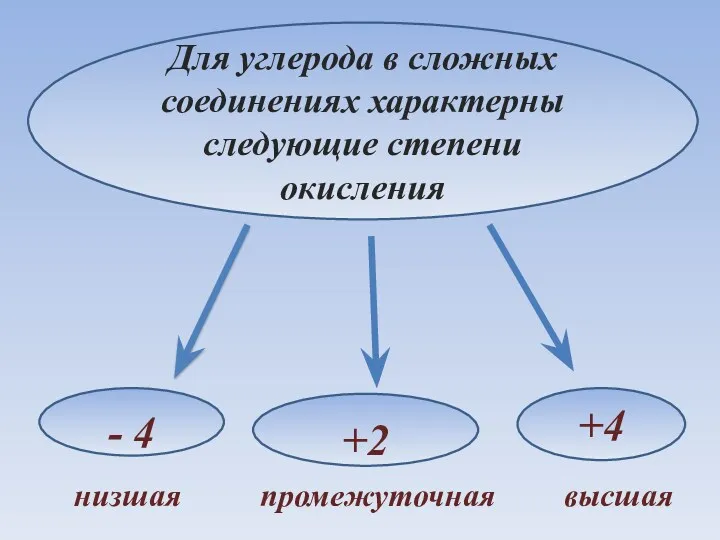
- 19. Для углерода в сложных соединениях характерны следующие степени окисления - 4 +4 +2 низшая промежуточная высшая
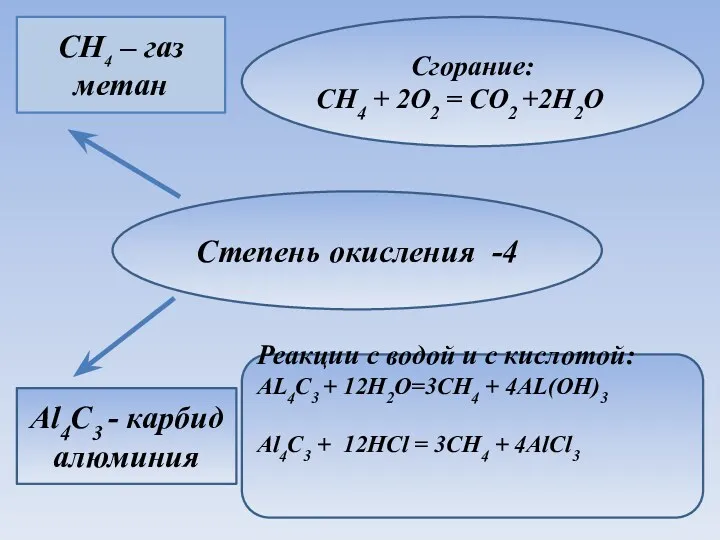
- 20. Степень окисления -4 CH4 – газ метан Al4C3 - карбид алюминия Сгорание: CH4 + 2O2 =
- 21. Степень окисления +2 CO - угарный газ сильный яд, опасный для жизни и здоровья человека (несолеобразующий
- 22. Степень окисления +4 H2CO3-угольная кислота Соли угольной кислоты (например K2CO3-карбонат калия) CO2-углекислый газ
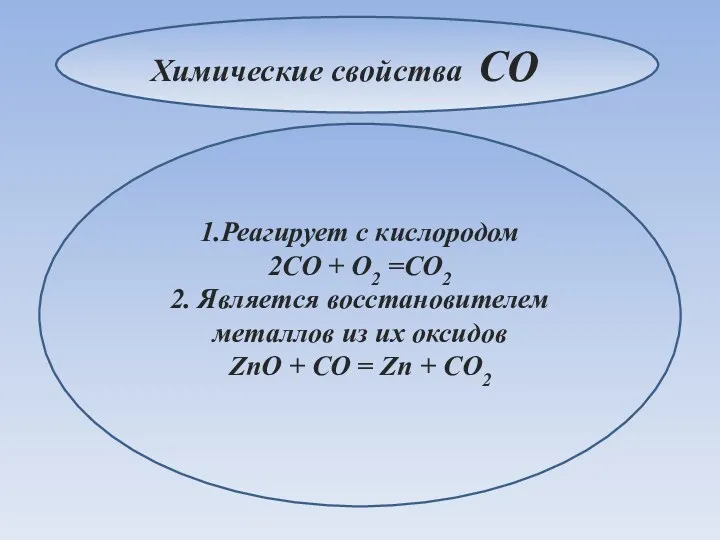
- 23. 1.Реагирует с кислородом 2CO + O2 =CO2 2. Является восстановителем металлов из их оксидов ZnO +
- 24. Химические свойства CO2- (кислотный оксид) 1.Реагирует с водой CO2 + H2O = H2CO3 2.Реагирует с основными
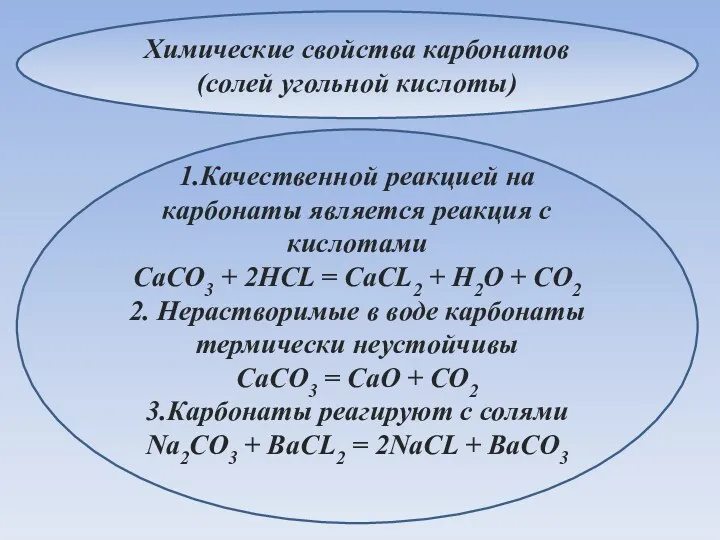
- 25. Химические свойства карбонатов (солей угольной кислоты) 1.Качественной реакцией на карбонаты является реакция с кислотами CaCO3 +
- 26. Углекислотный огнетушитель Сухой лед (хладагент) Сода Моющие средства Лимонады Соединения углерода вокруг нас
- 27. http://urbanjewelers.biz/wp-content/uploads/2010/10/diamonds-e1288016603994.jpg http://www.jabinesban.com/wp-content/uploads/2010/09/fullereno_fullereno.jpg http://s58.radikal.ru/i160/1012/ff/2e7639eb01bc.jpg http://www.rmnt.ru/pub/uploads/glass_cutter_0511_3.jpg http://www.students.by/articles/19/1001931/PH04503.jpg http://art-market.com.ua/media/catalog/product/cache/17/image/9df78eab33525d08d6e5fb8d27136e95/1/1/111111111111111_2.jpg http://im5-tub-ru.yandex.net/i?id=42457246-63-72&n=21 Ссылки на источники информации и изображения: И.И.Новошинский Н.С.Новошинская Химия
- 29. Скачать презентацию


















 Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Теория строения органических соединений
Теория строения органических соединений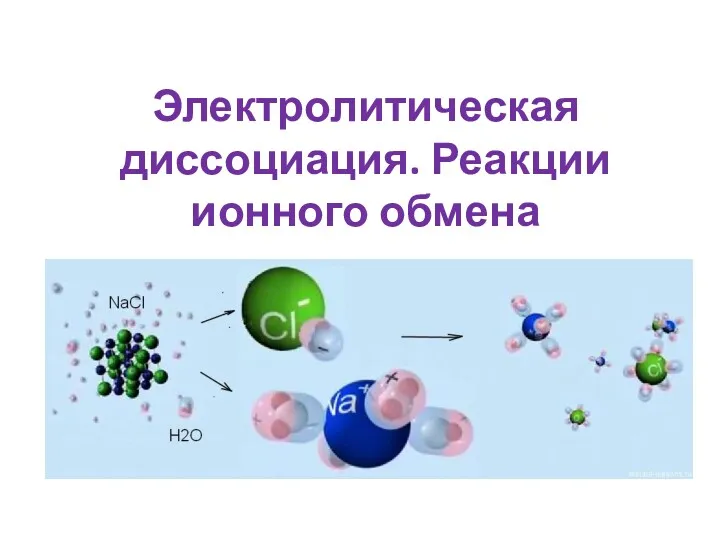 Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена 20230205_okislitelno-_vosstanovitelnye_reaktsii
20230205_okislitelno-_vosstanovitelnye_reaktsii Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Current Condition(Revision C)
Current Condition(Revision C) Состояние электронов в атоме
Состояние электронов в атоме Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Фосфор и его соединения
Фосфор и его соединения Прочность полимеров
Прочность полимеров Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Щелочные металлы
Щелочные металлы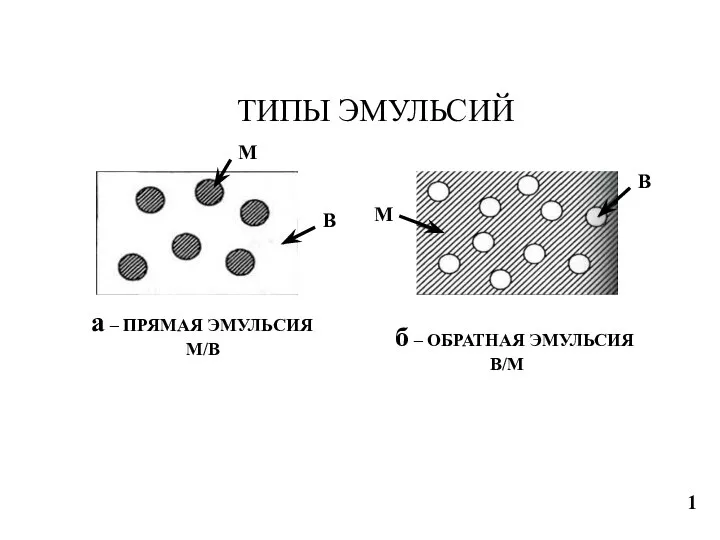 Типы эмульсий. Фракционный состав нефти. Типы нефти
Типы эмульсий. Фракционный состав нефти. Типы нефти Счастливый случай. Право первого хода
Счастливый случай. Право первого хода Газообразные вещества
Газообразные вещества Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Алкины. Гомологический ряд
Алкины. Гомологический ряд Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Самое удивительное на свете вещество - вода
Самое удивительное на свете вещество - вода АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Физические свойства металлов
Физические свойства металлов