Содержание
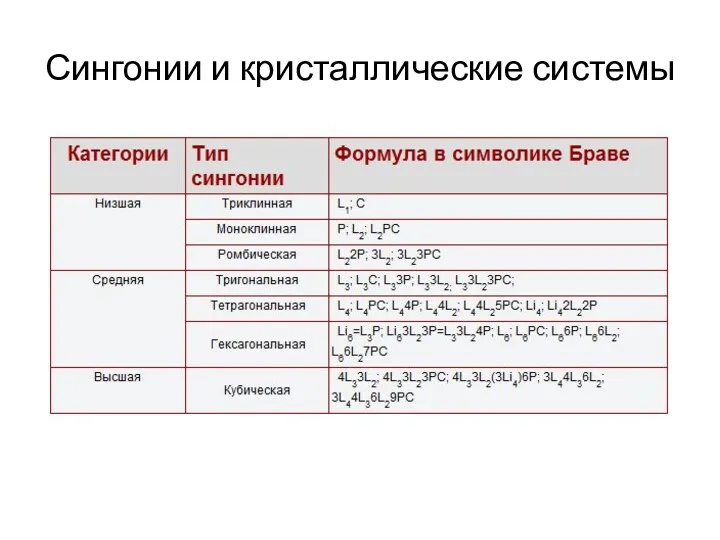
- 2. Сингонии и кристаллические системы
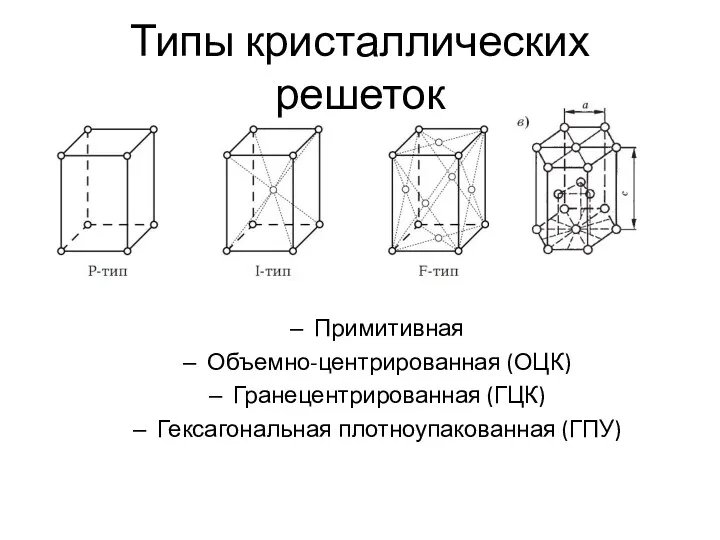
- 3. Типы кристаллических решеток Примитивная Объемно-центрированная (ОЦК) Гранецентрированная (ГЦК) Гексагональная плотноупакованная (ГПУ)
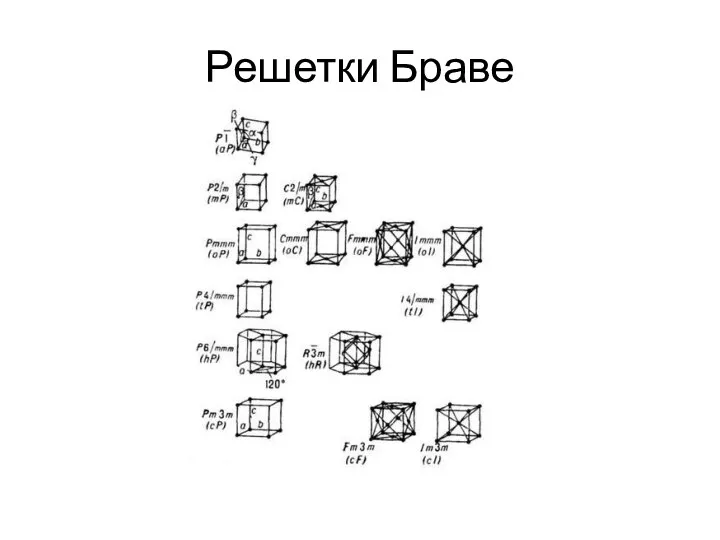
- 4. Решетки Браве
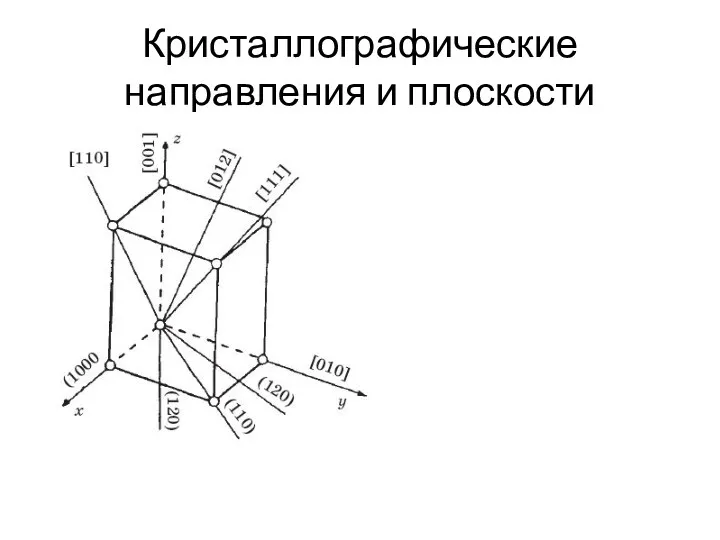
- 5. Кристаллографические направления и плоскости
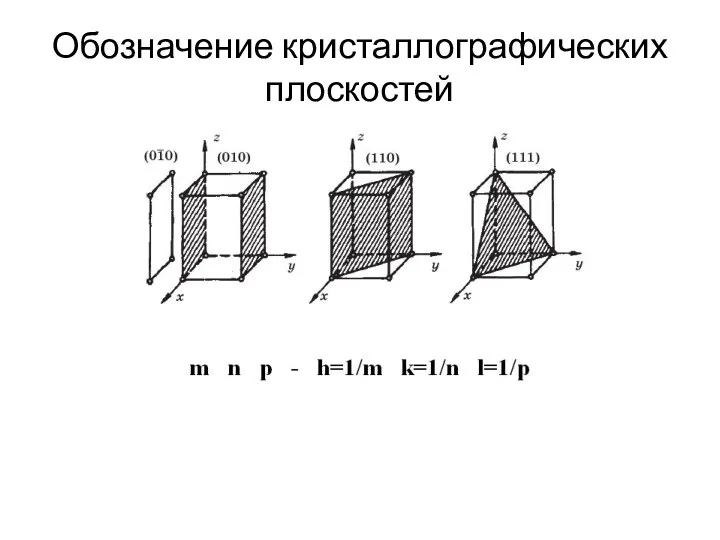
- 6. Обозначение кристаллографических плоскостей
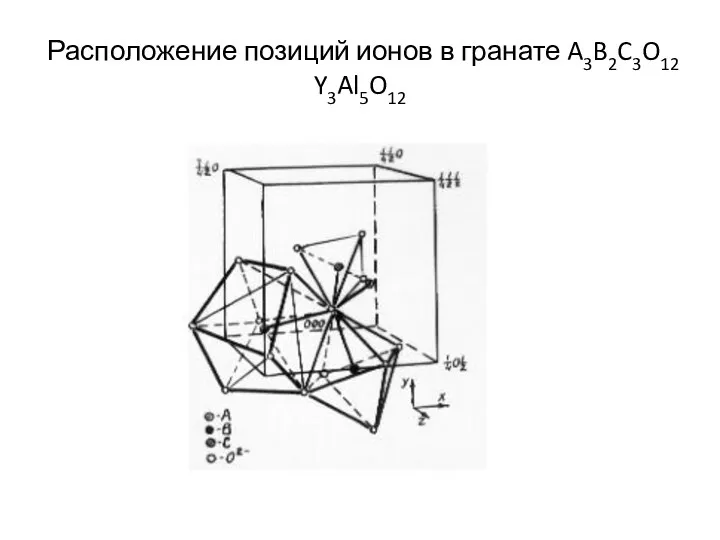
- 7. Расположение позиций ионов в гранате A3B2C3O12 Y3Al5O12
- 8. А – элементы; В – соединения типа АВ (например, NaCl, CsI); С – соединения типа AB2
- 9. Основные структурные типы Структура Меди Au, Ag, Ni, Al, Pb. Твердые растворы Ag-Au, Cu-Au, Соединения типа
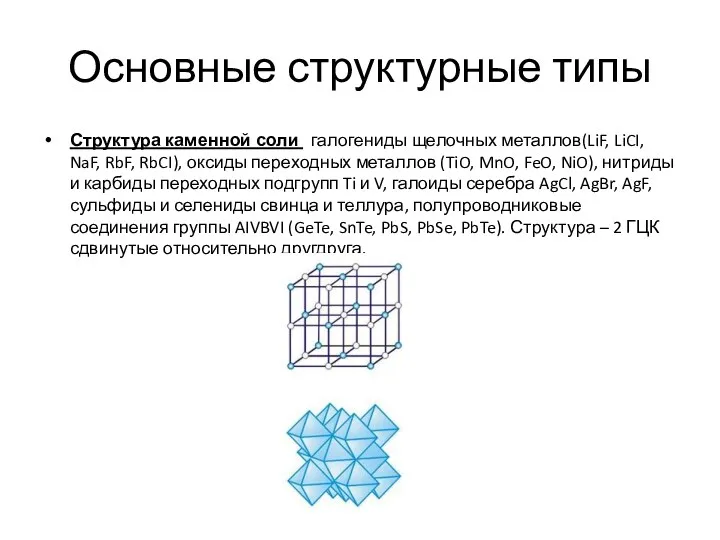
- 10. Основные структурные типы Структура каменной соли галогениды щелочных металлов(LiF, LiCI, NaF, RbF, RbCI), оксиды переходных металлов
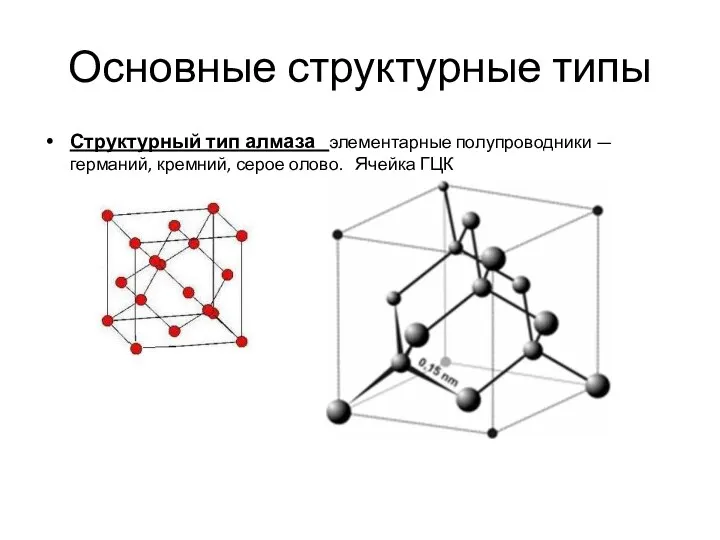
- 11. Основные структурные типы Структурный тип алмаза элементарные полупроводники — германий, кремний, серое олово. Ячейка ГЦК
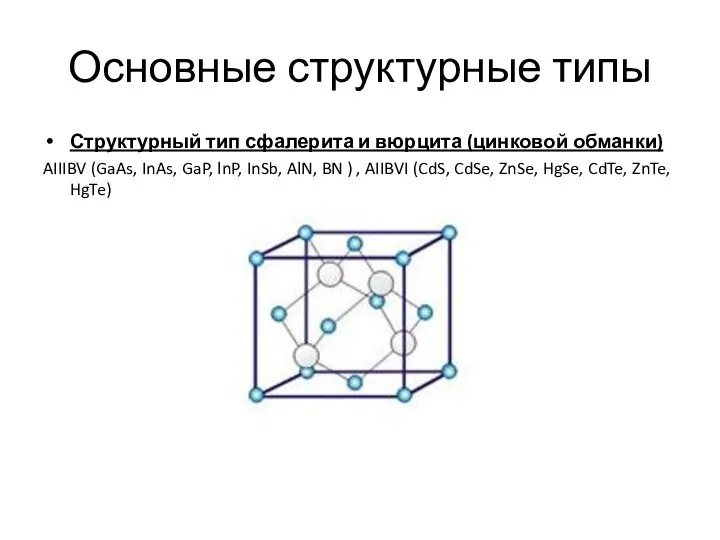
- 12. Основные структурные типы Структурный тип сфалерита и вюрцита (цинковой обманки) AIIIBV (GaAs, InAs, GaP, lnP, InSb,
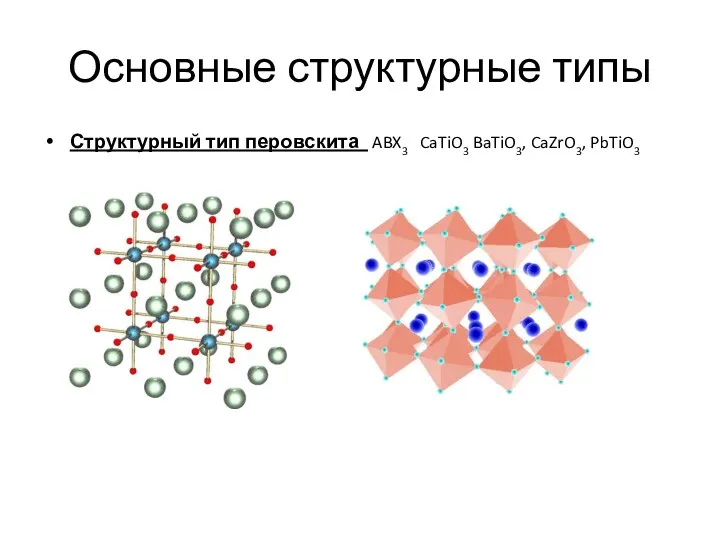
- 13. Основные структурные типы Структурный тип перовскита ABX3 CaTiO3 BaTiO3, CaZrO3, PbTiO3
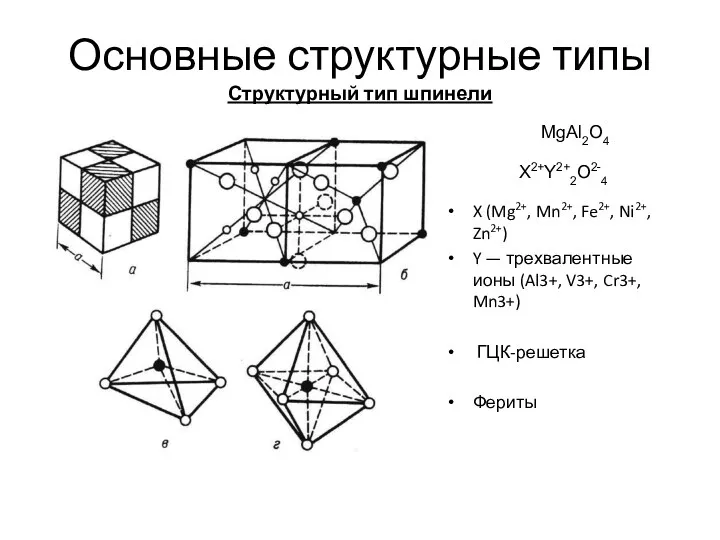
- 14. Основные структурные типы Структурный тип шпинели X (Mg2+, Mn2+, Fe2+, Ni2+, Zn2+) Y — трехвалентные ионы
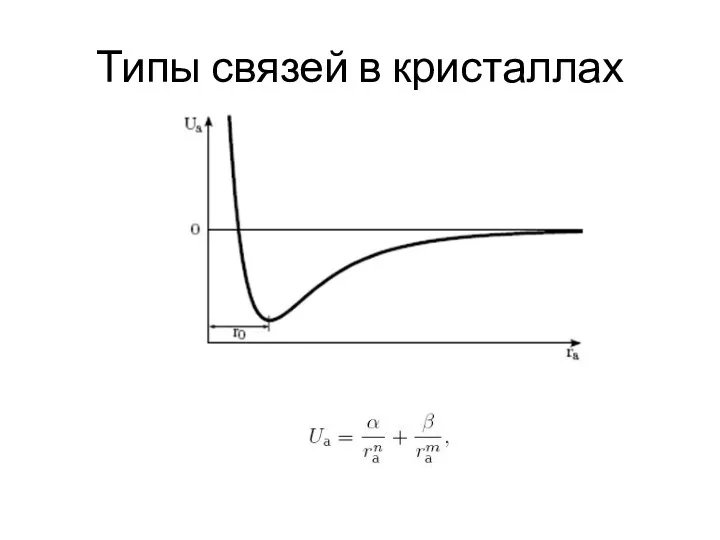
- 15. Типы связей в кристаллах
- 16. Типы связей в кристаллах. Ионная Ковалентная Ван-дер-вальсова металлическая
- 17. Дефекты в кристаллах Дефект – это нарушение идеальной структуры кристалла. Классификация дефектов (по Ван-Бюрену). · Нульмерные
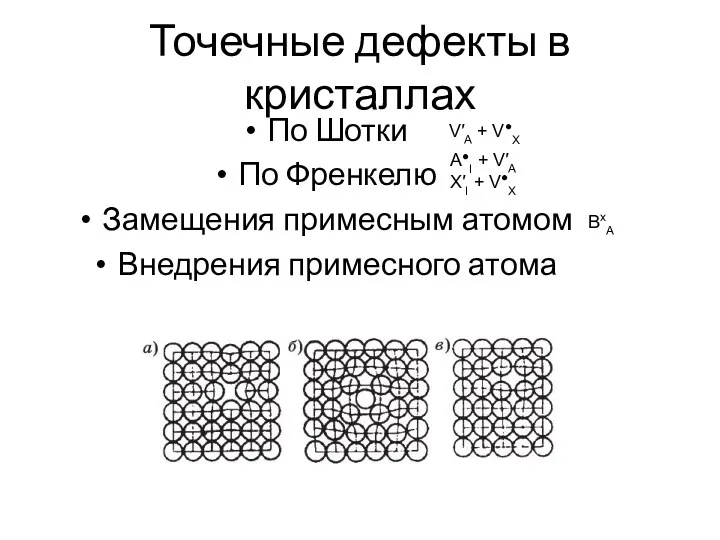
- 18. Точечные дефекты в кристаллах По Шотки По Френкелю Замещения примесным атомом Внедрения примесного атома V′А +
- 19. Обозначения дефектов по Крегеру-Винку V′А V′′А V·Х
- 21. Дефекты
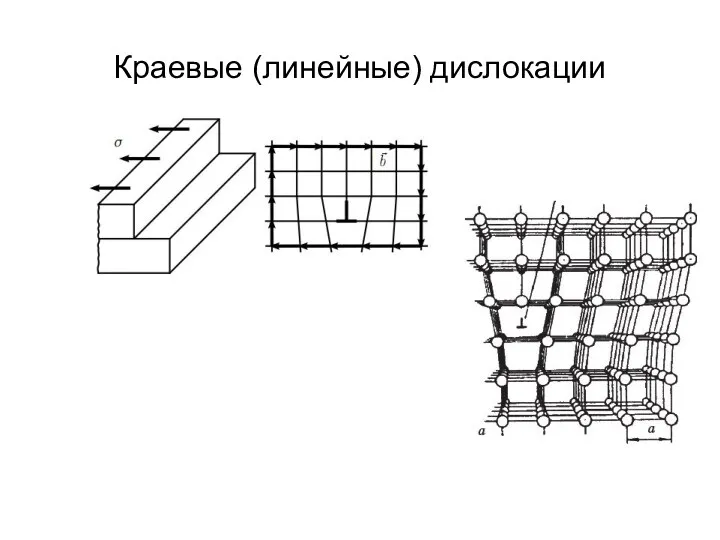
- 22. Краевые (линейные) дислокации
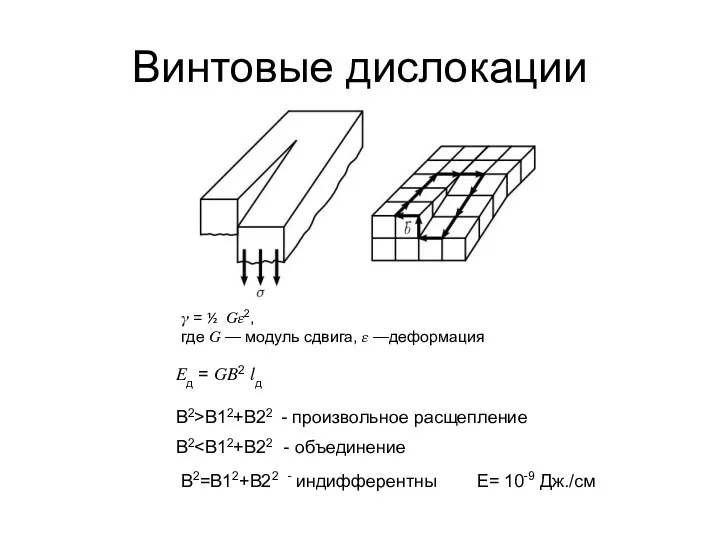
- 23. Винтовые дислокации ? = ½ ??2, где ? — модуль сдвига, ? —деформация ?д = ??2
- 24. Поверхностные дефекты Блоки Двойники Дефекты упаковки Границы зерен
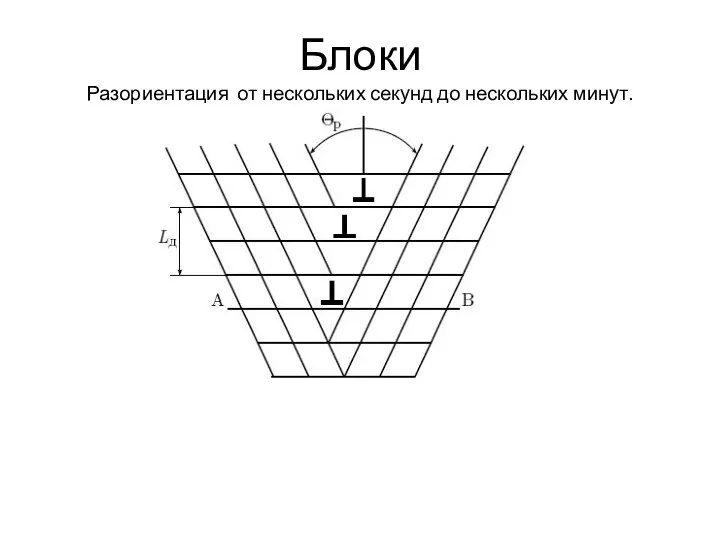
- 25. Блоки Разориентация от нескольких секунд до нескольких минут.
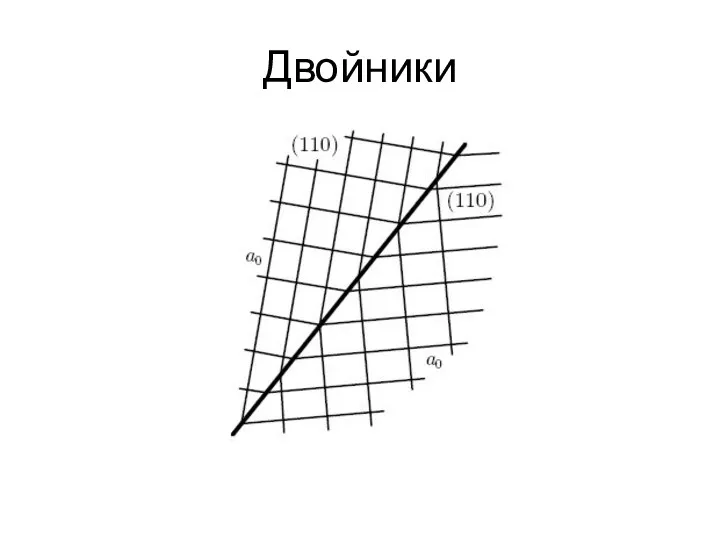
- 26. Двойники
- 28. Скачать презентацию








 Органическая химия в ряду других наук
Органическая химия в ряду других наук Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Простые вещества неметаллы
Простые вещества неметаллы Металлы в живой приподе
Металлы в живой приподе Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Химический элемент гелий
Химический элемент гелий 20231110_elektroliz
20231110_elektroliz Реакционная способность соединений со связью углерод-гетероатом
Реакционная способность соединений со связью углерод-гетероатом Сероводород. Сульфиды
Сероводород. Сульфиды Кристаллические решётки и их виды
Кристаллические решётки и их виды Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Водород - топливо будущего
Водород - топливо будущего ПОЛИСАХАРИДЫ
ПОЛИСАХАРИДЫ Періодична система хімічних елементів
Періодична система хімічних елементів ЕГЭ по химии. Решение задач 27, 28, 29
ЕГЭ по химии. Решение задач 27, 28, 29 Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Липиды
Липиды Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Подгруппа селена
Подгруппа селена Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?
Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?