Содержание
- 2. Содержание: Общие понятия электролиза Порядок разрядки анионов и катионов Примеры электролиза расплавов Примеры электролиза растворов солей
- 3. Проблемный вопрос. Что произойдёт, если в раствор или расплав электролита опустить электроды, которые присоединены к источнику
- 4. Электролиз – дословно: «лизис» – разложение «электро» – электрический ток Цель урока: сформировать представления у обучающихся
- 5. Электролиз – это окислительно- -восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав
- 6. В расплавах электролизу подвергаются: щелочи термически устойчивые соли оксиды металлов В растворах электролизу подвергаются: кислоты щелочи
- 7. Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может
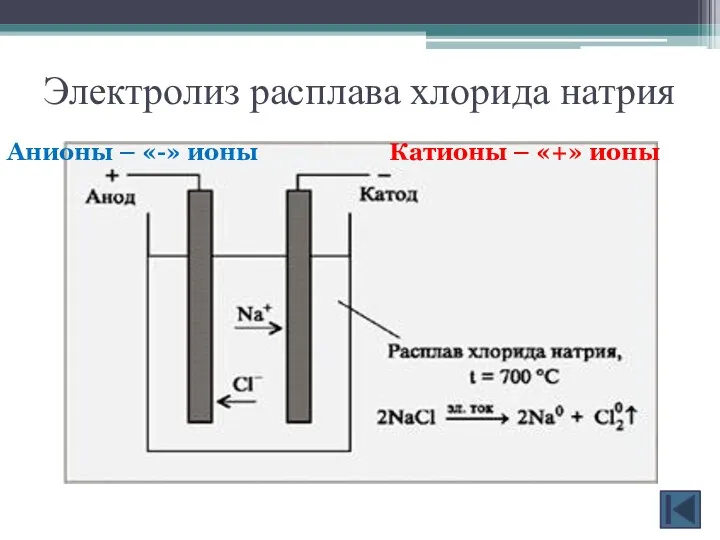
- 8. Электролиз расплава хлорида натрия Катионы – «+» ионы Анионы – «-» ионы
- 9. Электролиз – это ОВР на катоде всегда идёт процесс восстановления, на аноде всегда идёт процесс окисления.
- 10. Для определения результатов электролиза существуют следующие правила: Процесс на катоде не зависит от материала катода, а
- 11. Процесс на аноде зависит от материала анода и от природы аниона. Если анод нерастворимый, т.е. инертный
- 12. На аноде – окисление Порядок окисления анионов: 1) В I очередь окисляются бескислородные анионы (I -,
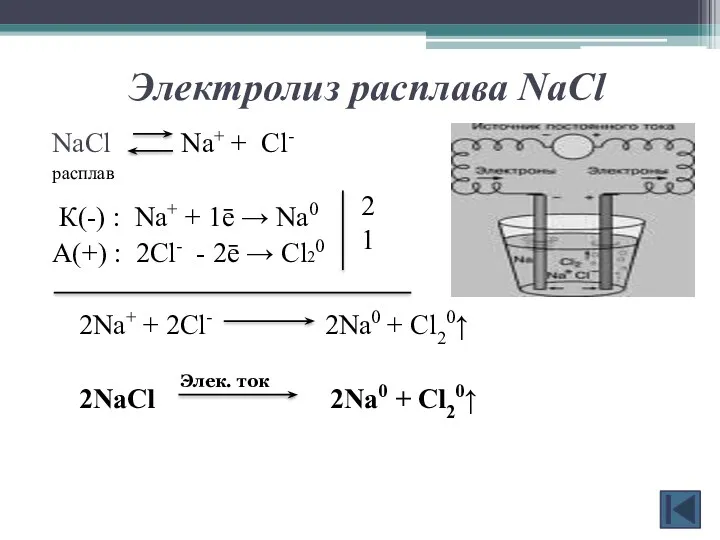
- 13. Электролиз расплава NaCl NaCl Na+ + Cl- расплав К(-) : Na+ + 1ē → Na0 А(+)
- 14. Электролиз расплава NaОН NaОН Na+ + ОН- расплав К(-) : Na+ + 1ē → Na0 4
- 15. Электролиз расплава Al2O3 в криолите Al2О3 2Al3+ + 3О2- расплав К(-) : Al3+ + 3ē →
- 16. Электролиз раствора соли бескислородной кислоты NaCl NaCl Na+ + Cl- Н2О К(-) : 2Н2О + 2е
- 17. Электролиз раствора соли кислородосодержащей кислоты CuSO4 CuSO4 Cu2+ + SO42- Н2О К(-) : Cu2+ + 2e
- 18. Самостоятельная работа Проанализируйте процесс электролиза водного раствора сульфата натрия. Используя инструкции, запишите катодный и анодный процессы,
- 19. Электролиз раствора соли Na2SO4 Na2SO4 2Na+ + SO42- Н2О К(-) : 2Н2О + 2е → Н20↑
- 20. Электролиз раствора соли органической кислоты СН3СООNa СН3СООNa СН3CОО- + Na+ Н2О К(-) : 2Н2О + 2е
- 21. Электролиз раствора соли NiCl2 , при котором на катоде происходит 2 процесса восстановления NiCl2 Ni 2+
- 22. Применение электролиза Катодные процессы Анодные процессы В гальваностегии ( никелирование, серебрение). В гальванопластике (изготовление копий). Получение
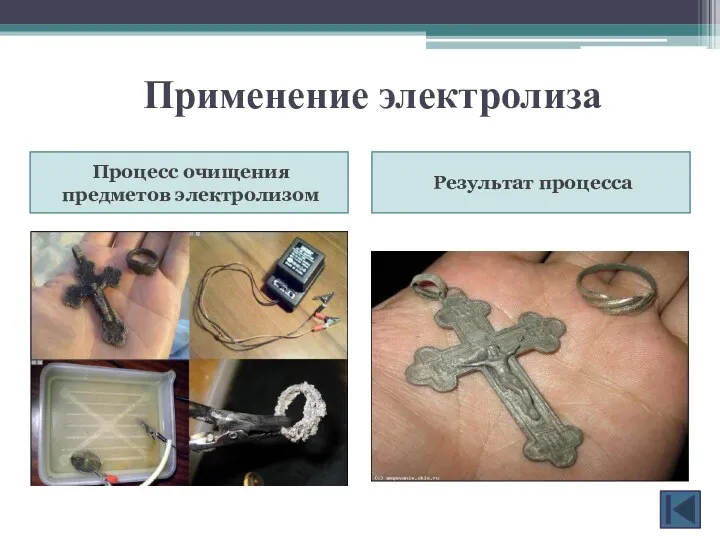
- 23. Применение электролиза Процесс очищения предметов электролизом Результат процесса
- 24. Копирование рельефных изделий из металлов и других материалов. Гальванопластика позволяет создавать документально точные копии барельефов, монет,
- 25. Гальванопластика политехнического государственного музея «Георгий Победоносец» Барельеф «Портрет Б.С.Якоби»
- 26. Защита металлов от коррозии (При этом на поверхности металлических изделий электрохимическим методом наносят тонкий слой другого
- 27. Проверим свои знания! (Правильный ответ - жми на чёрный прямоугольник, находящийся под вариантом ответа.)
- 28. окислительно-восстановительные реакции если через раствор или расплав Электролиз – это протекающие на электродах пропускают электролита постоянный
- 29. Ответьте на вопросы: 1. При электролизе к аноду движутся: а) катионы б) анионы в) все ионы
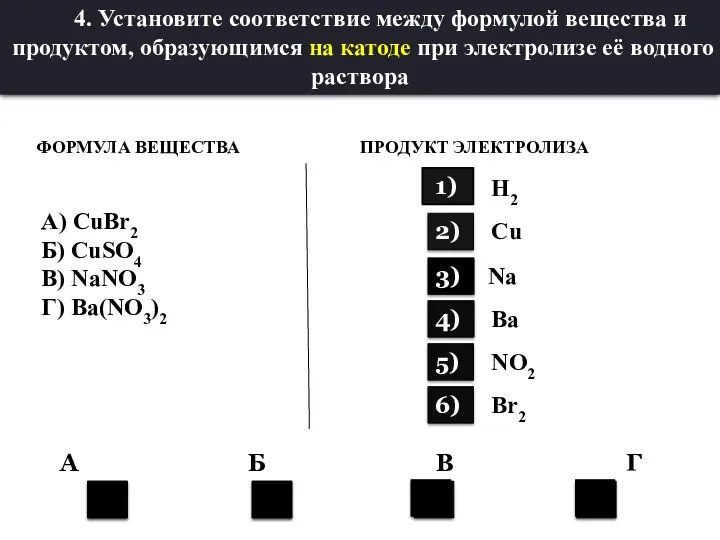
- 30. 1 1 2 2 6) ФОРМУЛА ВЕЩЕСТВА ПРОДУКТ ЭЛЕКТРОЛИЗА А) CuBr2 Б) CuSO4 В) NaNO3 Г)
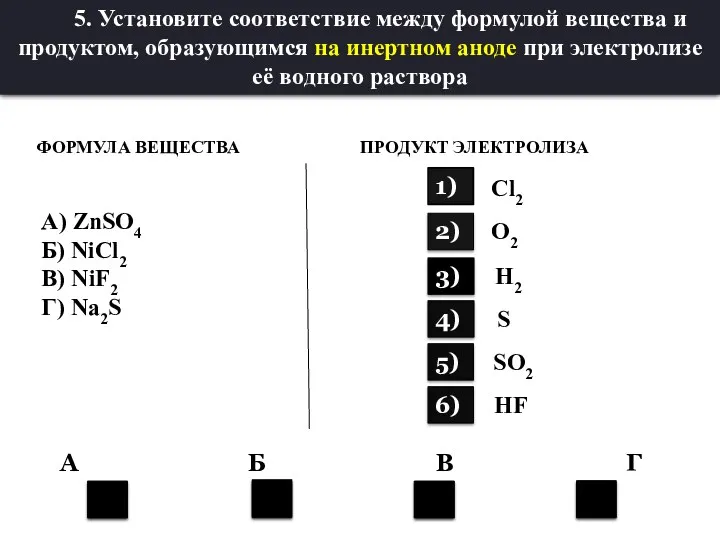
- 31. 2 4 1 2 6) ФОРМУЛА ВЕЩЕСТВА ПРОДУКТ ЭЛЕКТРОЛИЗА А) ZnSO4 Б) NiCl2 В) NiF2 Г)
- 32. 2 6 4 4 6) НАЗВАНИЕ СОЛИ ПРОДУКТ ЭЛЕКТРОЛИЗА А) хлорид меди(II) (раствор) Б) хлорид меди(II)
- 33. 3 4 1 1 А Б В Г 6) ФОРМУЛА СОЛИ УРАВНЕНИЕ АНОДНОГО ПРОЦЕССА А) KCl
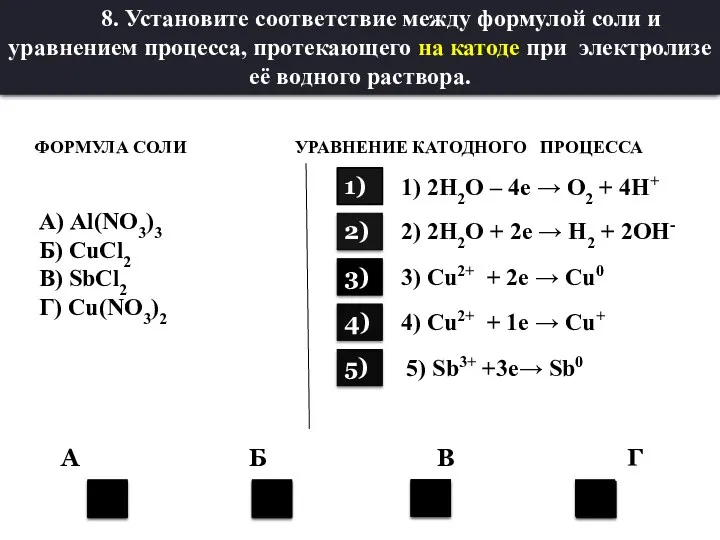
- 34. 2 3 2 3 А Б В Г ФОРМУЛА СОЛИ УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА А) Al(NO3)3 Б)
- 35. 9. Задача: Сравните, какие продукты будут находиться в растворе в результате электролиза водного раствора нитрата меди(II)
- 36. Второй случай: В условии не оговорено, отключен ли электрический ток после полного электролиза соли. Если в
- 38. Скачать презентацию





























 Составление формул химических соединений
Составление формул химических соединений Предмет и история геохимии
Предмет и история геохимии Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Химия атмосферы
Химия атмосферы Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Основы электрохимии. Электрохимические процессы
Основы электрохимии. Электрохимические процессы Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс)
Формула вещества. Относительная молекулярная масса. Простые и сложные вещества (8 класс) Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Коррозия металлов
Коррозия металлов Химический элемент хлор
Химический элемент хлор Химия в быту
Химия в быту Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах СОЕДИНЕНИЯ ХРОМА
СОЕДИНЕНИЯ ХРОМА Химический состав клетки. Неорганические вещества клетки. 10 класс
Химический состав клетки. Неорганические вещества клетки. 10 класс Подготовка пробы к анализу. Использование химических и физико-химических методов для идентификации вещества. (Лекция 11)
Подготовка пробы к анализу. Использование химических и физико-химических методов для идентификации вещества. (Лекция 11) Неметаллические материалы
Неметаллические материалы Тема: хімія та їжа
Тема: хімія та їжа Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Химия. Изучение жиров
Химия. Изучение жиров Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Ароматические амины
Ароматические амины Времена алхимиков
Времена алхимиков Практическая работа №1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени
Практическая работа №1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Коррозия металлов
Коррозия металлов Строение атома
Строение атома