Содержание
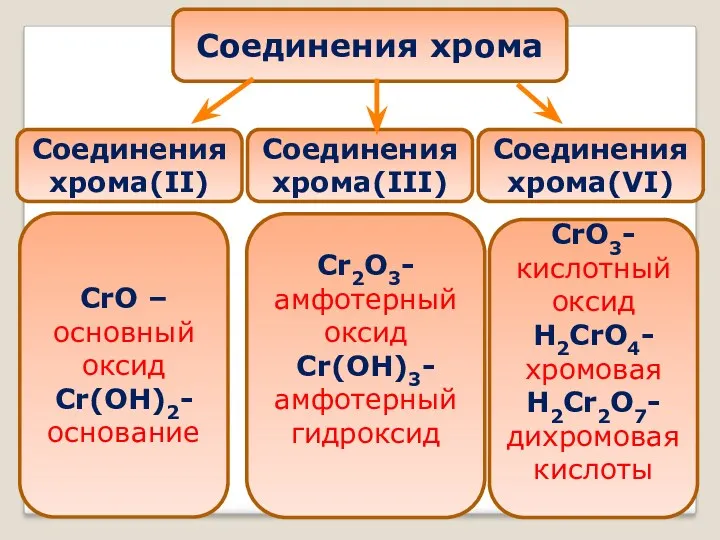
- 2. Соединения хрома Соединения хрома(II) Соединения хрома(III) Соединения хрома(VI) CrO –основный оксид Cr(OH)2- основание CrO3-кислотный оксид H2CrO4-хромовая
- 3. CrO Оксид хрома (II) – кристаллы черного цвета, имеет основный характер При осторожном нагревании гидроксида хрома
- 4. Оксида хрома (II) реагирует с соляной и серной кислотами. Рассмотрите реакции с точки зрения ТЭД. CrO
- 5. Оксид хрома (II) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома (III) Cr+2O + O20
- 6. Cr(OH)2 Гидроксид хрома (II) Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на
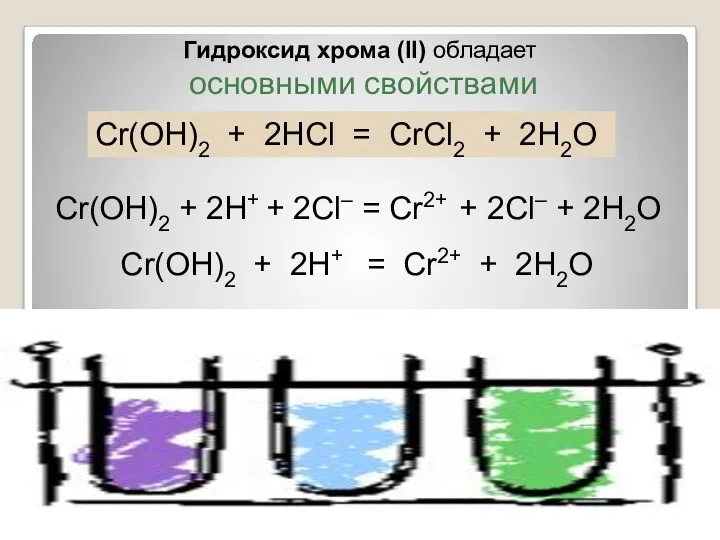
- 7. Гидроксид хрома (II) обладает основными свойствами Cr(OН)2 + 2HCl = CrCl2 + 2H2O Cr(OН)2 + 2H+
- 8. Гидроксид хрома (II) – сильный восстановитель Кислородом воздуха окисляется до гидроксида хрома (III) Cr+2(ОН)2+ O20 +
- 9. Соли хрома (II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в
- 10. Cr2O3 Оксид хрома (III) – тугоплавкий порошок темно-зеленого цвета. Получение^ В лабораторных условиях термическим разложением дихромата
- 11. Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение
- 12. При сплавлении оксида хрома (III) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хромиты:
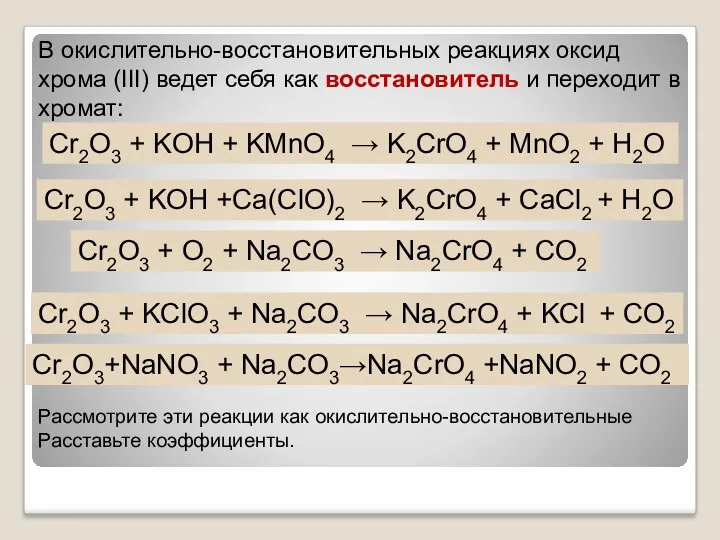
- 13. В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель и переходит в хромат: Cr2O3 +
- 14. Оксид хрома (III) – катализатор В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида
- 15. Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III)
- 16. Гидроксид хрома (III) Cr(OH)3 Получают гидроксид хрома (III) действием растворов щелочей или аммиака на растворы солей
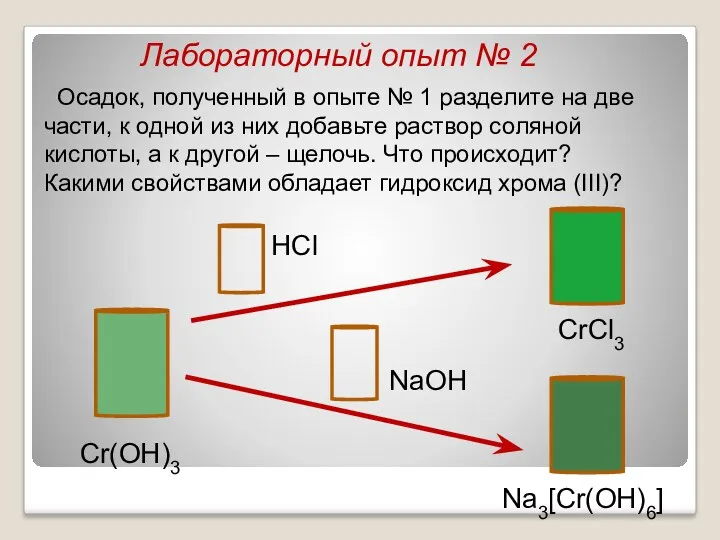
- 17. Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной
- 18. +H2SO4 +NaOH Осадок, полученный в опыте № 1 разделите на две части, к одной из них
- 19. Гидроксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение
- 20. Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3– Cr(OH)3 +
- 21. Соли хрома (III) Бывают двух видов: CrCl3 - хроматы (III) и хромиты NaCrO2 или гидроксокомплексы Na3[Cr(OH)6]
- 22. Соли хрома (III) 3. Взаимный гидролиз: при смешивании солей хрома (III) с растворами сульфидов, сульфитов, карбонатов
- 23. Сульфат хрома (III) образует двойные соли – хромовые квасцы Из смешанного раствора сульфата хрома (III) и
- 24. Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. Рассмотрите эти реакции как окислительно-восстановительные
- 25. Получают CrO3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na2Cr2O7 + 2H2SO4
- 26. CrO3 — кислотный оксид С избытком воды образуется хромовая кислота H2CrO4 CrO3 + Н2O = Н2CrO4
- 27. CrO3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются
- 28. Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько
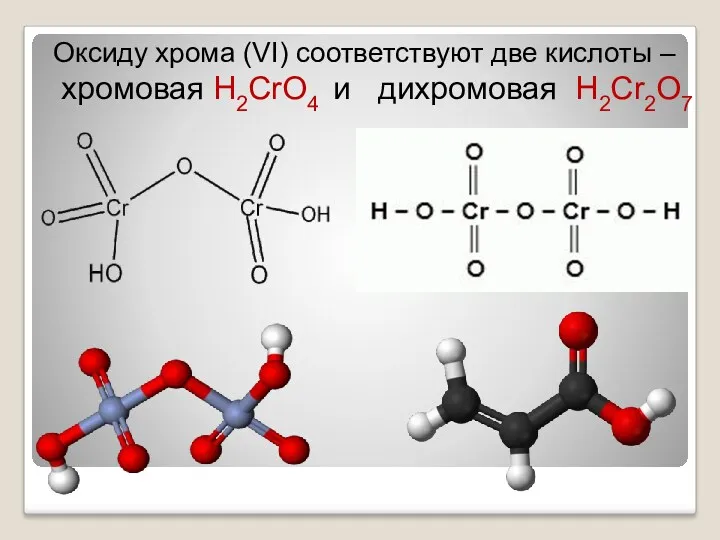
- 29. Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7
- 30. Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов
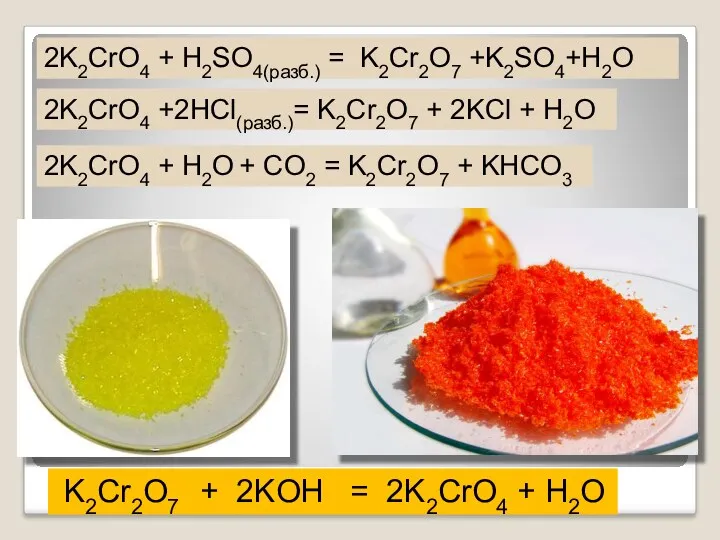
- 31. хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевые дихроматы, соли
- 32. Лабораторный опыт № 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это
- 33. 2K2CrO4 + H2SO4(разб.) = K2Cr2O7 +K2SO4+H2O K2Cr2O7 + 2KOH = 2K2CrO4 + H2O 2K2CrO4 +2HCl(разб.)= K2Cr2O7
- 34. Взаимопревращение хроматов и дихроматов Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7,
- 35. Соединения хрома (VI) – сильные окислители Cr2O72– Cr3+ Cr(OH)3 [Cr(OH)6]3– H+ H2O OH– Cr2O72– + 14H+
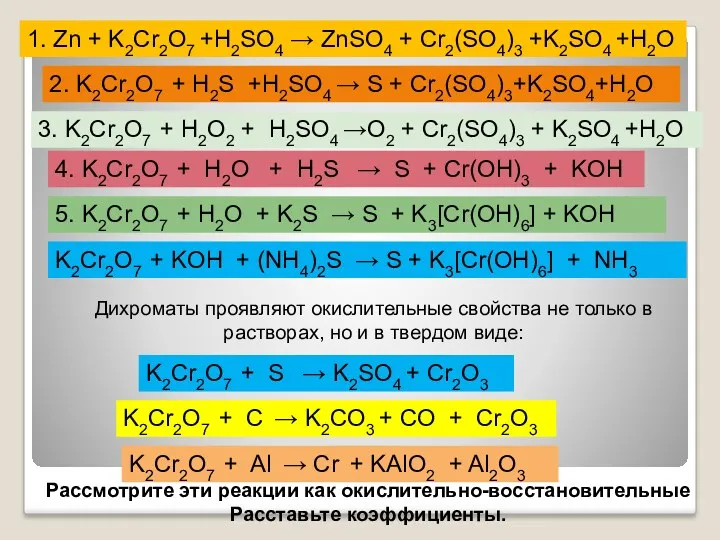
- 36. Окислительные свойства дихроматов Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в
- 37. 1. Zn + K2Cr2O7 +H2SO4 → ZnSO4 + Cr2(SO4)3 +K2SO4 +H2O 2. K2Cr2O7 + H2S +H2SO4
- 38. Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3С2H5OH + K2Cr2O7 + 4H2SO4 CH3– CHO
- 39. Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы. Дихромат аммония
- 40. В ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н2CrО4 закономерно происходит ослабление основных
- 41. Степень окисления хромa +2 +3 +6 Оксид CrO Cr2O3 CrO3 Гидроксид Cr(OH)2 Cr(OH)3 H2CrO4 H2Cr2O7 Кислотные
- 42. Домашнее задание: Выполнить ОВР! Используем презентацию «ОВР по теме «ХРОМ»
- 43. СПАСИБО ЗА РАБОТУ!
- 45. Скачать презентацию














![Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3OH–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397571/slide-19.jpg)












![Соединения хрома (VI) – сильные окислители Cr2O72– Cr3+ Cr(OH)3 [Cr(OH)6]3–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397571/slide-34.jpg)







 Водород. Растворы. 8 класс
Водород. Растворы. 8 класс Алмазы. Бриллианты
Алмазы. Бриллианты Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Состояние электронов в атоме
Состояние электронов в атоме Основания, их классификация и свойства
Основания, их классификация и свойства Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Антибиотики как ЛС
Антибиотики как ЛС Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Галогены. Физические свойства галогенов
Галогены. Физические свойства галогенов Химические уравнения. Закон сохранения массы веществ
Химические уравнения. Закон сохранения массы веществ Сера — представитель VIA-группы. Аллотропия серы. Свойства и применение
Сера — представитель VIA-группы. Аллотропия серы. Свойства и применение Теория резонанса в неорганической химии
Теория резонанса в неорганической химии Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Ионные уравнения реакций
Ионные уравнения реакций Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Диффузия вокруг нас
Диффузия вокруг нас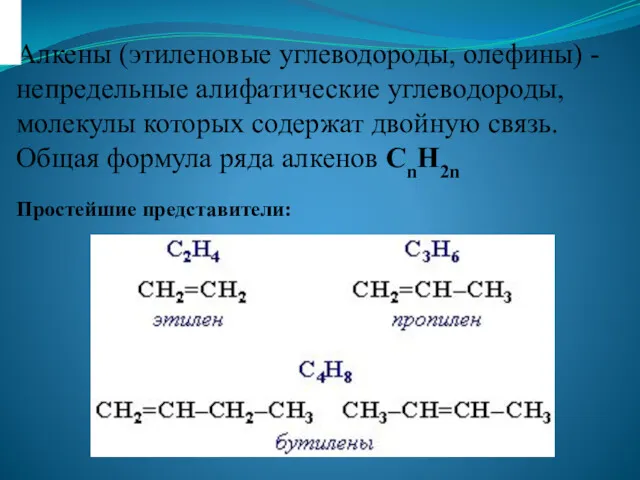 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Синтетические моющие средства
Синтетические моющие средства Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною История мыловарения
История мыловарения Геохимия окружающей среды и здоровье человека
Геохимия окружающей среды и здоровье человека Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду
Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду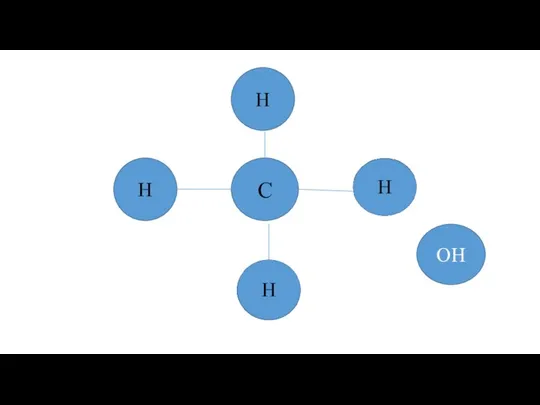 Предельные одноатомные спирты
Предельные одноатомные спирты Горение топлива
Горение топлива Кто хочет стать отличником по химии. Игра
Кто хочет стать отличником по химии. Игра Тренинг. Практическая химия (8-9 классы)
Тренинг. Практическая химия (8-9 классы) Коллоидная химия
Коллоидная химия