Содержание
- 2. Цель урока Сформировать новые знания о процессах, происходящих в растворах электролитов. Выявить условия, при которых реакции
- 3. Электролиты-…(примеры) Диссоциация-… Растворение-… Раствор-… Вещества по растворимости… Катион-… Анион-…. Химический тренажёр. (Разминка)
- 4. Вариант № 1 1) Дайте определение кислот в свете теории электролитической диссоциации. 2) Запишите уравнения электролитической
- 5. 3) Составьте 4 уравнения электролитической диссоциации веществ, образующих в качестве анионов только сульфат – ионы (SO42−)
- 6. Многие видные учёные того времени не поняли и не признавали теории Сванте Аррениуса о возможности диссоциации
- 7. К+19 )2)8)8)1 К+19 )2)8)8)0 e− = 19 e− = 18 +
- 8. Реакции между ионами называются ионными реакциями. Уравнения таких реакций – ионными уравнениями.
- 9. CuSO4 + 2КОН→ Cu(ОН)2↓ + К2 SO4 Молекулярное уравнение. Cu2++ SO42- + 2К+ +ОН-→Cu(ОН)2↓ +2К++SO42- Полное
- 10. CO2 Na2CO3 + 2НCl → 2NaCl + H2CO3 H2O Молекулярное уравнение. 2Na++CO32− +2H+ +2Cl− → 2Na++2Cl−+
- 11. KOH + фенолфталеин +HCl → KCl + H2O Молекулярное уравнение. K+ + OH− + H+ +
- 12. Na2SO4 + BaCl2 → 2NaCl + BaSO4 Молекулярное уравнение. 2Na+ + SO42− + Ba2+ + 2Cl−
- 13. Na2SO4 + 2KOH ↔ 2NaOH +K2SO4 Молекулярное уравнение. 2Na++SO42−+2K++2OH−↔2Na++2OH−+2K++SO42− Полное ионное уравнение. Данная реакция не идёт
- 14. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате
- 15. Если выделится газ – это раз, Иль получится вода – это два, А ещё нерастворимый Осаждается
- 16. Ø Сильные электролиты записывают в виде ионов. Ø Формулы слабых электролитов (в том числе и воды),
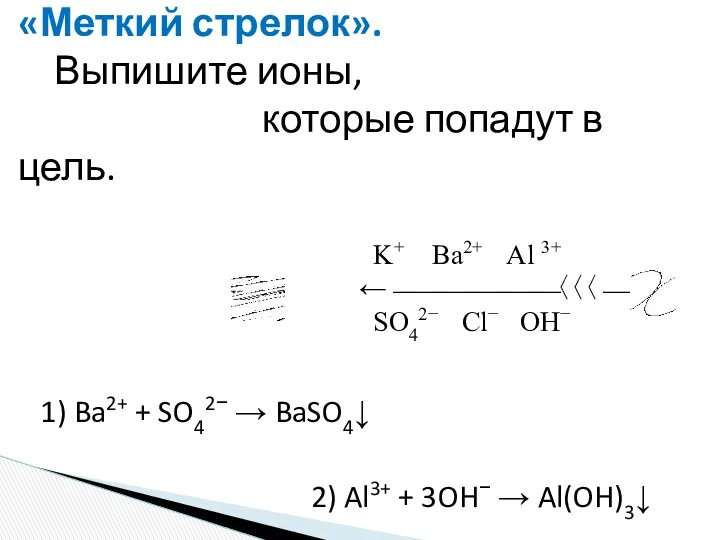
- 17. «Меткий стрелок». Выпишите ионы, которые попадут в цель. 1) Ba2+ + SO42− → BaSO4↓ 2) Al3+
- 18. 1) NaOH + H2SO4 → … 2) KNO3 + Na2SO4 → … 3) K2SO3 + 2HNO3
- 19. 1. Какие из перечисленных ниже веществ могут образоваться в ходе реакции ионного обмена? а) Na3PO4; б)
- 23. Скачать презентацию


















 Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Дикарбоновые , гидроксикислоты
Дикарбоновые , гидроксикислоты Рафинирование металлических расплавов
Рафинирование металлических расплавов Бытовая химия
Бытовая химия Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Углеводы. Моносахариды
Углеводы. Моносахариды Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Химические основы жизни
Химические основы жизни Значення хімічних процесів у природі
Значення хімічних процесів у природі Химические свойства металлов
Химические свойства металлов Полимеры и ЕГЭ
Полимеры и ЕГЭ Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6) Создание косметических средств
Создание косметических средств Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Железо и его соединения
Железо и его соединения Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Алюминий и его соединения
Алюминий и его соединения Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Амины
Амины Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Непредельные углеводороды: этилен
Непредельные углеводороды: этилен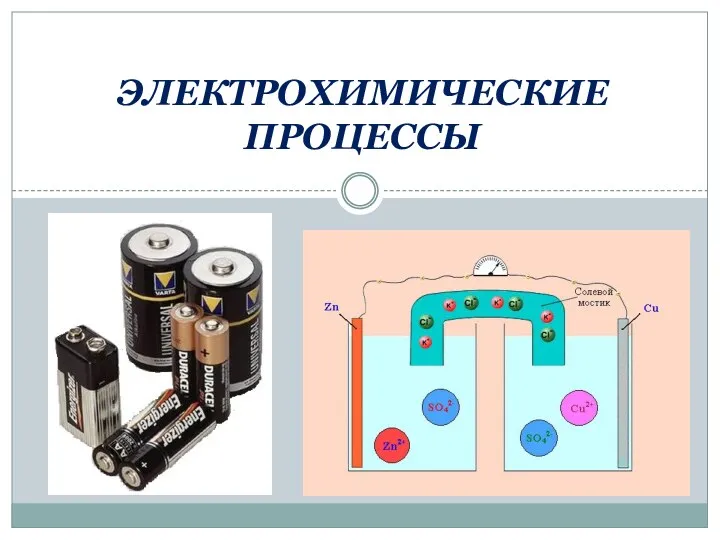 Электрохимические процессы
Электрохимические процессы Фибоначчи. Закономерности химических элементов ряда
Фибоначчи. Закономерности химических элементов ряда