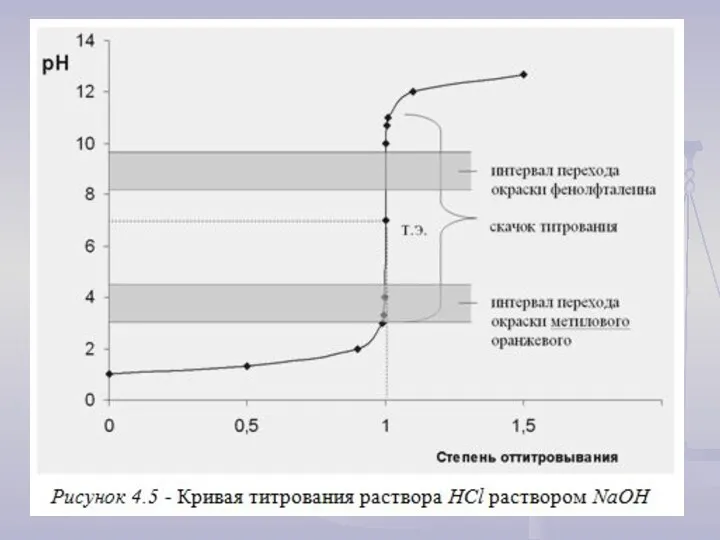
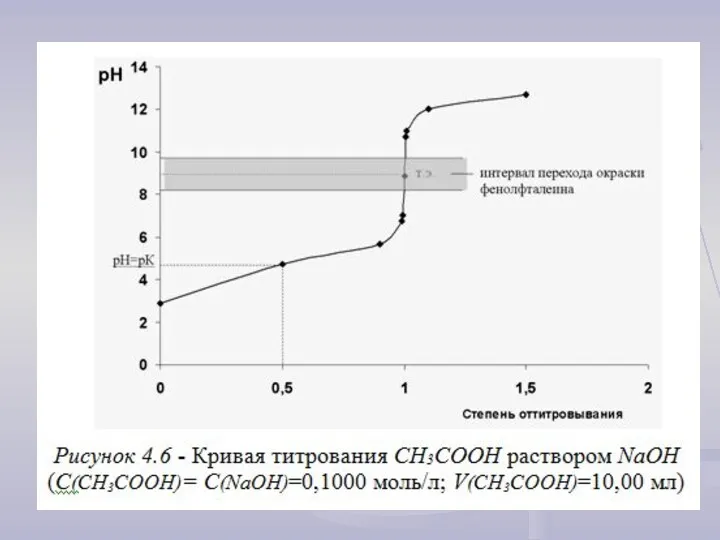
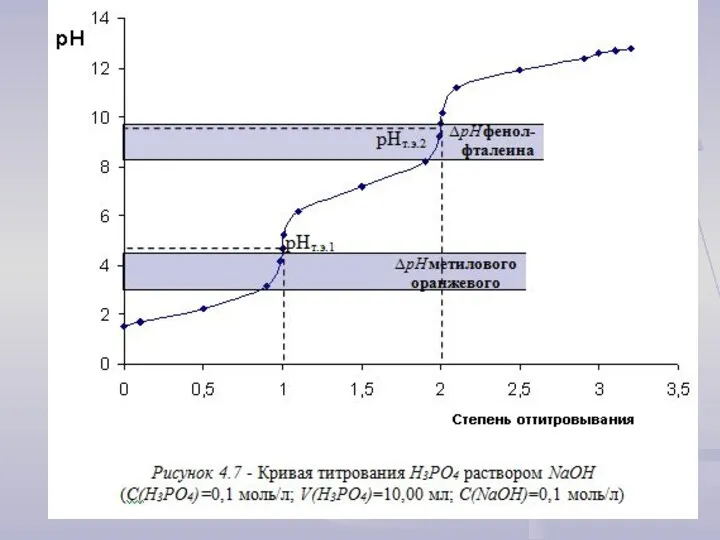
Титрование сильных кислот растворами сильных оснований
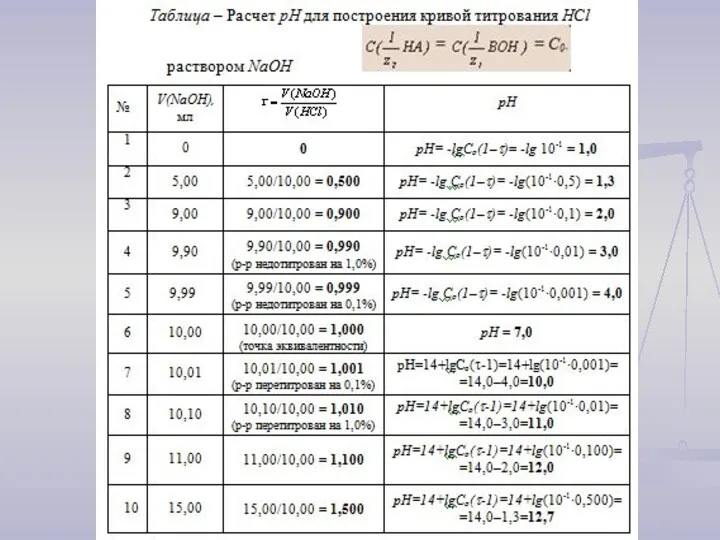
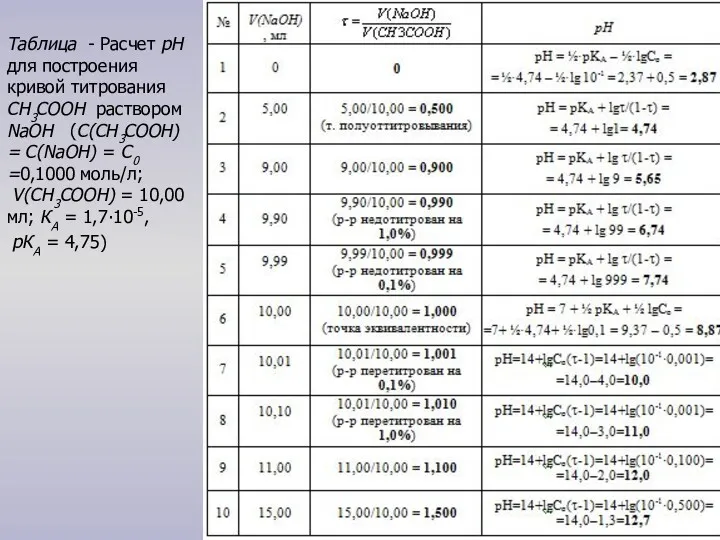
Для построения кривой титрования следует провести
расчет значений рН: 1) до точки эквивалентности (τ < 1);
2) в точке эквивалентности (τ = 1);
3) после точки эквивалентности (τ > 1).
рН = - lg Со·(1 – τ ).
2) При τ = 1 будет достигнута точка эквивалентности (совпадает с точкой нейтральности раствора)
рН = рОН = 7.
3) При τ > 1 HA полностью вступила в реакцию, поэтому рН раствора определяется добавленным избытком сильного основания.
рН = рKH2O + lgС(ВОН) = 14 + lgС(ВОН).
C(ВОН) = Со·τ – Со = Со·(τ –1),
избыток добавлено прореагировало
всего при титровании
рН = рKH2O + lg Со·(τ - 1) = 14 + lg Со·(τ - 1)
1) При τ < 1 для сильной кислоты рН = - lg C(HA).
C(HA) = Со – Со·τ или C(HA) = Со·(1 – τ)
осталось было оттитровали







 Высокомолекулярные вещества и их растворы
Высокомолекулярные вещества и их растворы Обзор электродных процессов
Обзор электродных процессов Эфирные масла
Эфирные масла Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Старение полимеров. Процессы, протекающие при старении полимеров
Старение полимеров. Процессы, протекающие при старении полимеров Введение в химическую термодинамику
Введение в химическую термодинамику Химическое кафе Кислоты
Химическое кафе Кислоты Основные типы фуллероидных наночастиц
Основные типы фуллероидных наночастиц Валентність. Хімія. 7 клас
Валентність. Хімія. 7 клас Контрольная работа по дисциплине: химия
Контрольная работа по дисциплине: химия Вклад М.В. Ломоносова в развитие науки химия
Вклад М.В. Ломоносова в развитие науки химия Задача №5. Аккумулятор на основе железа
Задача №5. Аккумулятор на основе железа Исследование Е. Е. Вагнера в области терпенов и камфоры
Исследование Е. Е. Вагнера в области терпенов и камфоры Пниктогены элеметны VA группы
Пниктогены элеметны VA группы Химический элемент сера
Химический элемент сера Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы
Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы Спирты & Фенолы
Спирты & Фенолы Чистые вещества и смеси
Чистые вещества и смеси Химические свойства альдегидов
Химические свойства альдегидов Аминокислоты. Физические свойства
Аминокислоты. Физические свойства Biomass Feedstocks
Biomass Feedstocks АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат Щелочноземельные металлы
Щелочноземельные металлы Пиролиз углеводородного сырья
Пиролиз углеводородного сырья Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Введение в количественный анализ
Введение в количественный анализ Теплова теорія припинення горіння. Вогнегасні засоби
Теплова теорія припинення горіння. Вогнегасні засоби