Содержание
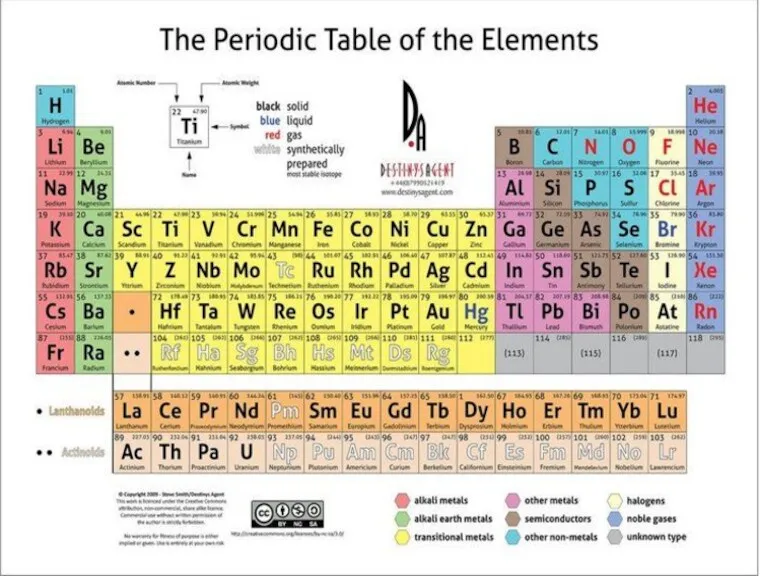
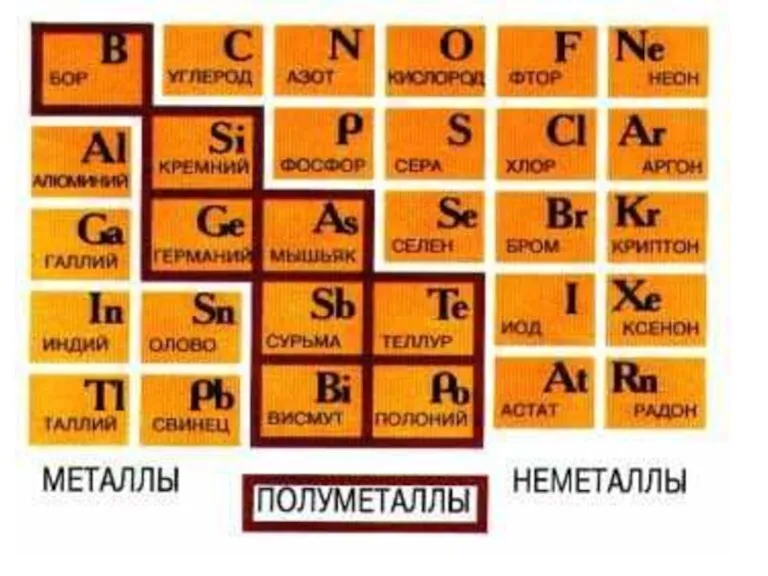
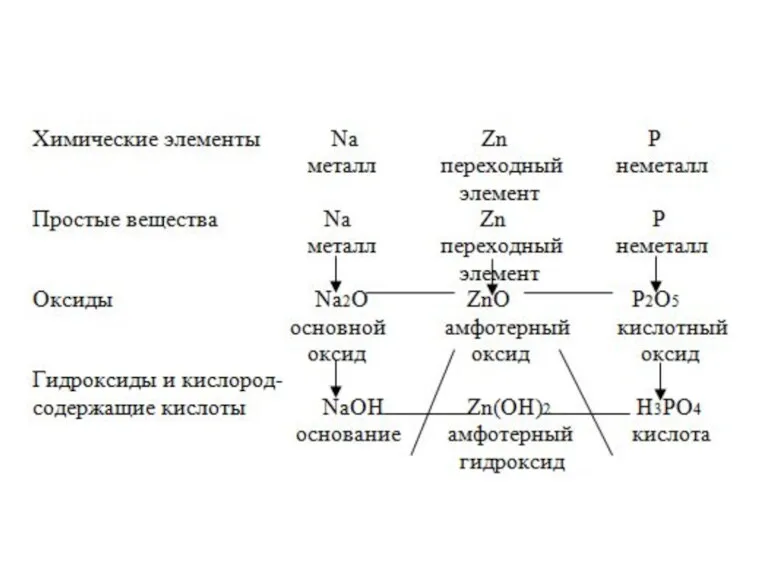
- 2. 1. Периодическая система элементов. Предсказание химических свойств элементов на основе таблицы.
- 7. 2. Типы химической связи.
- 8. Основные типы химической связи – ионная, квалентная и водородная.
- 9. Ионная связь образуется, когда "обмен "становится настолько неравными, что электрон отрывается от своего атома А и
- 10. Ковалентная связь образуется, когда два атома могут «обобщить» электроны: А . + В . → А:В
- 11. Водородсодержащие группы атомов (где атом водорода соединен с атомом фтора, кислорода или азота, реже: хлора, серы
- 12. 3. Типы химических реакций, правила протекания химических реакций; современные представления о скорости химических реакций.
- 14. Правила протекания реакций 1. Одно из веществ выпадает в осадок. 2. Одно из веществ удаляется в
- 15. Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени
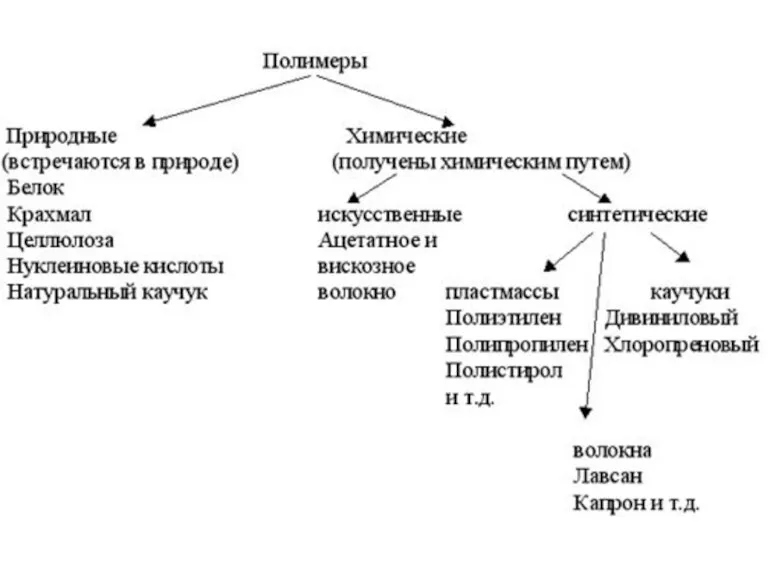
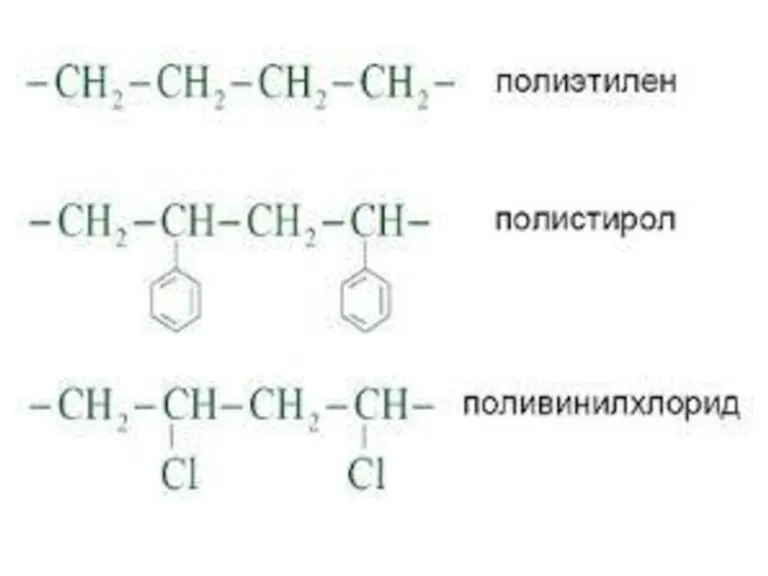
- 16. 4. Химические системы: растворы, дисперсные системы электрохимические системы, катализаторы и каталитические системы, полимеры.
- 17. Растворами называются гомогенные системы, содержащие не менее двух веществ. Могут существовать растворы твердых, жидких и газообразных
- 18. В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы. Газообразными растворами являются воздух
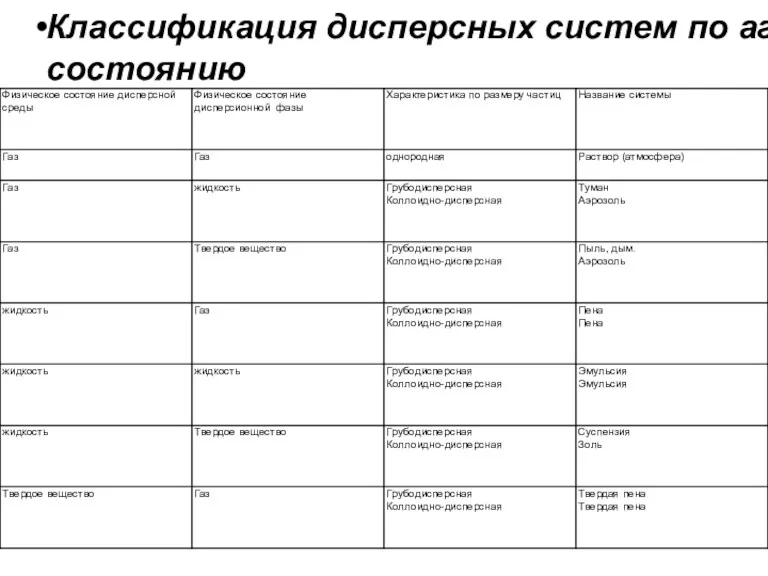
- 19. Дисперсные системы - это гетерогенные системы, состоящие из дисперсной фазы (х) и дисперсионной среды (у), свойства
- 21. Классификация дисперсных систем по размеру частиц
- 22. Классификация дисперсных систем по агрегатному состоянию
- 23. Электрохимическая система - система: - состоящая из двух электродов и находящегося с ними в контакте проводника
- 24. Все электрохимические системы можно условно подразделить на системы с химической реакцией и системы без химической реакции.
- 25. Катализатор — это вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в
- 26. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами. Гетерогенный
- 27. Настоящее изобретение касается каталитической системы, которая может быть использована для получения путем полимеризации диеновых эластомеров, состоящих
- 31. 5. КИСЛОТНО-ОСНОВНЫЕ И ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ВЕЩЕСТВ.
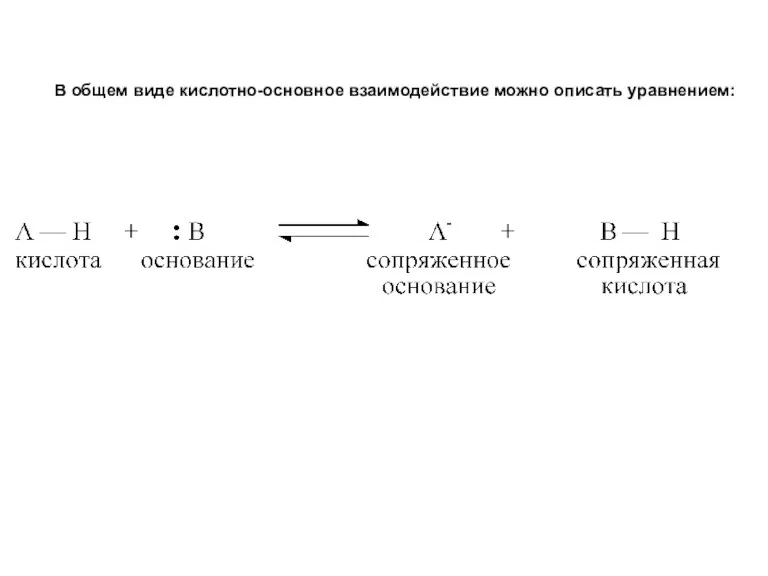
- 32. Наиболее распространенной концепцией кислотности и основности органических соединений является теория Бренстеда–Лоури. Согласно этой концепции, кислоты представляют
- 33. В общем виде кислотно-основное взаимодействие можно описать уравнением:
- 34. Передача электронов от атома к атому называется окислением-восстановлением. Окисляется тот атом, который отдает свои электроны, а
- 36. 6. Основные процессы, протекающие в электрохимических системах, процессы коррозии и методы борьбы с коррозией.
- 37. Коррозия — это в основном электрохимический процесс, в определенных условиях она становится чисто химическим явлением.
- 38. Коррозия — термин, применяемый обычно в отношении процесса разрушения металлов ржавчиной, которое вызывается электрохимическими процессами. Большинство
- 39. По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов: газовая коррозия;
- 40. По условиям протекания коррозионного процесса различаются следующие виды: контактная коррозия; щелевая коррозия; коррозия при неполном погружении;
- 41. По характеру разрушения: сплошная коррозия, охватывающая всю поверхность: равномерная; неравномерная; избирательная; Локальная (местная) коррозия, охватывающая отдельные
- 42. Главная классификация производится по механизму протекания процесса. Различают два вида: химическую коррозию; электрохимическую коррозию.
- 43. Коррозия приводит ежегодно к миллиардным убыткам, и решение этой проблемы является важной задачей. Основной ущерб, причиняемый
- 44. Ржавчина, самый распространенный вид коррозии.
- 45. Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 %
- 46. Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы. При проектировании
- 47. Газовая коррозия Атмосферная коррозия Коррозия при неполном погружении Коррозия по ватерлинии Коррозия при полном погружении Коррозия
- 48. 7. Особенности строения строительных материалов на производстве и в быту.
- 49. К строительным материалам (материал от лат. materia — вещество) относят природные и искусственные вещества, композиции и
- 50. Свойства строительного материала определяются его структурой. Для получения материала заданных свойств следует создать его внутреннюю структуру,
- 51. Макроструктуру твердых строительных материалов (исключая горные породы, имеющие свою геологическую классификацию) делят на следующие группы: конгломератная,
- 52. Кристаллические вещества, входящие в состав строительного материала, различают по характеру связи между частицами, образующими кристаллическую решетку.
- 53. Ионные связи образуются в кристаллах материалов, где связь имеет в основном ионный характер, например гипс, ангидрид.
- 54. Классификация материалов. Строительные материалы можно классифицировать по составу, структуре, свойствам, способу получения и области применения. Состав
- 56. Скачать презентацию













































 Медь, графит, алмаз
Медь, графит, алмаз Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Дослідження методів очищення висококольорових поверхневих вод
Дослідження методів очищення висококольорових поверхневих вод Пиролиз нефтяного сырья
Пиролиз нефтяного сырья Пневмовакуум-формование
Пневмовакуум-формование Йодометрия
Йодометрия Металлы
Металлы Нефть и газ
Нефть и газ Металдарға қандай физикалық қасиеттер тән?
Металдарға қандай физикалық қасиеттер тән? Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Гідроліз солей
Гідроліз солей ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Способы переработки нефти
Способы переработки нефти Алкадиены (диеновые углеводороды)
Алкадиены (диеновые углеводороды) Виды мелиорации земель. Химическая реабилитация урбаноземов
Виды мелиорации земель. Химическая реабилитация урбаноземов Качественные реакции на органические вещества
Качественные реакции на органические вещества Мінерали та гірські породи
Мінерали та гірські породи Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă
Cromatografie de lichide de inalta performanta cuplata cu spectrometrie de masă Фотохимический смог
Фотохимический смог Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Виды изомерии в органической химии
Виды изомерии в органической химии Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини Основные положения теории резонанса
Основные положения теории резонанса The application nanotechnology in chemistry
The application nanotechnology in chemistry Растворы. Способы выражения концентрации раствора
Растворы. Способы выражения концентрации раствора КСЕ. Концепции химии. (Лекция 6)
КСЕ. Концепции химии. (Лекция 6)