Содержание
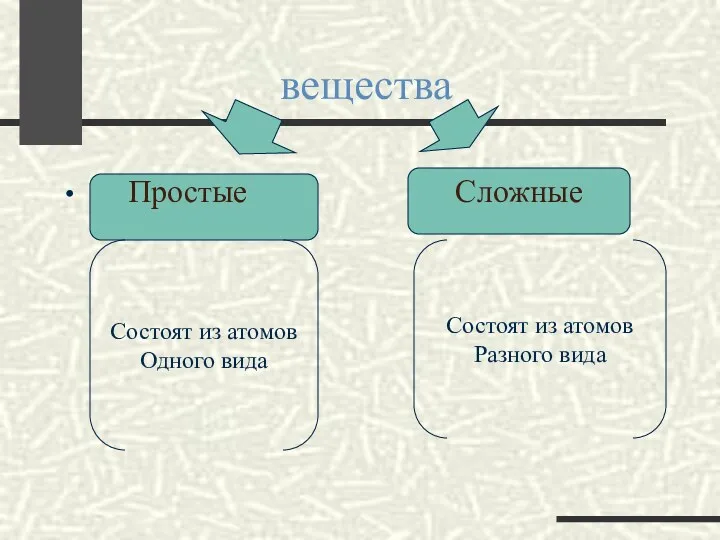
- 2. вещества Простые Сложные Состоят из атомов Одного вида Состоят из атомов Разного вида
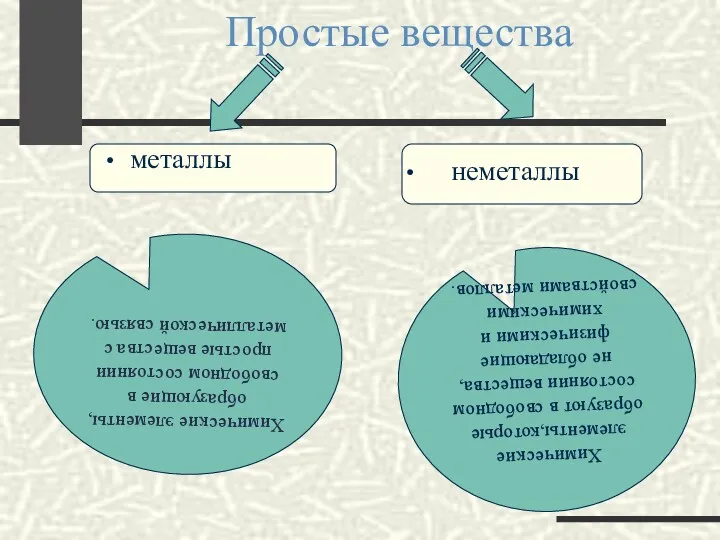
- 3. Простые вещества металлы неметаллы Химические элементы, образующие в свободном состоянии простые вещества с металлической связью. Химические
- 4. Древние века и средние века – 7 металлов (Au, Ag, Cu,Pb, Fe, Hg) М.В. Ломоносов -
- 5. Нахождение металлов в природе В виде соединений В самородном состоянии (Au, Pt, Ag) В виде солей
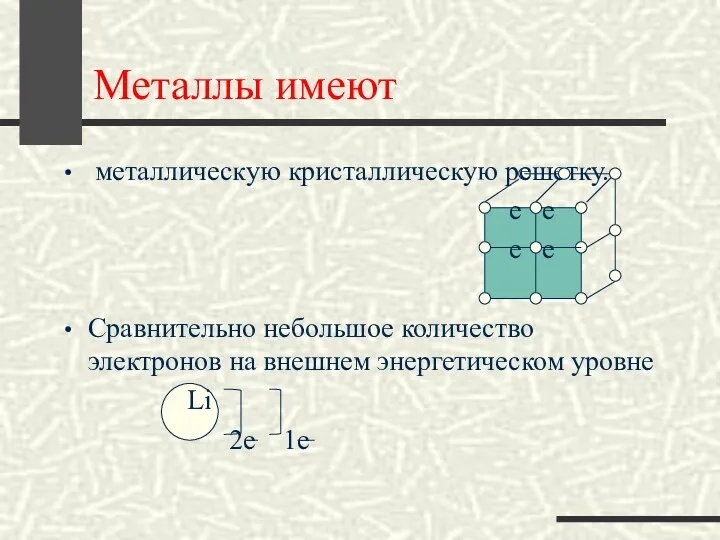
- 6. Металлы имеют металлическую кристаллическую решетку. е е е е Сравнительно небольшое количество электронов на внешнем энергетическом
- 7. Имеют свободные валентные электроны Металлическая связь не обладает направленностью и насыщенностью. Подвижные электроны компенсируют электрическое отталкивание
- 8. Физические свойства металлов Твердые вещества, кроме ртути. (самый мягкий – калий, самый твердый – хром)
- 9. Пластичные Au, Ag, Cu, Sn, Pb,Zn, Fe уменьшается
- 10. Теплопроводность Hg, Cu, Ag, Al, Fe уменьшается Электропроводность Ag Mn уменьшается
- 11. Температура плавления Легкоплавкие тугоплавкие Hg, Ga, Cs, In, Bi W, Mo, V, Cr
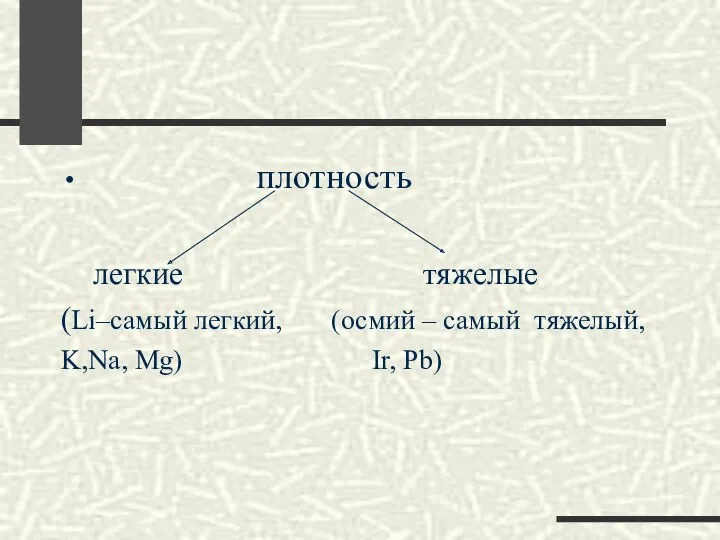
- 12. плотность легкие тяжелые (Li–самый легкий, (осмий – самый тяжелый, K,Na, Mg) Ir, Pb)
- 13. Обладают металлическим блеском
- 14. Причины, приводящие к различию в физических свойств металлов Атомы металлов образуют разные типы кристаллических решеток
- 15. Причины, приводящие к различию физических свойств Атомы металлов имеют разное число валентных электронов, участвующих в образовании
- 16. положение металлов в периодической системе Д. И.Менделеева
- 17. Загадочные соседи Щелочно-земельные металлы Переходные металлы Щелочные металлы
- 18. Химические свойства металлов Металлы в химических реакциях являются восстановителями, при этом они окисляются Mo – ne
- 19. Металлы вытесняются из их соединений другими металлами Н.Н. Бекетов – создал «вытеснительный ряд» (прототип электрохимического ряда
- 20. Взаимодействуют с простыми веществами С галогенами и кислородом 2Na + Cl2 = 2 Na Cl Mg
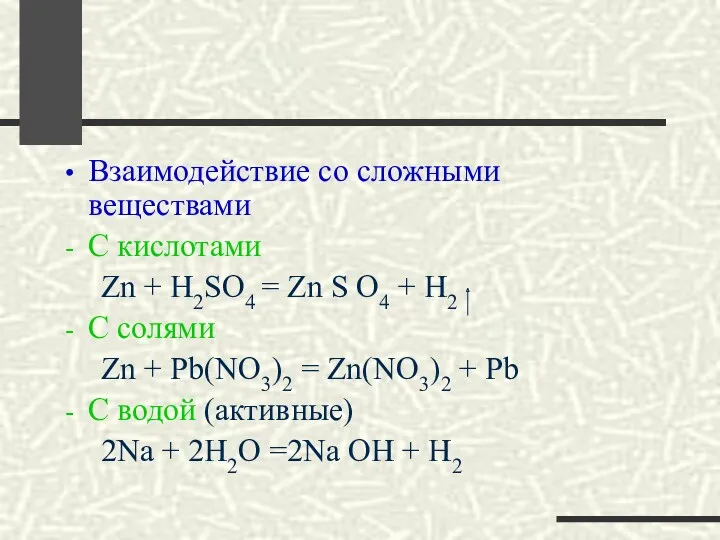
- 21. Взаимодействие со сложными веществами С кислотами Zn + H2SO4 = Zn S O4 + H2 C
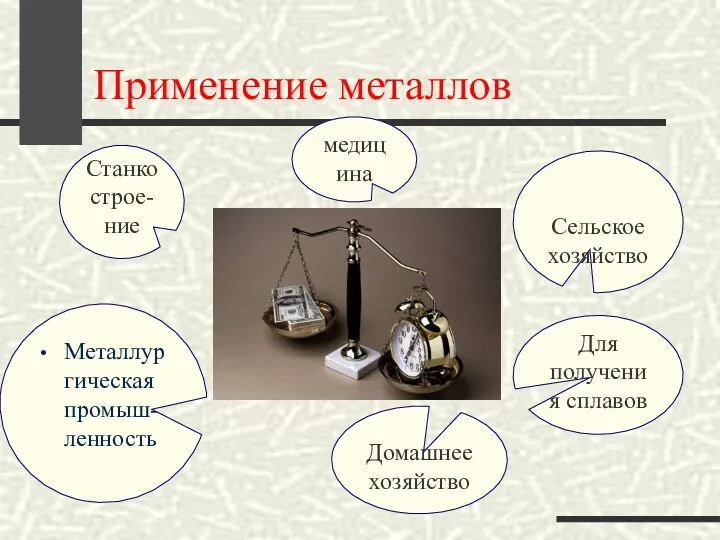
- 22. Применение металлов Металлургическая промыш-ленность Станкострое-ние медицина Сельское хозяйство Для получения сплавов Домашнее хозяйство
- 24. Скачать презентацию















 Последствия применения удобрений в сельском хозяйстве
Последствия применения удобрений в сельском хозяйстве Аминокислоты и белки
Аминокислоты и белки Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Энергетика химических реакций
Энергетика химических реакций Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si Химические свойства серной кислоты
Химические свойства серной кислоты Белки. Строение и свойства
Белки. Строение и свойства Аммиак. Соли аммония
Аммиак. Соли аммония Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Задачи на избыток-недостаток
Задачи на избыток-недостаток Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Основные задачи и понятия химической метрологии
Основные задачи и понятия химической метрологии Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани
Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани Основания - свойства ТЭД
Основания - свойства ТЭД Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Строение атома
Строение атома Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази
Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази Alyuminiy_ego_soedinenia
Alyuminiy_ego_soedinenia Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Топливо. Виды топлива
Топливо. Виды топлива Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл