Содержание
- 2. Электролиз Электролиз-это окислительно-восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускают постоянный электрический
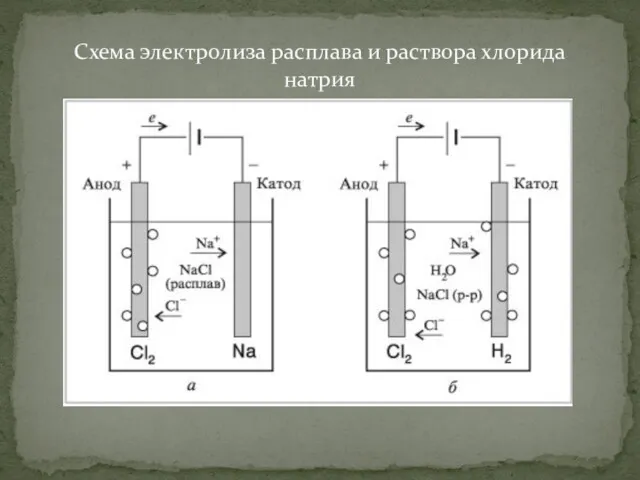
- 3. Движение ионов в расплаве или в растворе электролита является беспорядочным, хаотическим. Но если в раствор или
- 4. Схема электролиза расплава и раствора хлорида натрия
- 5. КАТОД 5 букв МИНУС Катод Катионы Восстановление Принимают электроны АНОД 4 буквы ПЛЮС Анод Анионы Окисление
- 6. Процесс на катоде -процесс на катоде не зависит от материала катода, а зависит от положения металла
- 7. Катодные процессы в водных растворах солей
- 8. Процесс на аноде зависит от материала анода. Аноды могут быть двух видов растворимые и нерастворимые. Нерастворимые
- 9. Процесс на аноде
- 10. Анион карбоновой кислоты окисляется на аноде, образуя СО2 и свободный алкильный радикал. Алкильные радикалы димеризуются на
- 11. Законы Фарадея: масса электролита, подвергшаяся превращению при электролизе, а также массы, образующихся на электродах веществ, прямо
- 12. Электролиз широко используется в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний,
- 13. При изучении темы «Электролитическая диссоциация» по заданию учителя были изготовлены несколько приборов для проверки электропроводности. Одни
- 14. Электропроводность воды мы обнаружили с помощью более чувствительного прибора.
- 15. Электролиз раствора гидроксида натрия.
- 16. Электролиз раствора серной кислоты.
- 17. Щелочи, кислородосодержащих кислоты, соли кислородосодержащих кислот и активных металлов. (K, Na, Ca) NaOH? + Na +
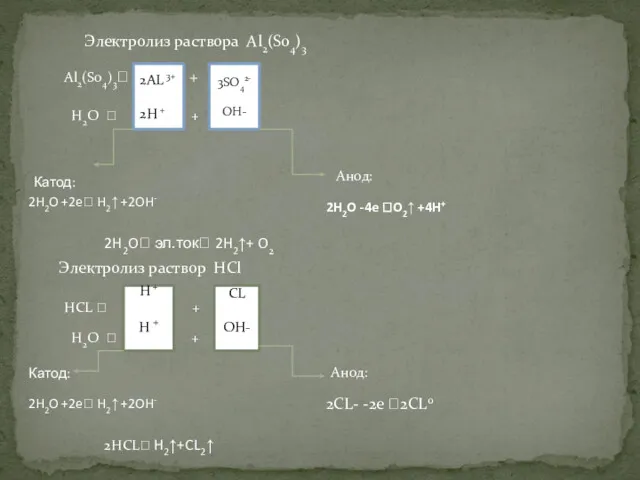
- 18. Электролиз раствора сульфата алюминия .
- 19. Электролиз раствора соляной кислоты.
- 20. Al2(S04)3? + 2AL 3+ 2H + H2O ? + 3SO42- OH- Катод: Анод: 2H2O +2e? H2↑
- 21. Электролиз раствора хлорида меди (II)
- 22. Выделение меди на катоде.
- 23. Электролиз раствора сульфата никеля.
- 24. Электролиз раствора сульфата кобальта (III)
- 25. Электролиз раствора сульфата меди (II)
- 26. Выделение меди на катоде.
- 27. Электролиз раствора KI KI? + H2O ? + K + 2H + I- OH- Катод: Анод:
- 28. Продукты электролиза водных растворов электролитов
- 29. Заключение Теория проверяется практикой В результате проведенной работы мы убедились в том, что 1. При электролизе
- 30. ФОРМУЛА СОЛИ А) Al(NO3)3 Б) KF В) Cu(NO3)2 Г) FeBr2 ПРОДУКТ НА КАТОДЕ 1) Медь 2)
- 31. НАЗВАНИЕ СОЛИ А) Бромид алюминия Б) Сульфат рубидия В) Нитрат ртути(II) Г) Хлорид золота ПРОДУКТ НА
- 32. С-2. При взаимодействии оксида алюминия с азотной кислотой образовалась соль, которую высушили и прокалили. Образовавшийся при
- 33. 1. При взаимодействии оксида алюминия с азотной кислотой образовалась соль: Al2O3 + 6HNO3 = 2Al(NO3)3 +
- 34. С-2. Вещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, прореагировало с сероводородом.
- 35. 1. Вещество получено на аноде при электролизе раствора йодида натрия с инертными электродами: 2NaI + 2H2O
- 36. С-3. Раствор хлорида железа(III) подвергли электролизу с графитовыми электродами. Осадок бурого цвета, образовавшийся в качестве побочного
- 37. 1. Раствор хлорида железа (III) подвергли электролизу с графитовыми электродами: 4FeCl3 + 6H2O ======== 2Fe +
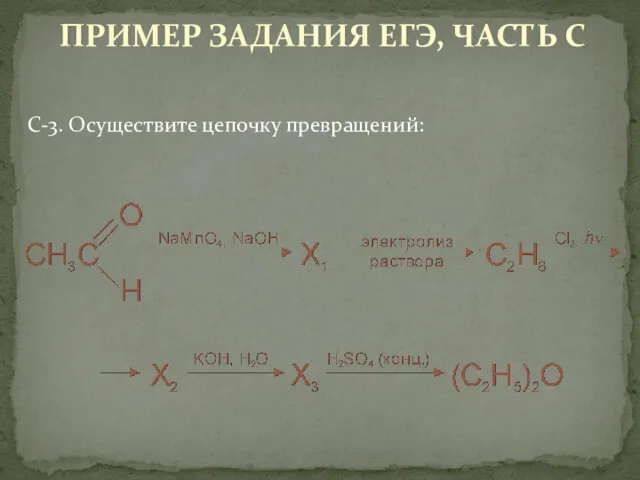
- 38. С-3. Осуществите цепочку превращений: ПРИМЕР ЗАДАНИЯ ЕГЭ, ЧАСТЬ С
- 39. 1. При электролизе 16г. расплава некоторого соединения водорода с одновалентным элементом на аноде выделился водород количеством
- 40. Решение задач № 1
- 42. Скачать презентацию




































 АльдегидыКетоны-1
АльдегидыКетоны-1 Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Месторождения турмалина
Месторождения турмалина Биотыңайтқыштар
Биотыңайтқыштар Галогены. Нахождение в природе
Галогены. Нахождение в природе Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Электролиз водных растворов
Электролиз водных растворов №9 зертханалық жұмыс
№9 зертханалық жұмыс Расстояние между молекулами в разных агрегатных состояниях
Расстояние между молекулами в разных агрегатных состояниях Физические свойства минералов
Физические свойства минералов Электролиз
Электролиз Использование сплавов алюминия
Использование сплавов алюминия Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення 20190430_otkrytyy_urok_kislotypptx
20190430_otkrytyy_urok_kislotypptx Химическая связь. Лекция 5
Химическая связь. Лекция 5 Rhodium
Rhodium Алкены. Этилен
Алкены. Этилен Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Химические элементы в организме человека
Химические элементы в организме человека Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Ионоселективные электроды
Ионоселективные электроды Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Природные источники углеводородов
Природные источники углеводородов Алюминий и его соединения
Алюминий и его соединения Алканы. Углеводороды. Предельные (насыщенные, алканы)
Алканы. Углеводороды. Предельные (насыщенные, алканы) Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Альдегиды и кетоны. Лекция 10
Альдегиды и кетоны. Лекция 10