Содержание
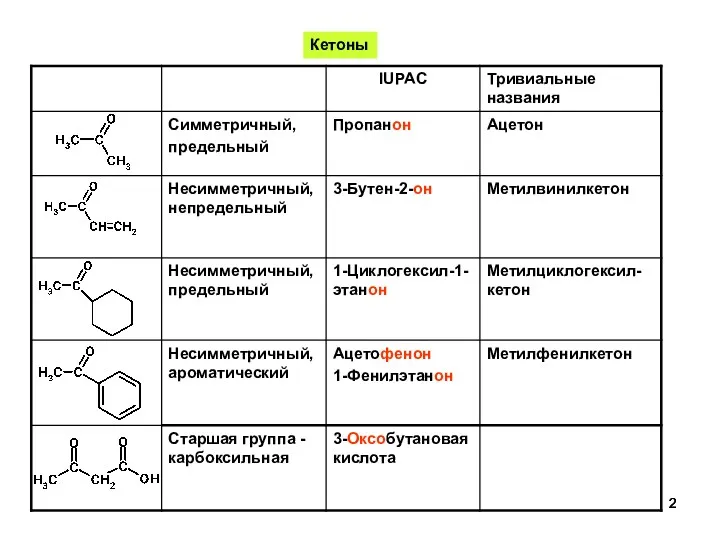
- 2. Кетоны
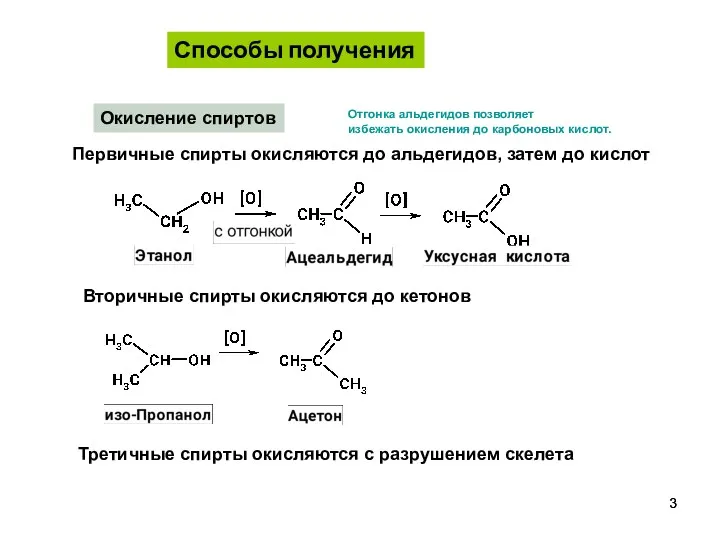
- 3. Окисление спиртов Первичные спирты окисляются до альдегидов, затем до кислот Вторичные спирты окисляются до кетонов Третичные
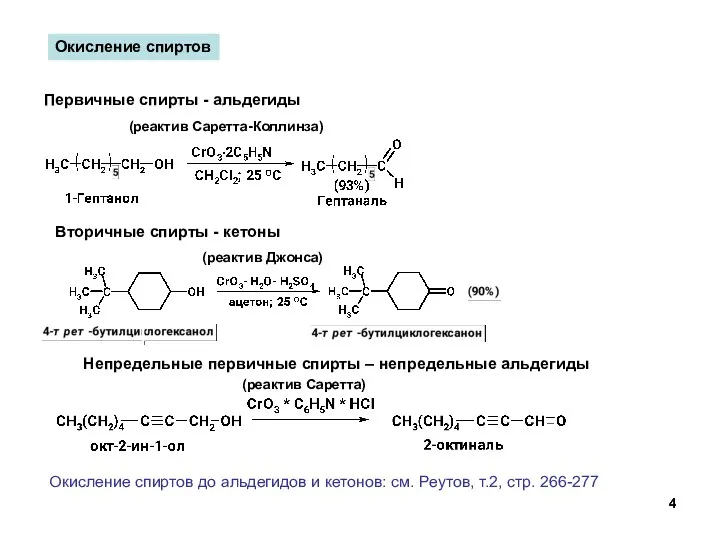
- 4. Окисление спиртов Первичные спирты - альдегиды (реактив Саретта-Коллинза) Вторичные спирты - кетоны Непредельные первичные спирты –
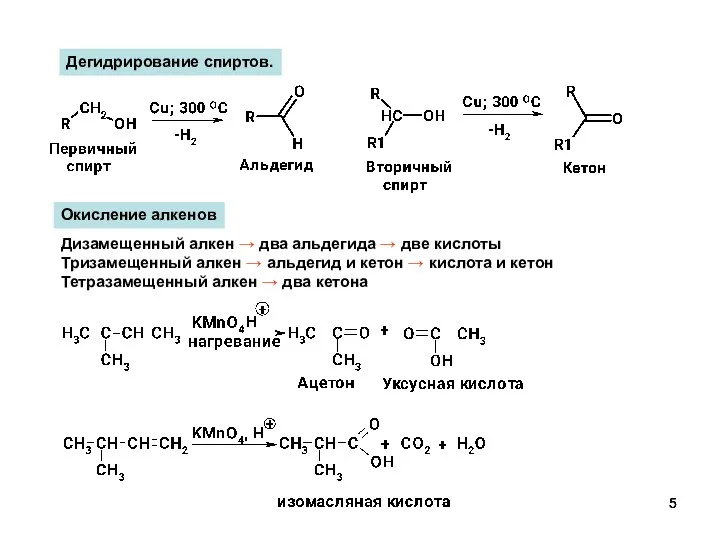
- 5. Дегидрирование спиртов. Окисление алкенов Дизамещенный алкен → два альдегида → две кислоты Тризамещенный алкен → альдегид
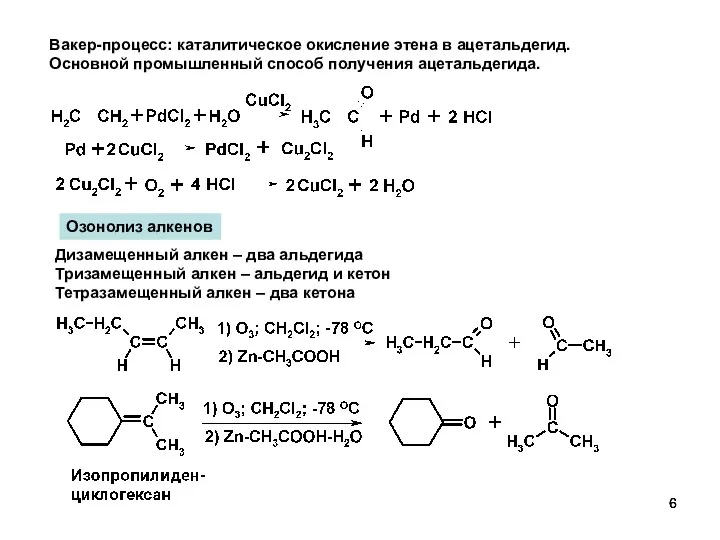
- 6. Дизамещенный алкен – два альдегида Тризамещенный алкен – альдегид и кетон Тетразамещенный алкен – два кетона
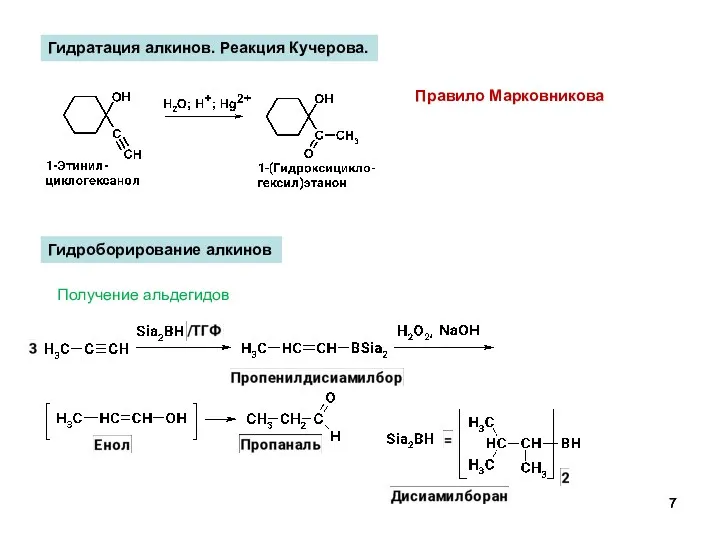
- 7. Гидратация алкинов. Реакция Кучерова. Правило Марковникова Гидроборирование алкинов Получение альдегидов
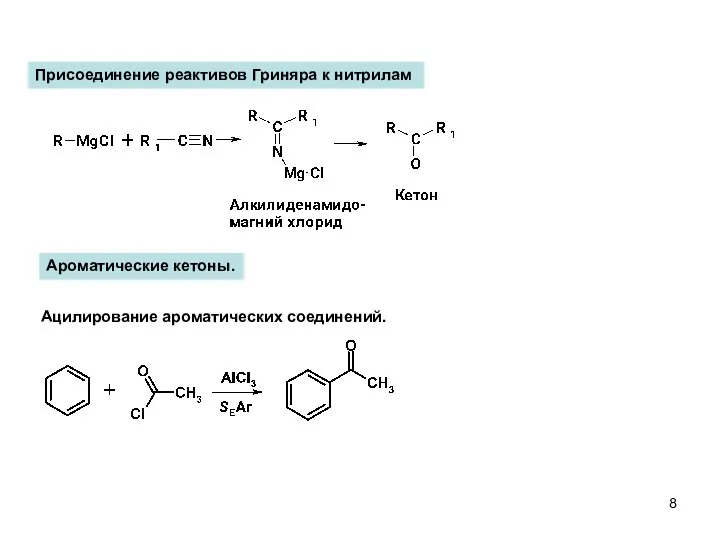
- 8. Ацилирование ароматических соединений. Ароматические кетоны. Присоединение реактивов Гриняра к нитрилам
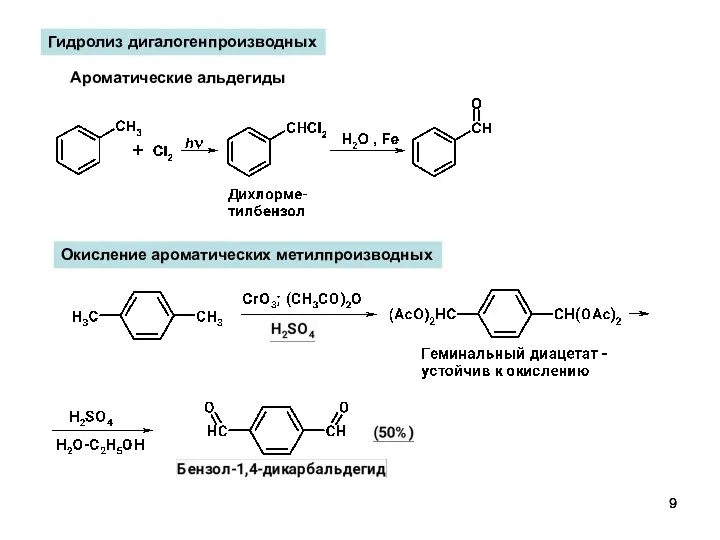
- 9. Гидролиз дигалогенпроизводных Ароматические альдегиды Окисление ароматических метилпроизводных
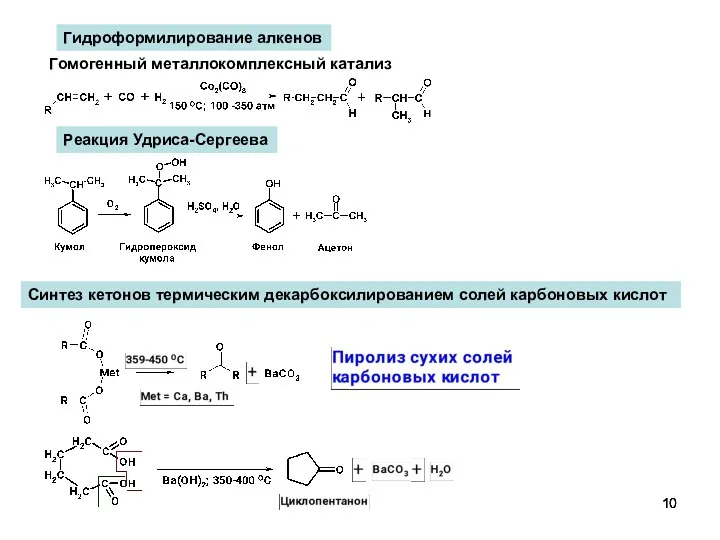
- 10. Гидроформилирование алкенов Гомогенный металлокомплексный катализ Реакция Удриса-Сергеева Синтез кетонов термическим декарбоксилированием солей карбоновых кислот
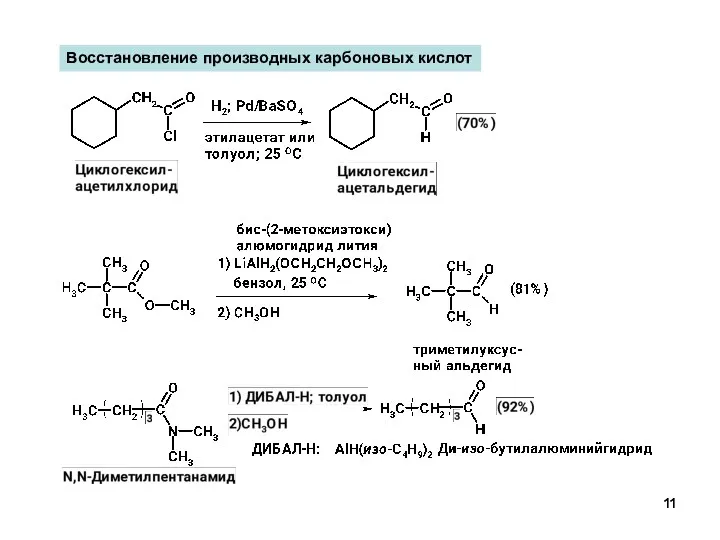
- 11. Восстановление производных карбоновых кислот
- 12. Физические свойства и строение молекулы. Charges C -0.165 [C(1)] C 0.527 [C(2)] C -0.077 [C(3)] C
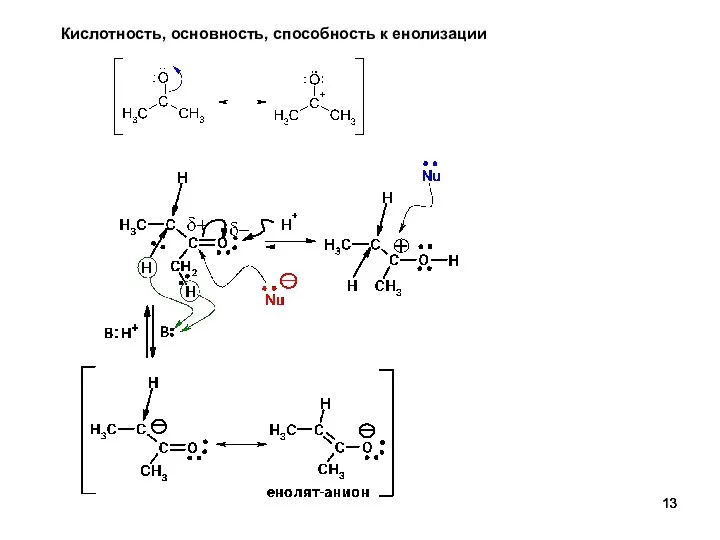
- 13. Кислотность, основность, способность к енолизации
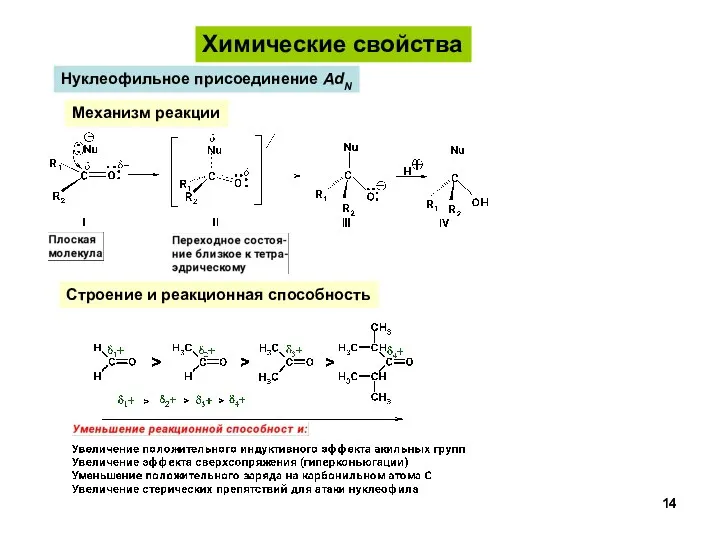
- 14. Химические свойства Нуклеофильное присоединение AdN Строение и реакционная способность Механизм реакции
- 15. Присоединение цианид-иона. Образование циангидринов. Механизм AdN2 v=k[CC=O] [CСN-]
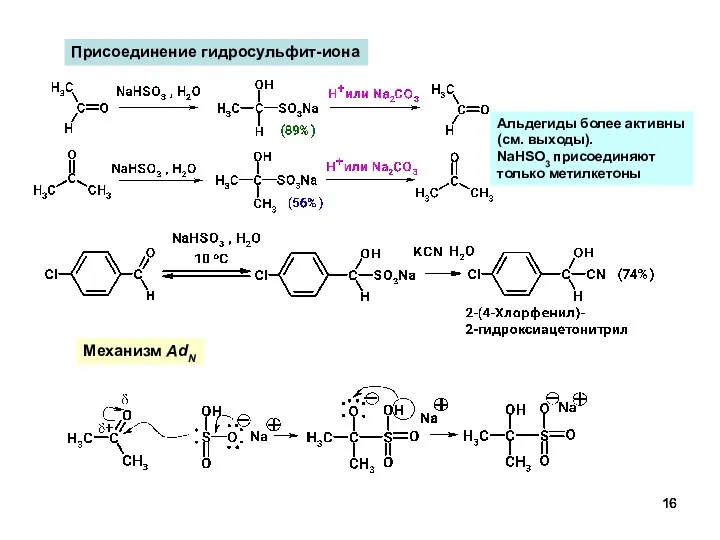
- 16. Присоединение гидросульфит-иона Механизм AdN Альдегиды более активны (см. выходы). NaHSO3 присоединяют только метилкетоны
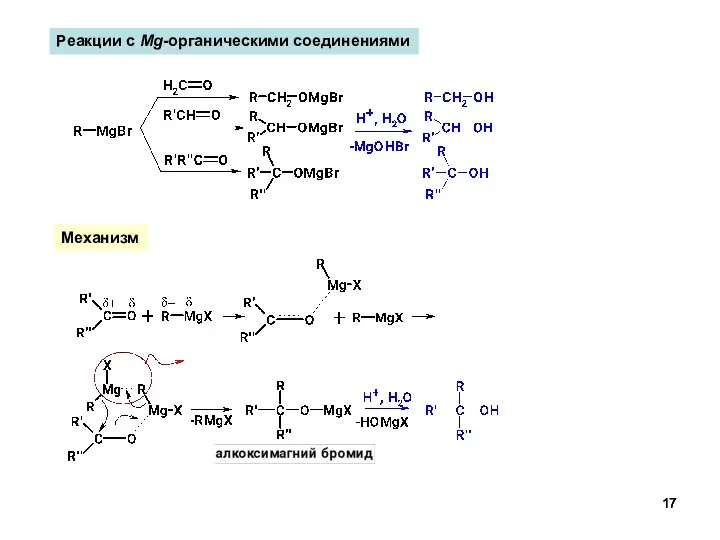
- 17. Реакции с Mg-органическими соединениями Механизм
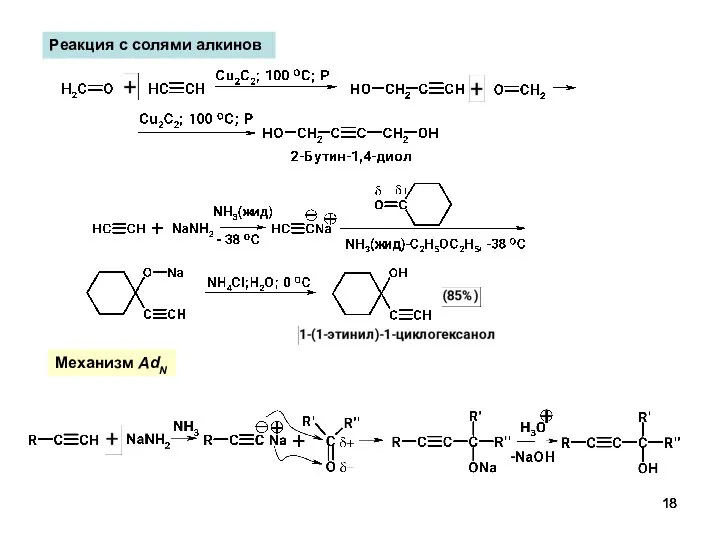
- 18. Реакция с солями алкинов Механизм AdN
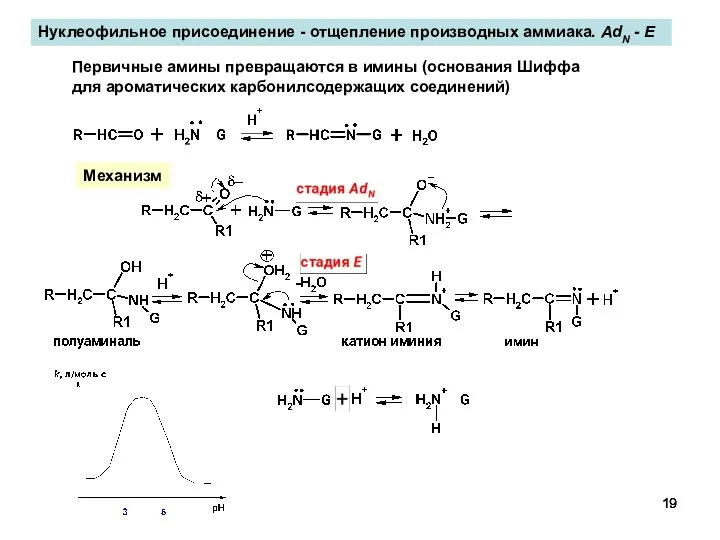
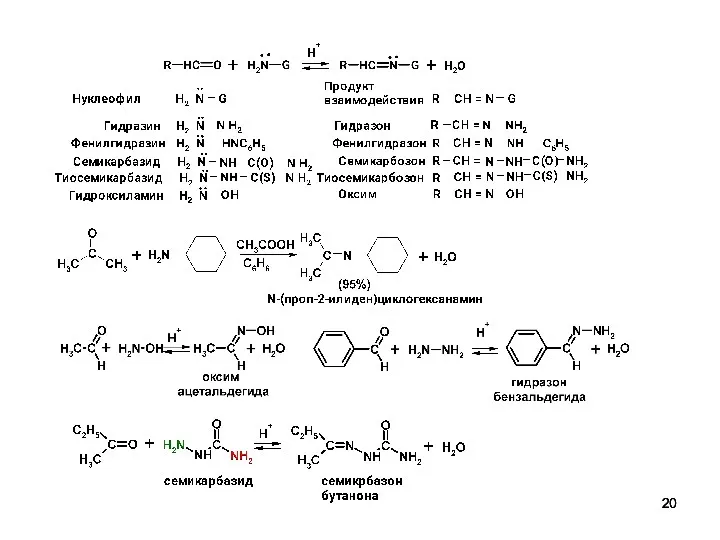
- 19. Нуклеофильное присоединение - отщепление производных аммиака. AdN - E Первичные амины превращаются в имины (основания Шиффа
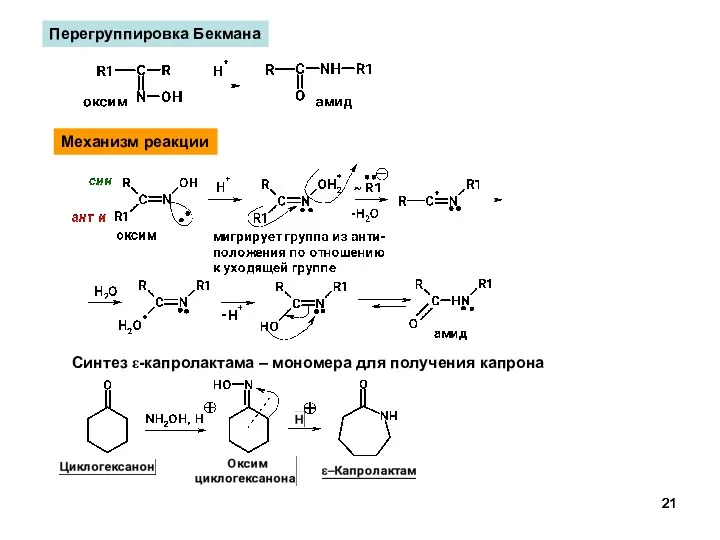
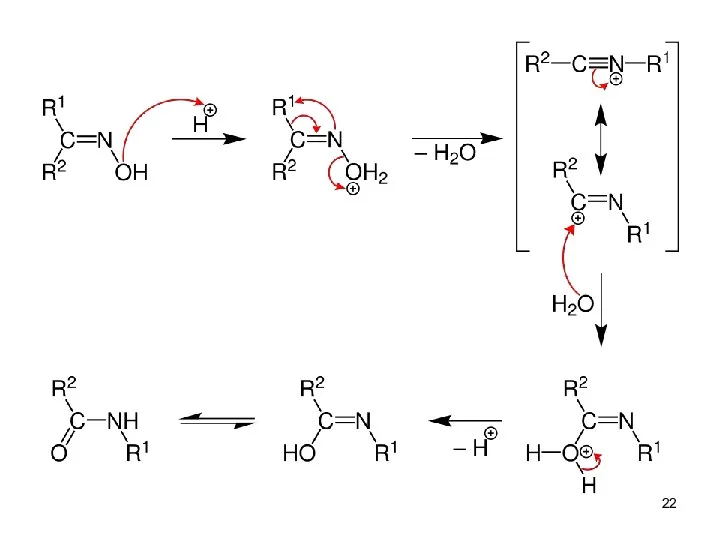
- 21. Перегруппировка Бекмана Синтез ε-капролактама – мономера для получения капрона Механизм реакции
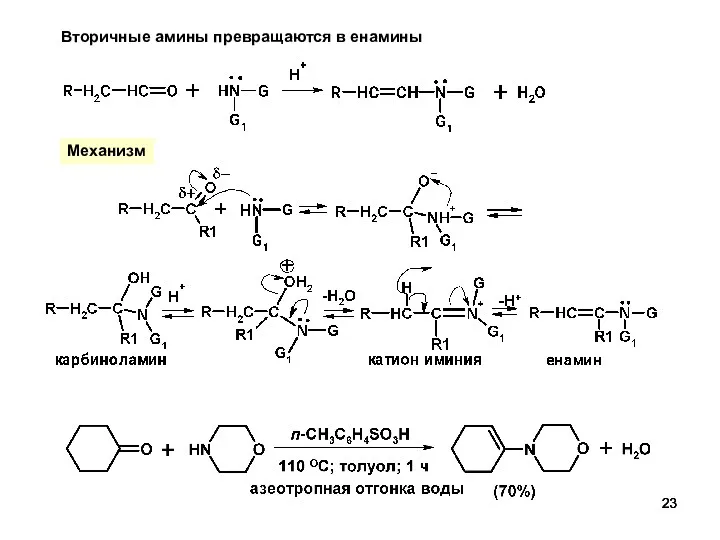
- 23. Вторичные амины превращаются в енамины Механизм
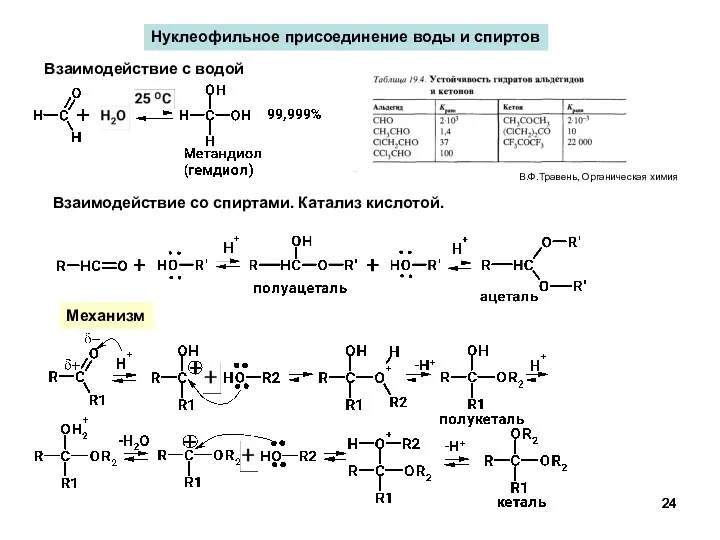
- 24. Нуклеофильное присоединение воды и спиртов Механизм В.Ф.Травень, Органическая химия Взаимодействие с водой Взаимодействие со спиртами. Катализ
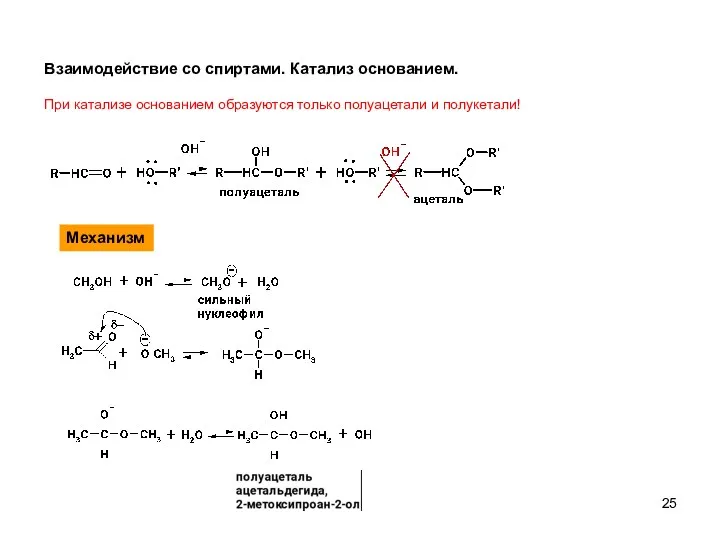
- 25. Взаимодействие со спиртами. Катализ основанием. При катализе основанием образуются только полуацетали и полукетали! Механизм
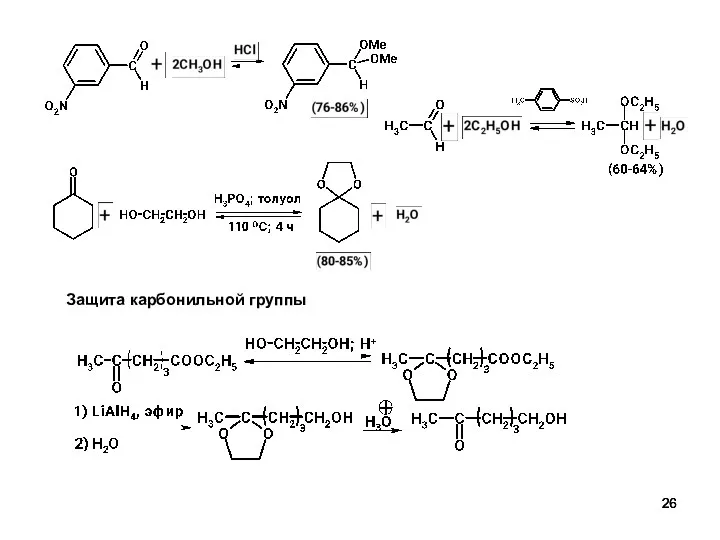
- 26. Защита карбонильной группы
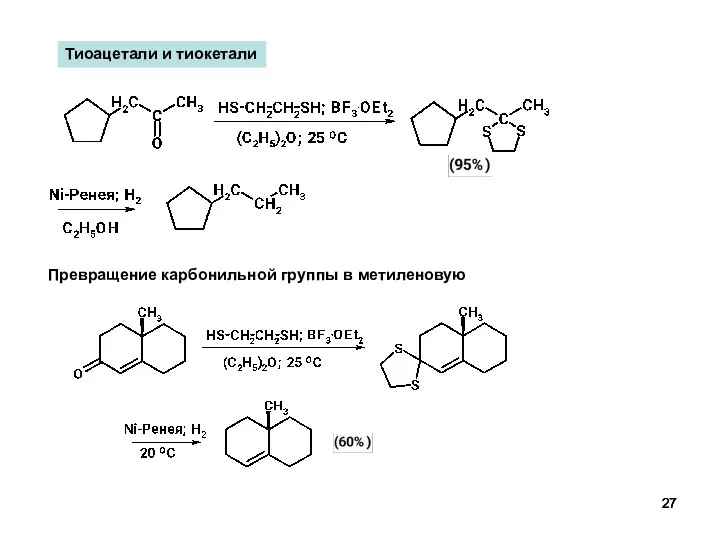
- 27. Тиоацетали и тиокетали Превращение карбонильной группы в метиленовую
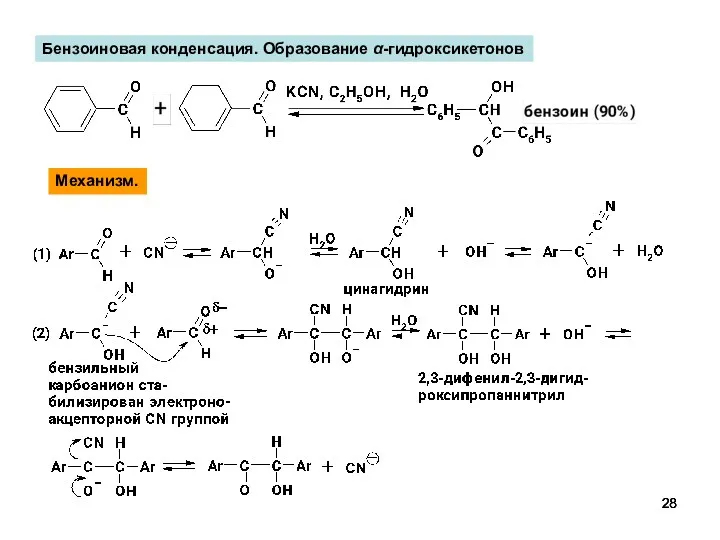
- 28. Бензоиновая конденсация. Образование α-гидроксикетонов Механизм.
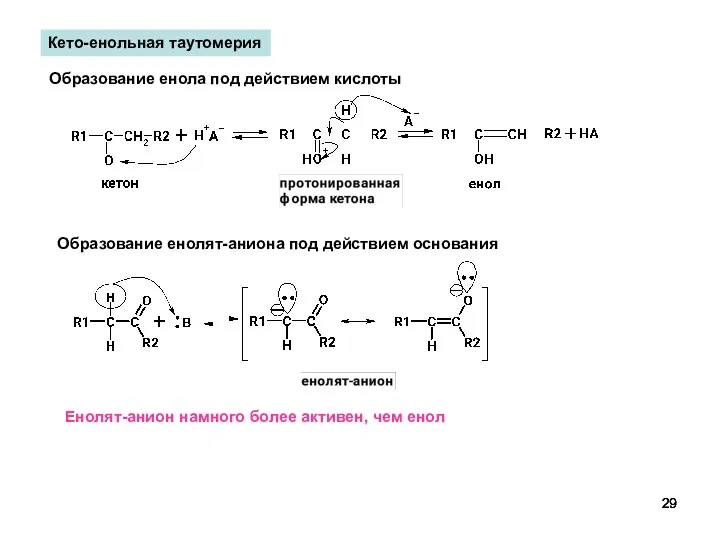
- 29. Кето-енольная таутомерия Образование енола под действием кислоты Образование енолят-аниона под действием основания Енолят-анион намного более активен,
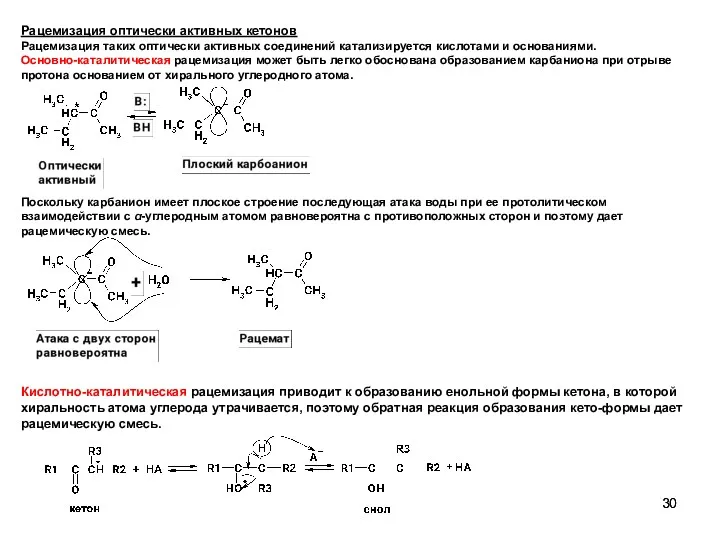
- 30. Рацемизация оптически активных кетонов Рацемизация таких оптически активных соединений катализируется кислотами и основаниями. Основно-каталитическая рацемизация может
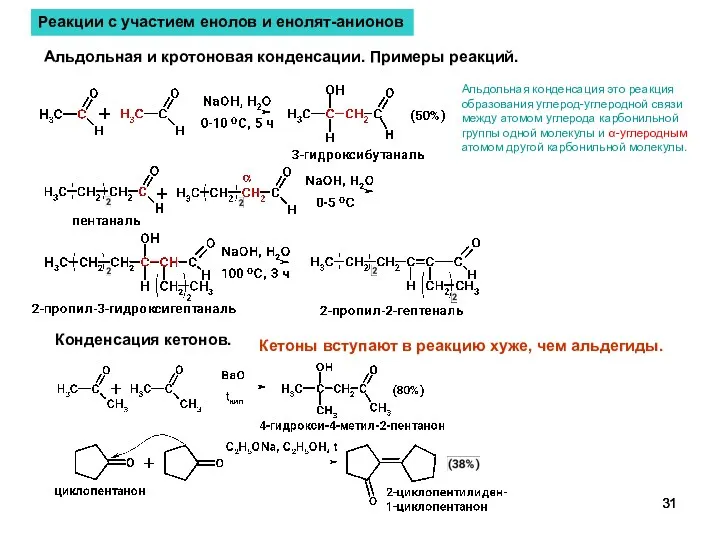
- 31. Реакции с участием енолов и енолят-анионов Альдольная и кротоновая конденсации. Примеры реакций. Конденсация кетонов. Кетоны вступают
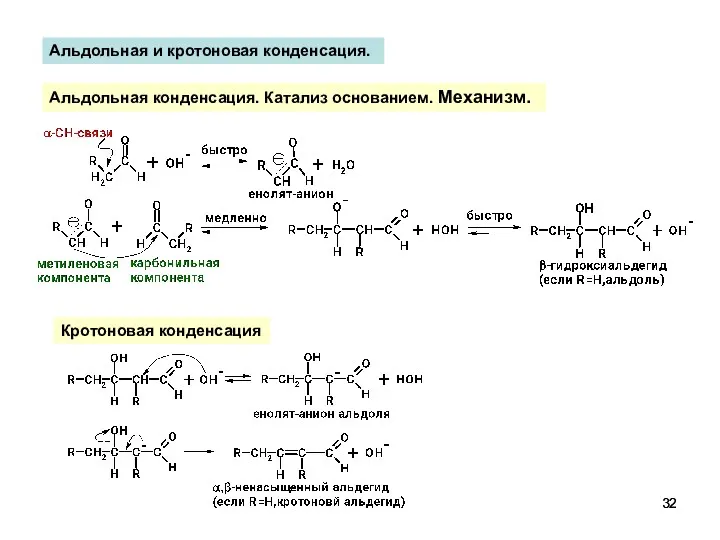
- 32. Альдольная конденсация. Катализ основанием. Механизм. Кротоновая конденсация Альдольная и кротоновая конденсация.
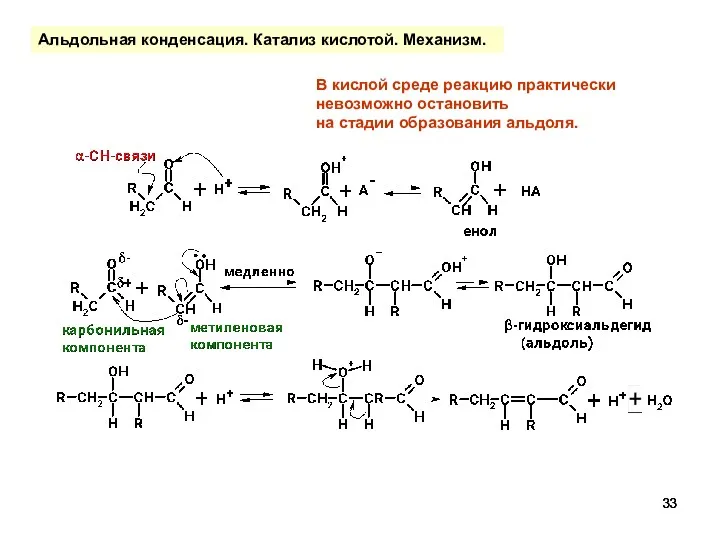
- 33. Альдольная конденсация. Катализ кислотой. Механизм. В кислой среде реакцию практически невозможно остановить на стадии образования альдоля.
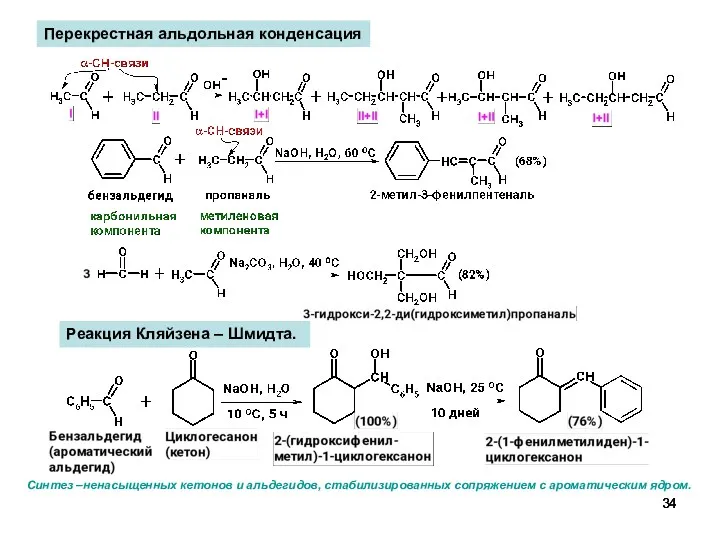
- 34. Перекрестная альдольная конденсация Реакция Кляйзена – Шмидта. Синтез –ненасыщенных кетонов и альдегидов, стабилизированных сопряжением с ароматическим
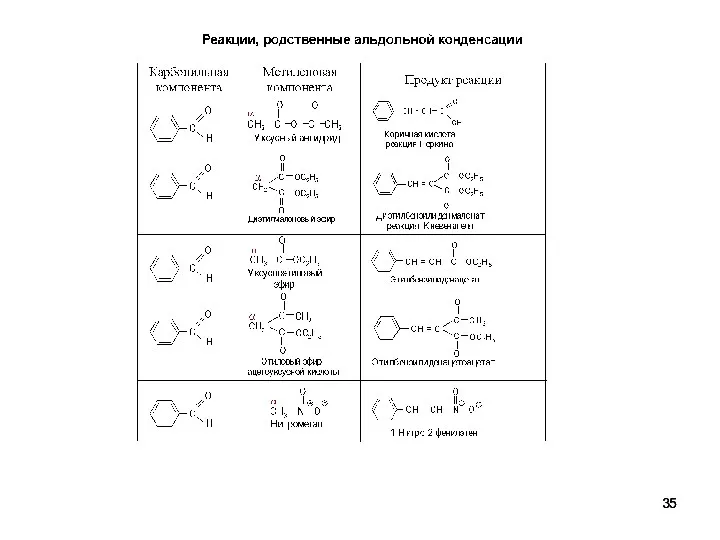
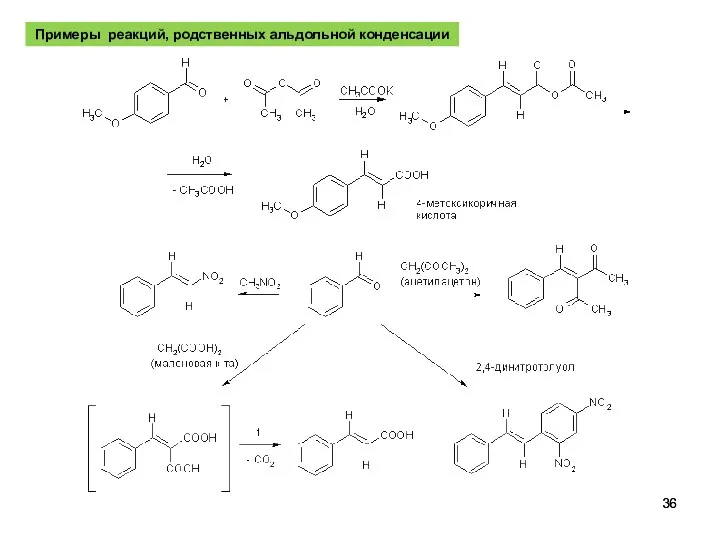
- 36. Примеры реакций, родственных альдольной конденсации
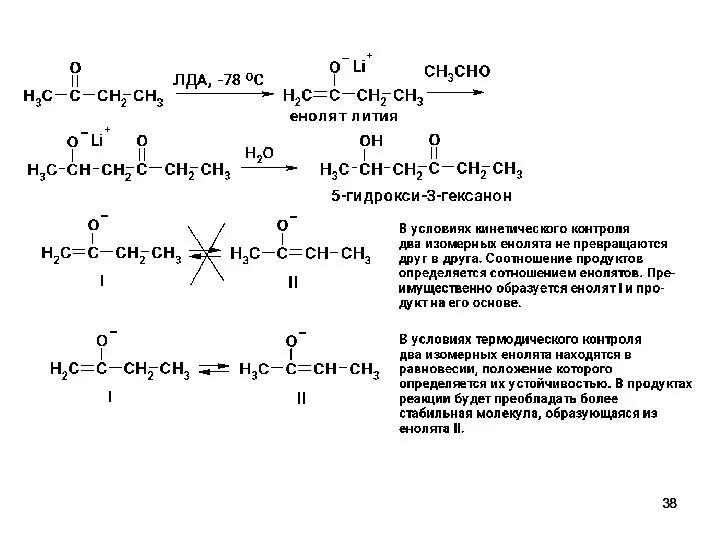
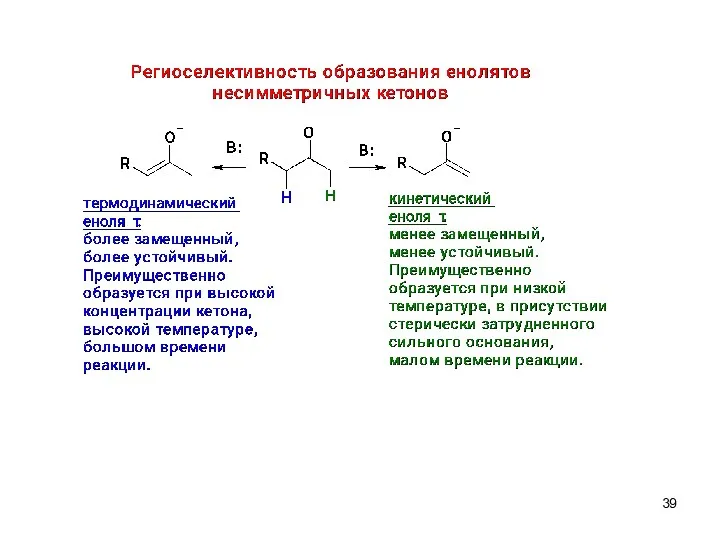
- 37. Региоселективная перекрестная альдольная конденсация В условиях кинетического контроля (низкая температура), применения апротонного растворителя и стерически затрудненного
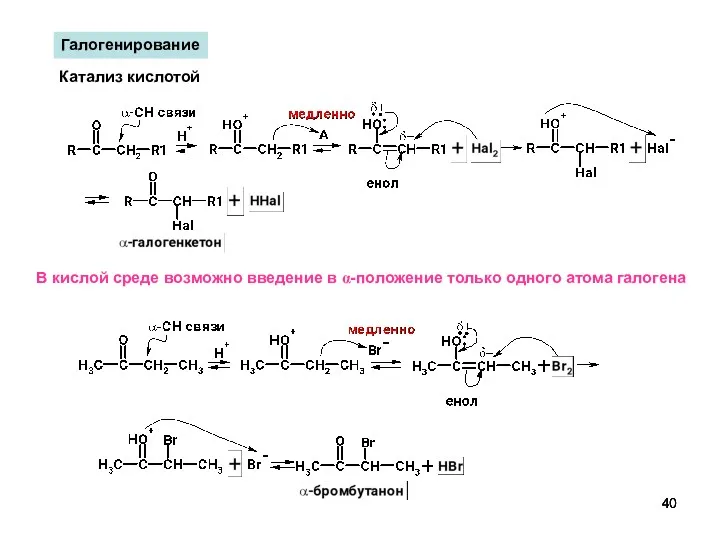
- 40. Галогенирование Катализ кислотой В кислой среде возможно введение в α-положение только одного атома галогена
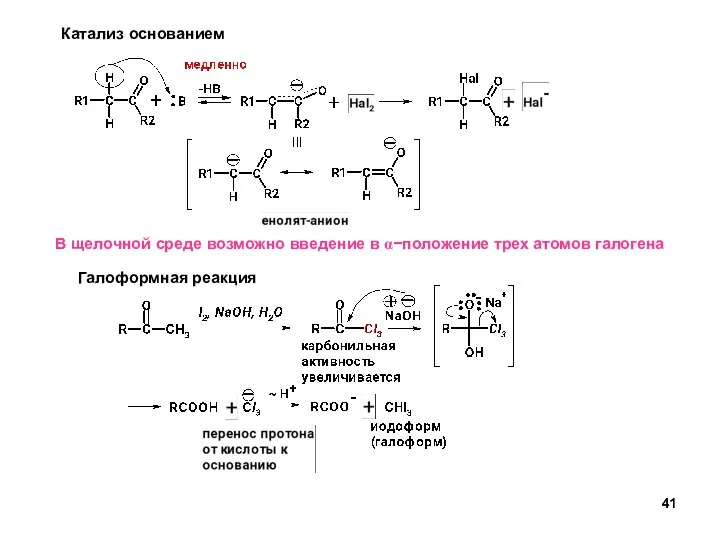
- 41. Катализ основанием В щелочной среде возможно введение в α−положение трех атомов галогена Галоформная реакция
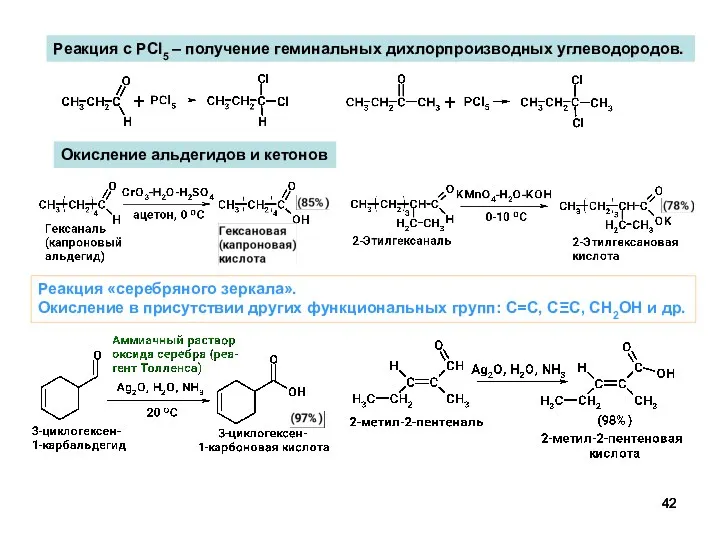
- 42. Окисление альдегидов и кетонов Реакция с PCl5 – получение геминальных дихлорпроизводных углеводородов. Реакция «серебряного зеркала». Окисление
- 43. Реакция «серебряного зеркала».
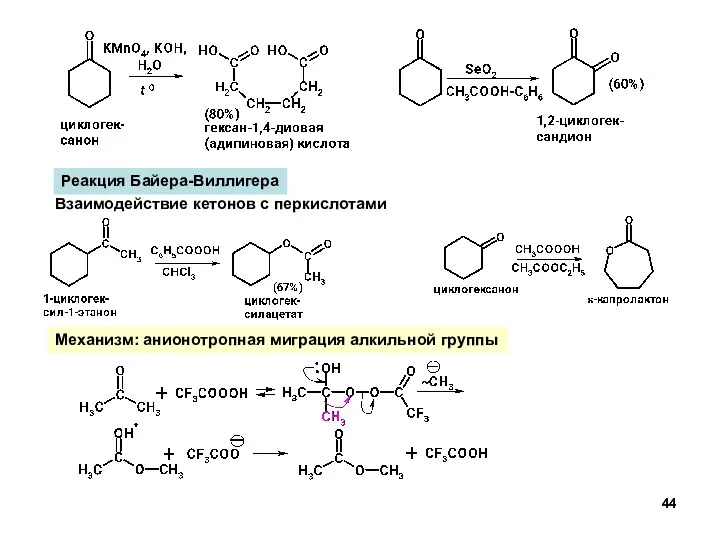
- 44. Реакция Байера-Виллигера Взаимодействие кетонов с перкислотами Механизм: анионотропная миграция алкильной группы
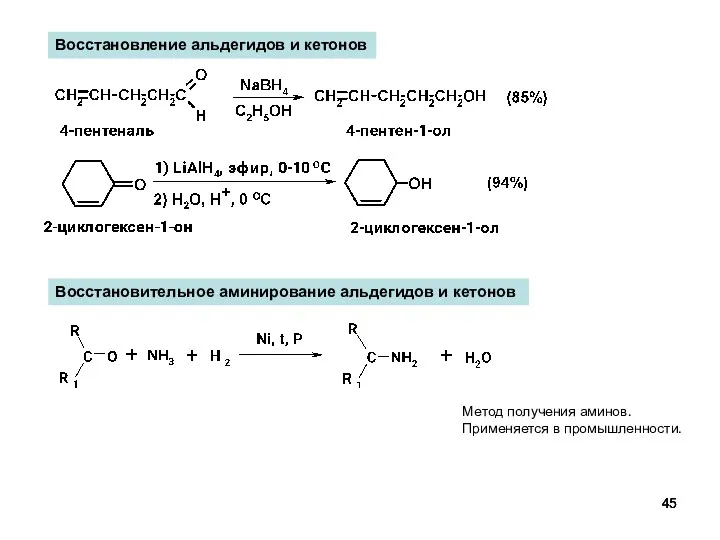
- 45. Восстановление альдегидов и кетонов Восстановительное аминирование альдегидов и кетонов Метод получения аминов. Применяется в промышленности.
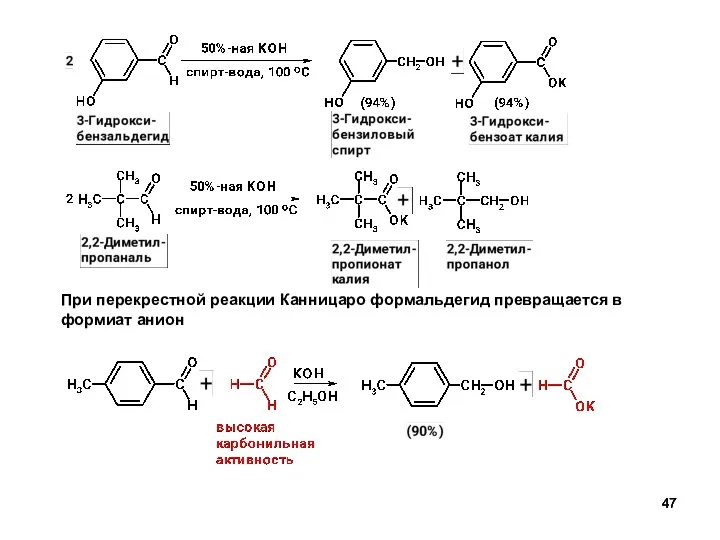
- 46. Реакция С.Канницаро (окисление-восстановление) Альдегиды, не имеющие α-C-H-связей, в присутствии щелочи подвергаются реакции диспропорционирования: Механизм v=k[ArCHO]2.[OH- ]
- 47. При перекрестной реакции Канницаро формальдегид превращается в формиат анион
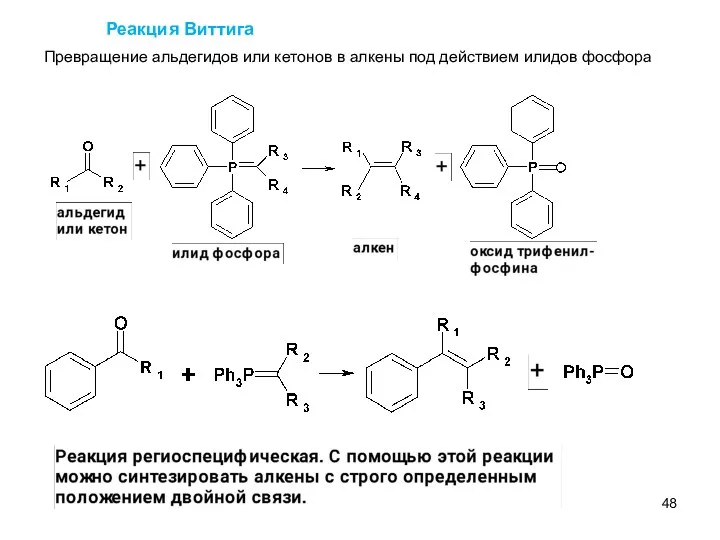
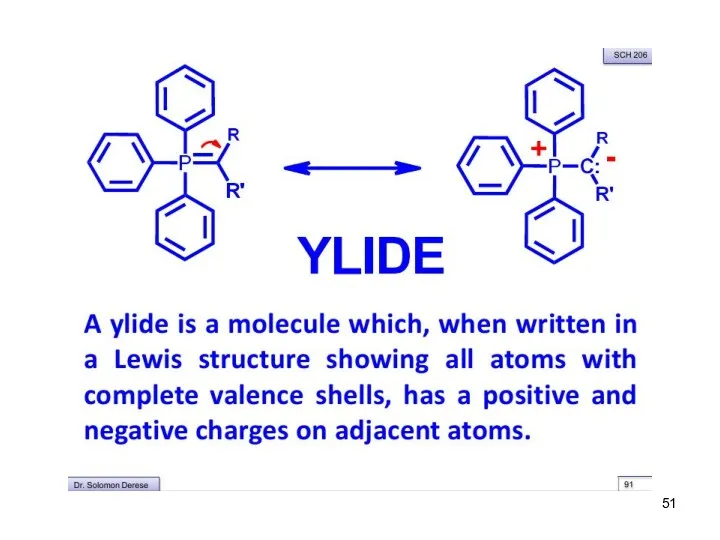
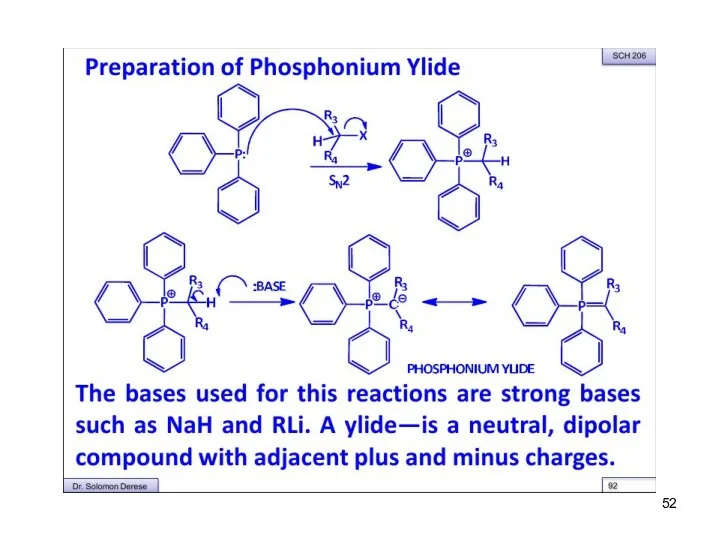
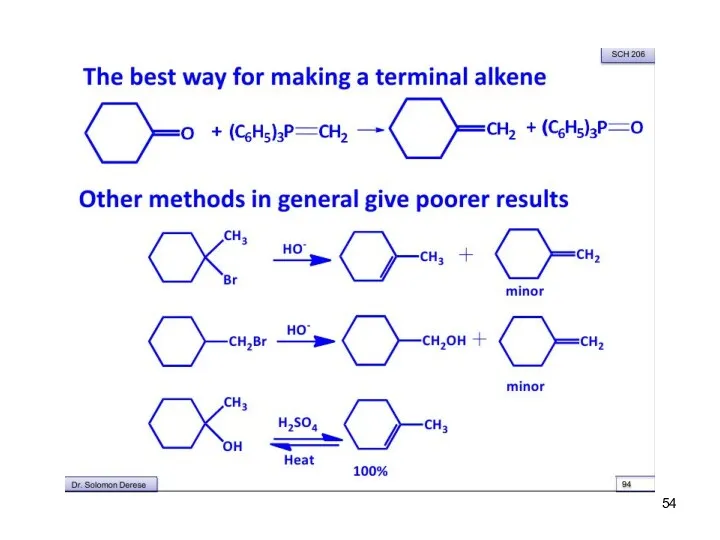
- 48. Реакция Виттига Превращение альдегидов или кетонов в алкены под действием илидов фосфора
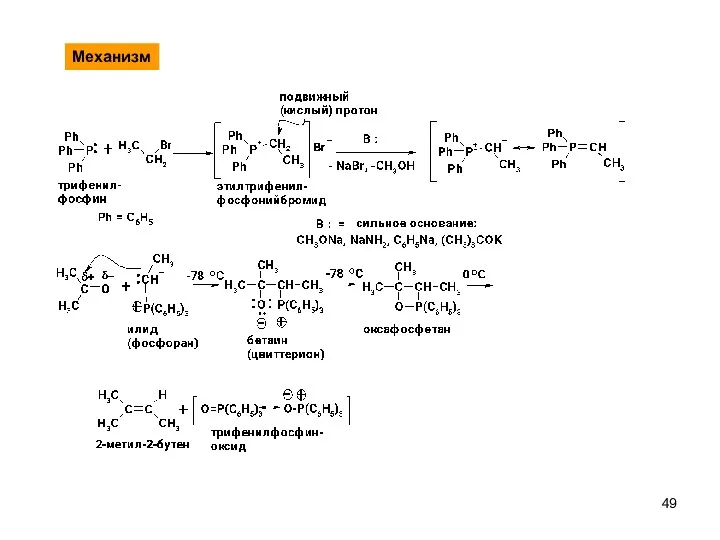
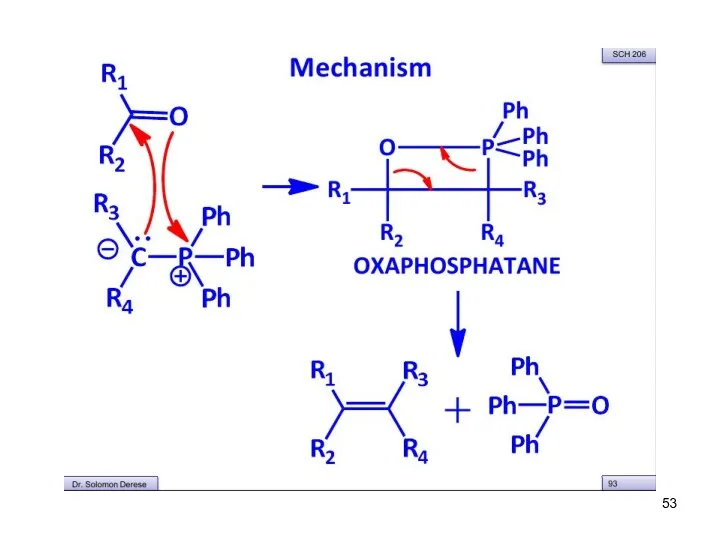
- 49. Механизм
- 50. В.Ф.Травень, Органическая химия.
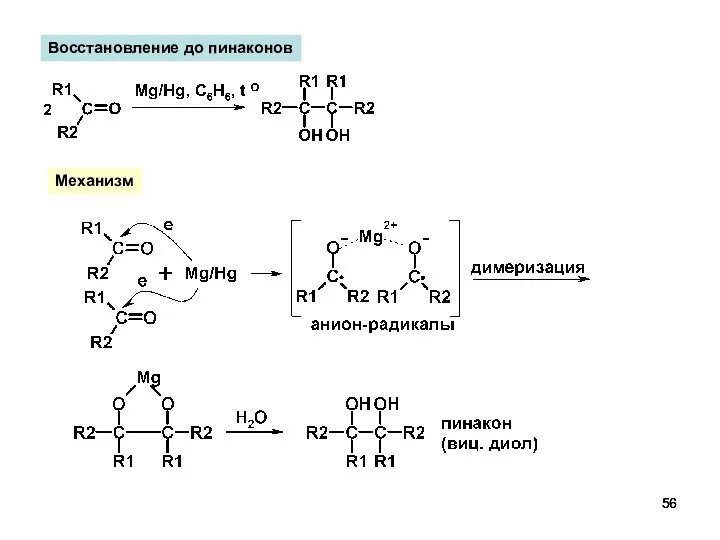
- 56. Восстановление до пинаконов Механизм
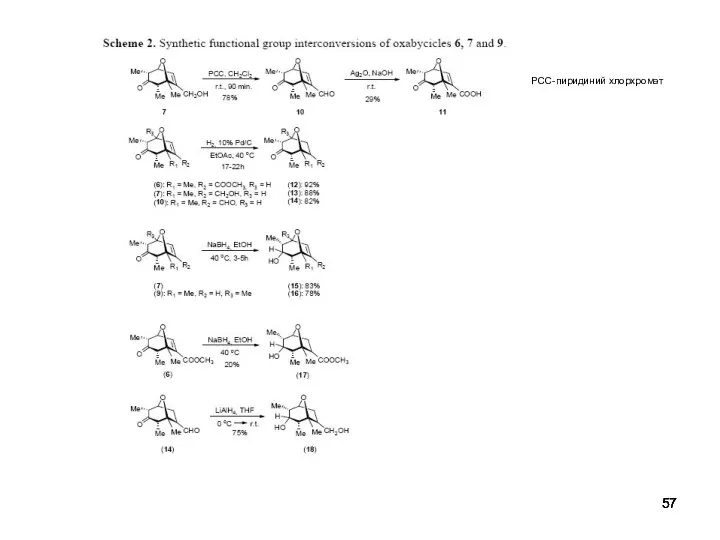
- 57. PCC-пиридиний хлорхромат
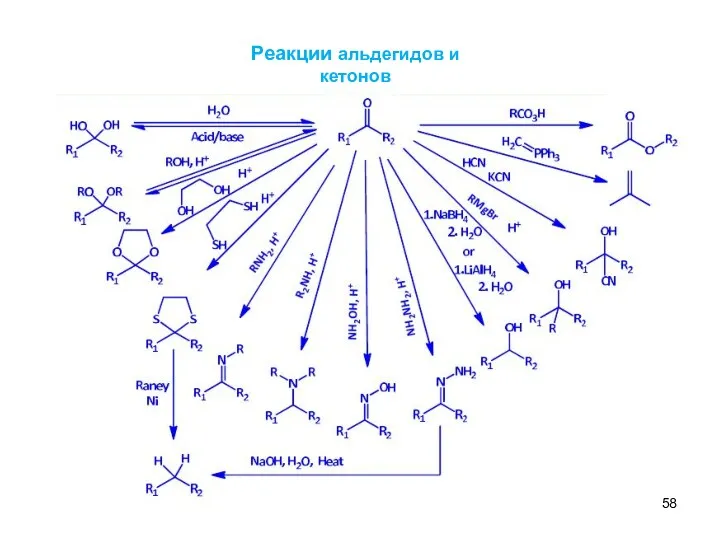
- 58. Реакции альдегидов и кетонов
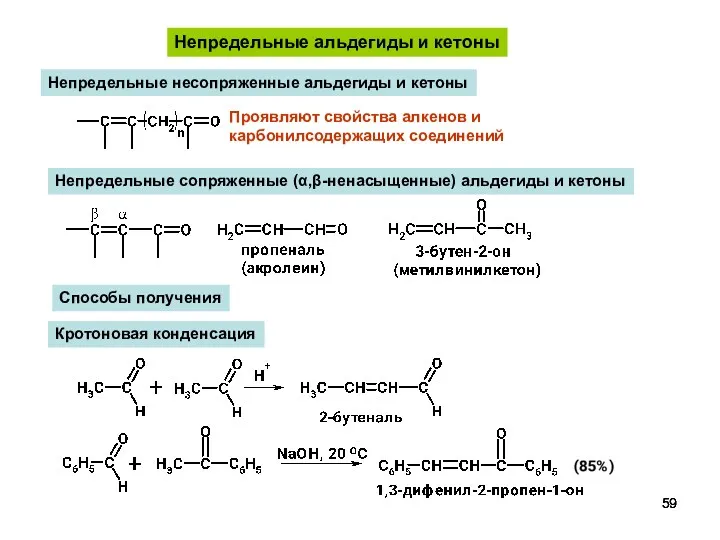
- 59. Непредельные альдегиды и кетоны Непредельные несопряженные альдегиды и кетоны Проявляют свойства алкенов и карбонилсодержащих соединений Непредельные
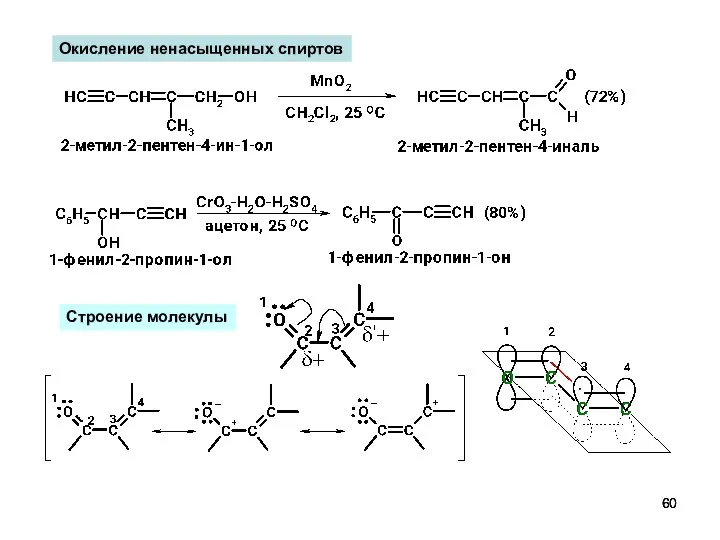
- 60. Окисление ненасыщенных спиртов Строение молекулы
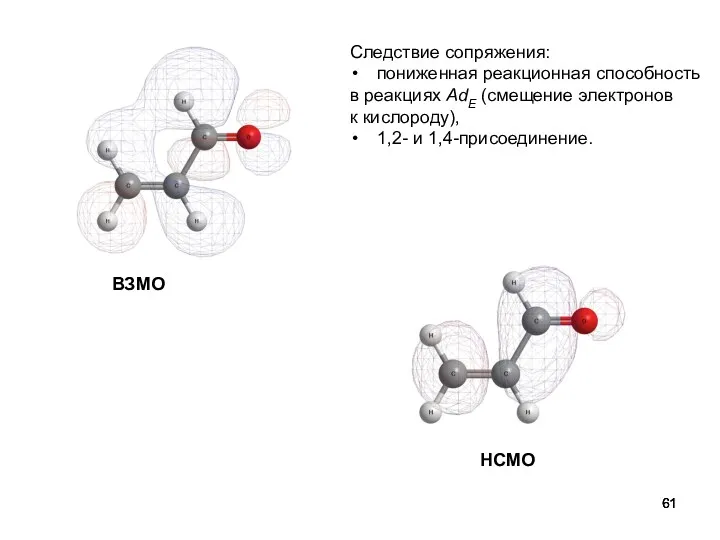
- 61. ВЗМО НСМО Следствие сопряжения: пониженная реакционная способность в реакциях AdE (смещение электронов к кислороду), 1,2- и
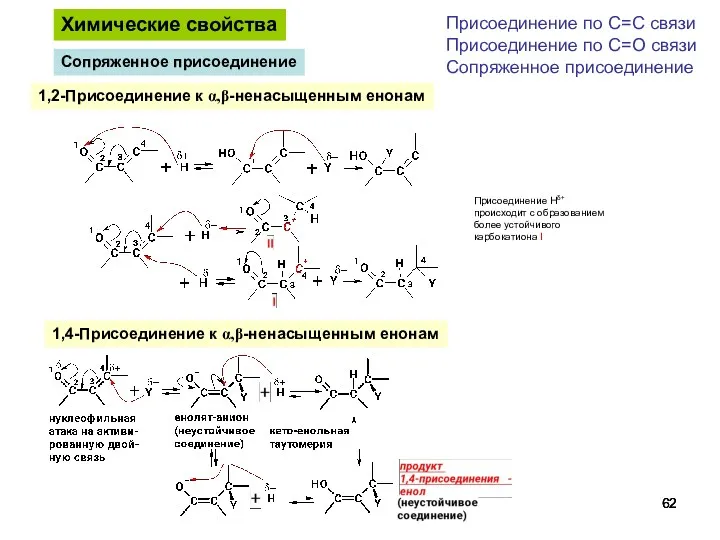
- 62. Химические свойства Присоединение по С=С связи Присоединение по С=О связи Сопряженное присоединение 1,2-Присоединение к α,β-ненасыщенным енонам
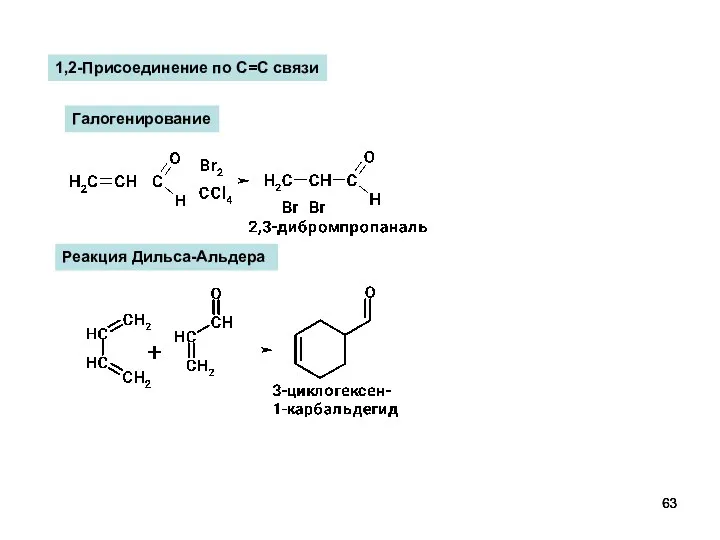
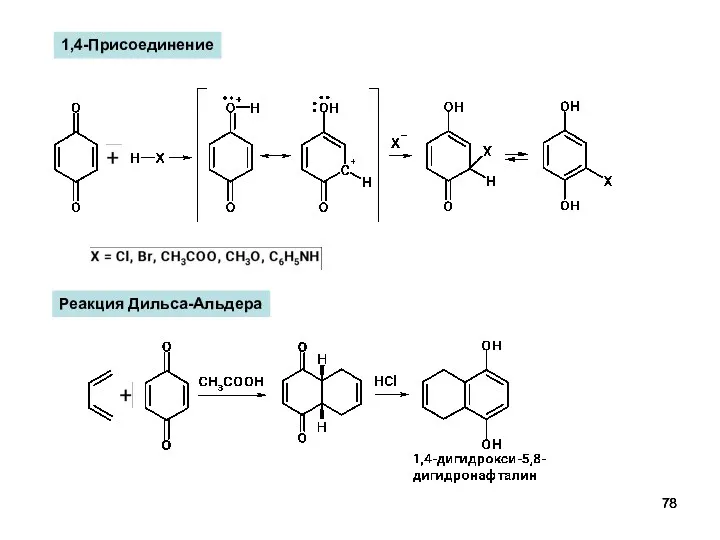
- 63. Реакция Дильса-Альдера Галогенирование 1,2-Присоединение по С=С связи
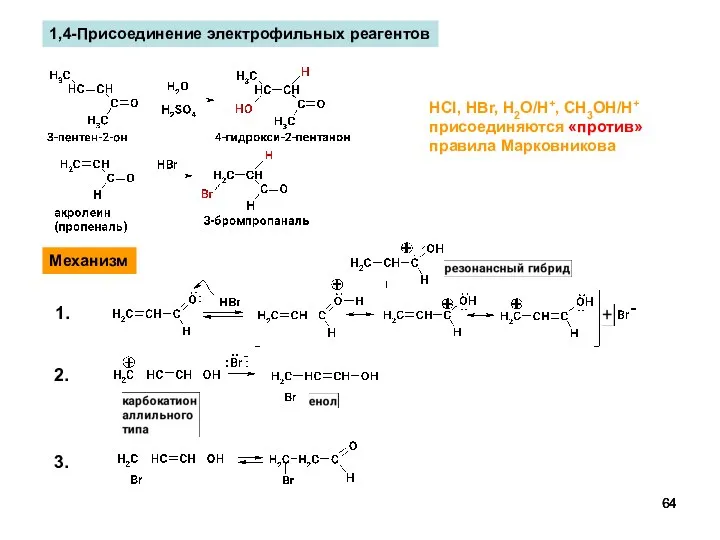
- 64. 1,4-Присоединение электрофильных реагентов HCl, HBr, H2O/H+, CH3OH/H+ присоединяются «против» правила Марковникова Механизм 1. 2. 3.
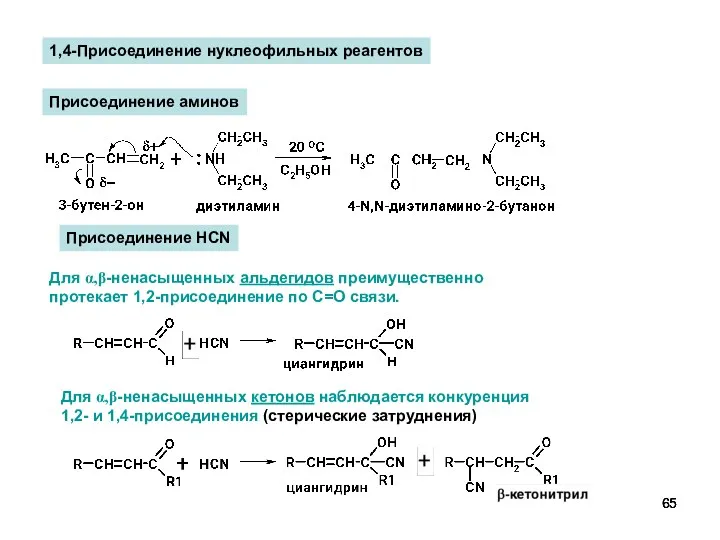
- 65. Присоединение HCN Для α,β-ненасыщенных альдегидов преимущественно протекает 1,2-присоединение по С=О связи. Для α,β-ненасыщенных кетонов наблюдается конкуренция
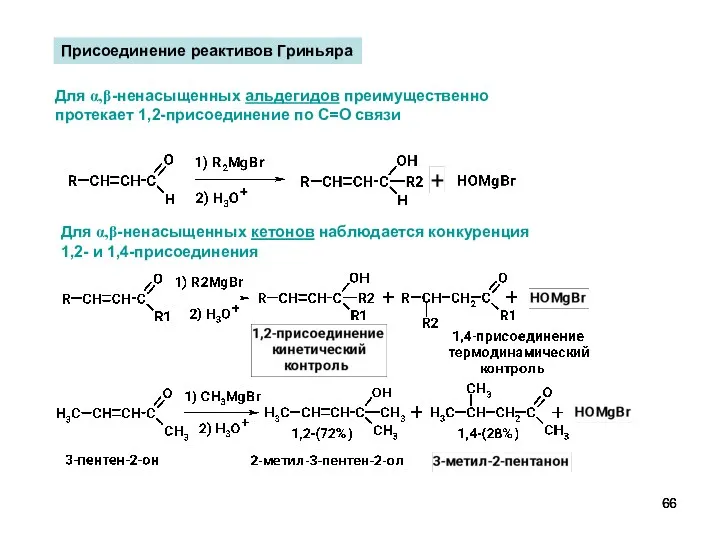
- 66. Для α,β-ненасыщенных кетонов наблюдается конкуренция 1,2- и 1,4-присоединения Присоединение реактивов Гриньяра Для α,β-ненасыщенных альдегидов преимущественно протекает
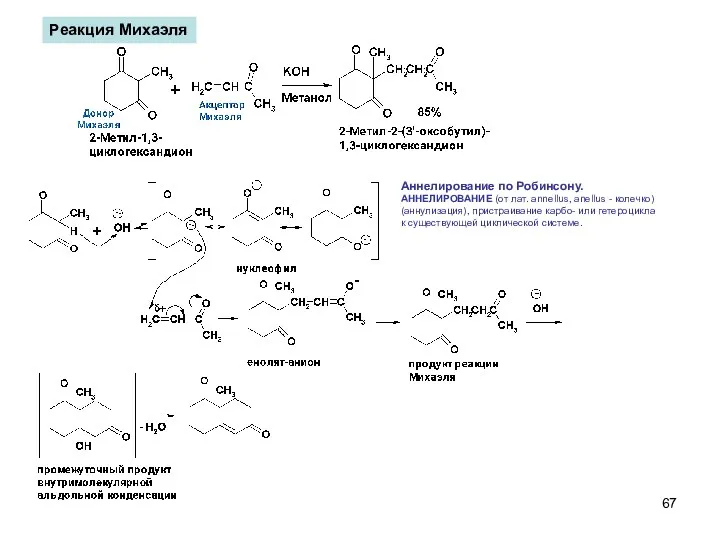
- 67. Реакция Михаэля Аннелирование по Робинсону. АННЕЛИРОВАНИЕ (от лат. annellus, anellus - колечко) (аннулизация), пристраивание карбо- или
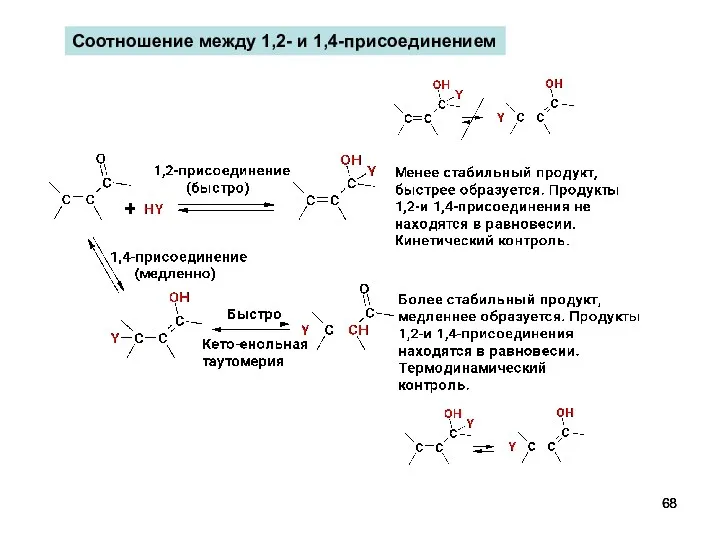
- 68. Соотношение между 1,2- и 1,4-присоединением
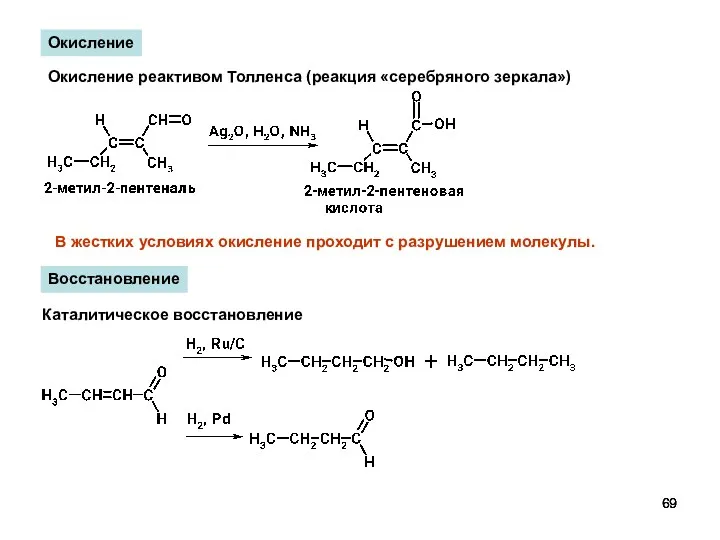
- 69. Окисление Окисление реактивом Толленса (реакция «серебряного зеркала») В жестких условиях окисление проходит с разрушением молекулы. Восстановление
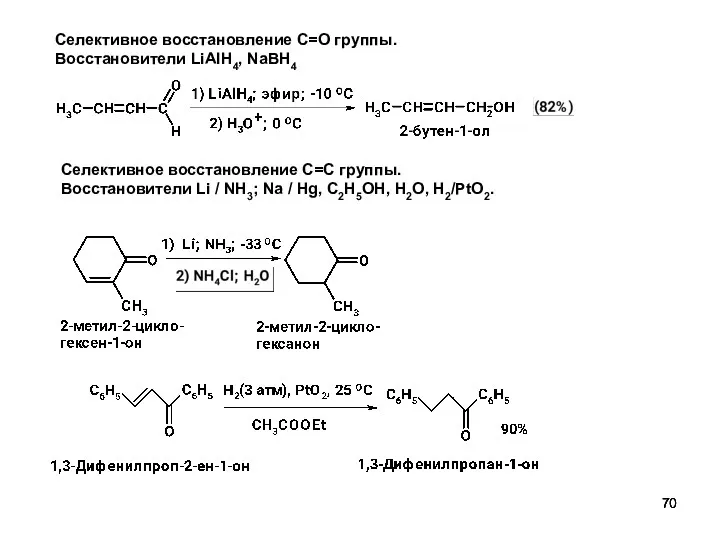
- 70. Селективное восстановление C=O группы. Восстановители LiAlH4, NaBH4 Селективное восстановление C=С группы. Восстановители Li / NH3; Na
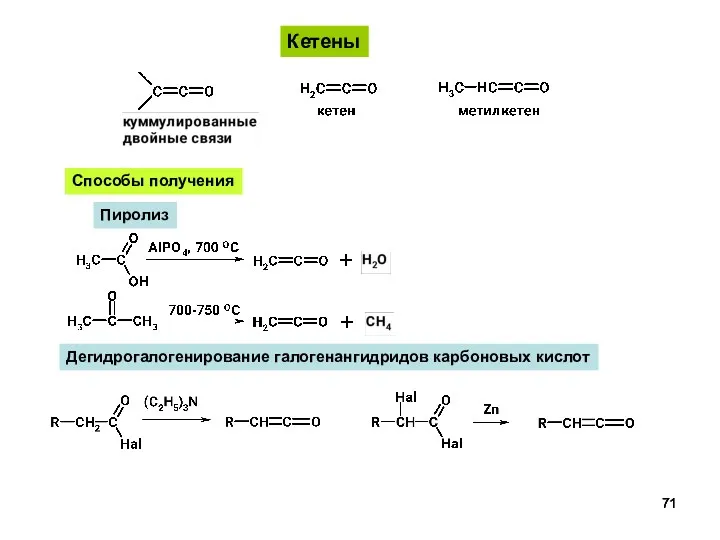
- 71. Кетены Способы получения Пиролиз Дегидрогалогенирование галогенангидридов карбоновых кислот
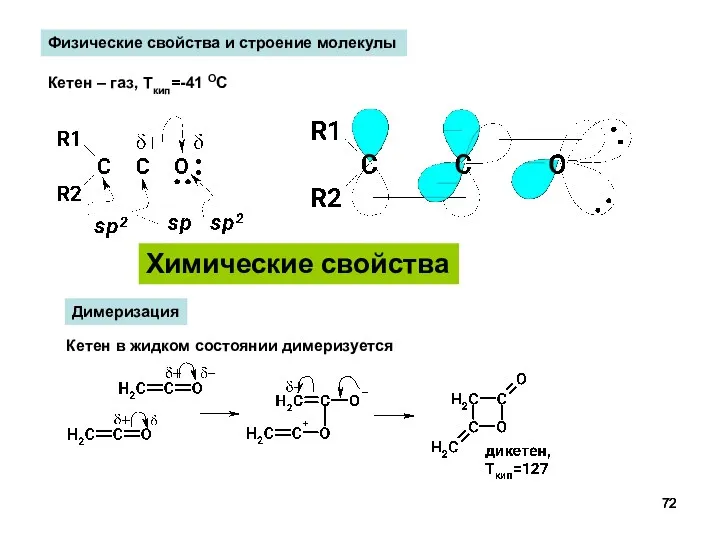
- 72. Химические свойства Физические свойства и строение молекулы Кетен – газ, Ткип=-41 ОС Димеризация Кетен в жидком
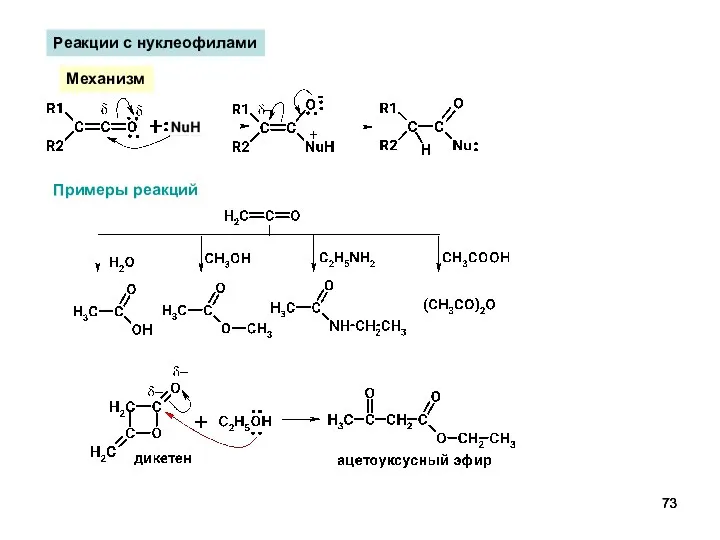
- 73. Реакции с нуклеофилами Механизм Примеры реакций
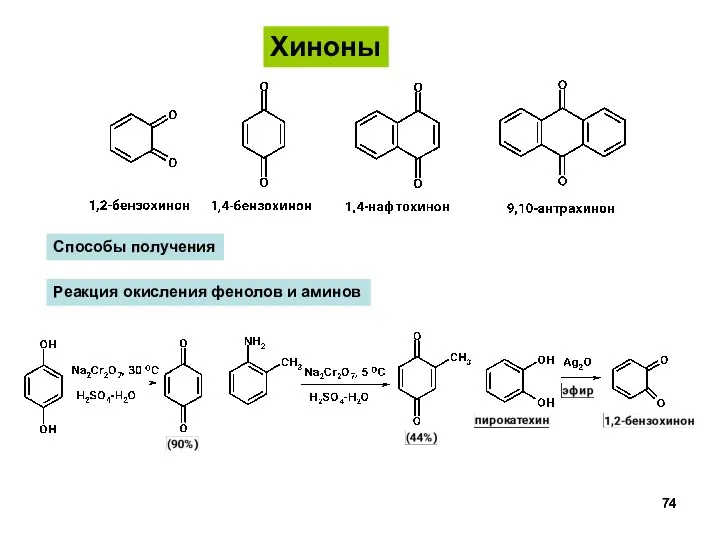
- 74. Хиноны Способы получения Реакция окисления фенолов и аминов
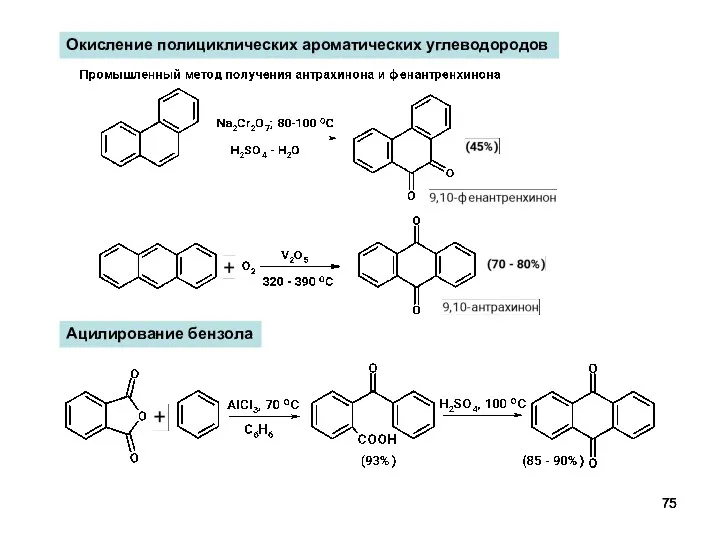
- 75. Окисление полициклических ароматических углеводородов Ацилирование бензола
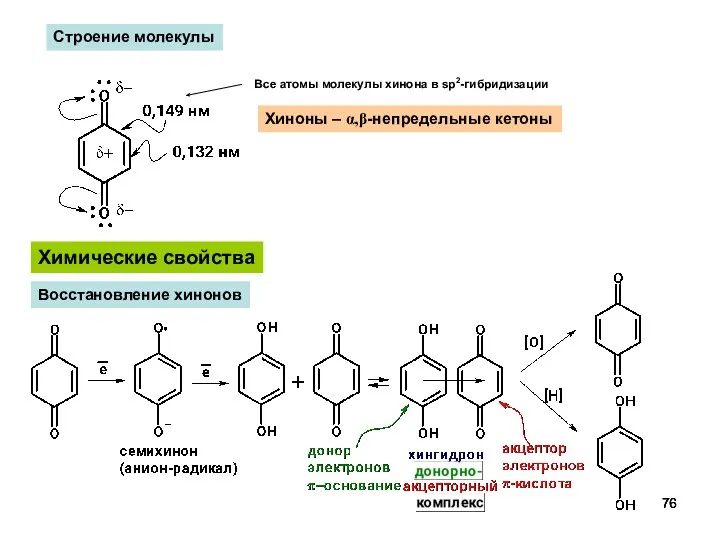
- 76. Химические свойства Восстановление хинонов Хиноны – α,β-непредельные кетоны Строение молекулы Все атомы молекулы хинона в sp2-гибридизации
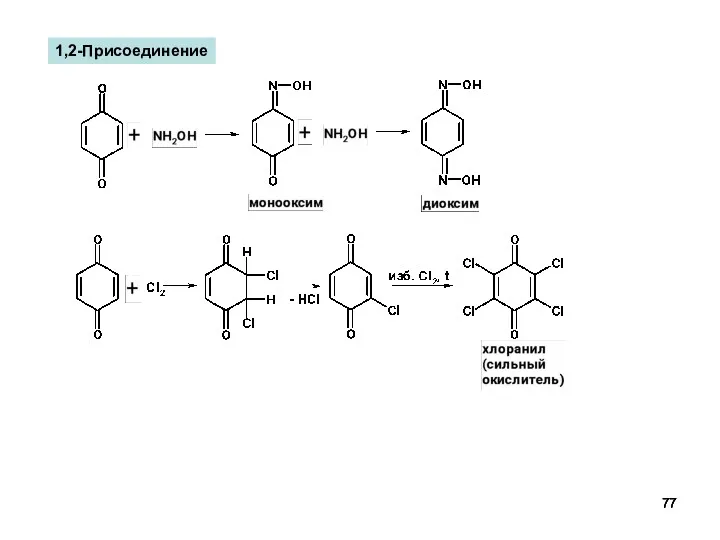
- 77. 1,2-Присоединение
- 78. 1,4-Присоединение Реакция Дильса-Альдера
- 80. Скачать презентацию
![Физические свойства и строение молекулы. Charges C -0.165 [C(1)] C](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379896/slide-11.jpg)
![Присоединение цианид-иона. Образование циангидринов. Механизм AdN2 v=k[CC=O] [CСN-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379896/slide-14.jpg)


![Реакция С.Канницаро (окисление-восстановление) Альдегиды, не имеющие α-C-H-связей, в присутствии щелочи подвергаются реакции диспропорционирования: Механизм v=k[ArCHO]2.[OH- ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379896/slide-45.jpg)


 Минерал турмалин
Минерал турмалин Пластмассы: свойства, требования, перспективы развития. Виды конструкций из пластмасс
Пластмассы: свойства, требования, перспективы развития. Виды конструкций из пластмасс Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты
Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты Искусственные полимеры. 10 класс
Искусственные полимеры. 10 класс Теория химического строения органических соединений
Теория химического строения органических соединений Роль побутової хімії у житті
Роль побутової хімії у житті Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей
Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей альдегиды, свойства, получение
альдегиды, свойства, получение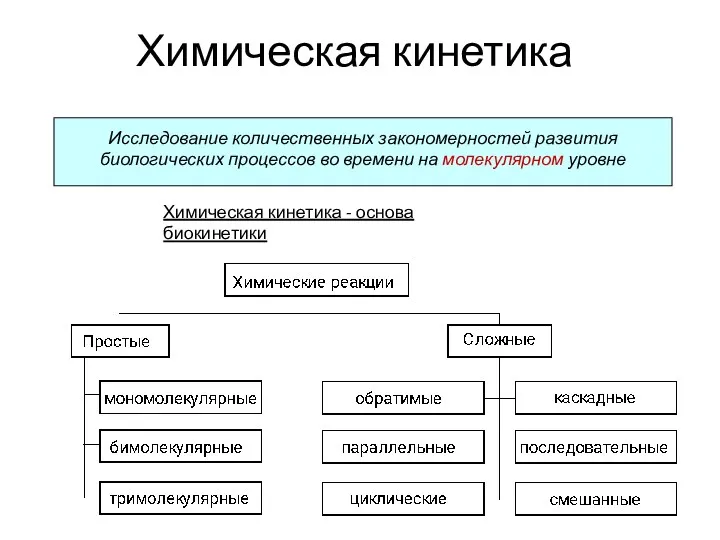 Химическая кинетика
Химическая кинетика Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Химические и физические свойства воды
Химические и физические свойства воды Окислительно-восстановительные реакции. Готовимся к ЕГЭ
Окислительно-восстановительные реакции. Готовимся к ЕГЭ Ферменты в биотехнологии
Ферменты в биотехнологии Губна помада та ії призначення
Губна помада та ії призначення Анализ двойных диаграмм. Лабораторная работа
Анализ двойных диаграмм. Лабораторная работа Общая характеристика металлов
Общая характеристика металлов Азот и его соединения
Азот и его соединения Обобщение по типам химических реакций
Обобщение по типам химических реакций The production of stable isotopes
The production of stable isotopes Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Protein Chemistry
Protein Chemistry Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)