Содержание
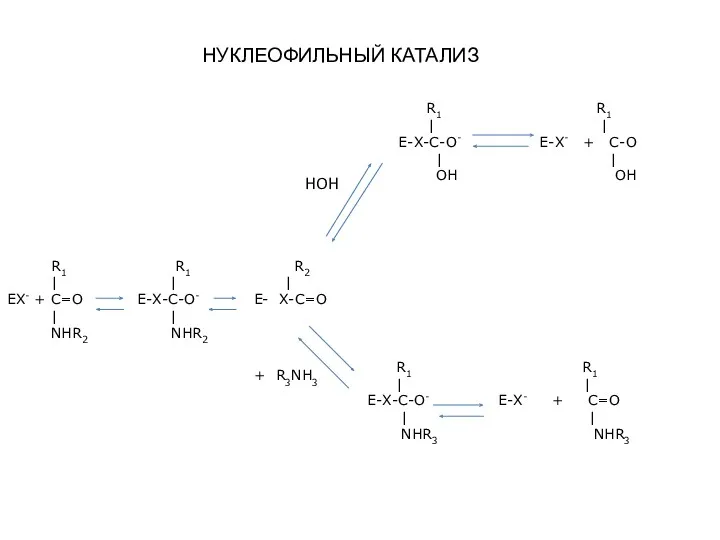
- 2. R1 R1 R2 | | | EX- + C=O E-X-C-O- E- X-C=O | | NHR2 NHR2
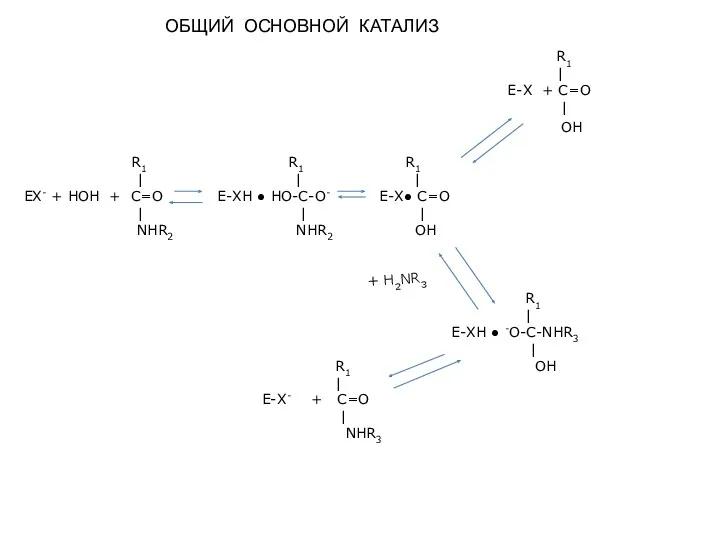
- 3. ОБЩИЙ ОСНОВНОЙ КАТАЛИЗ R1 R1 R1 | | | EX- + НОН + C=O E-XН ●
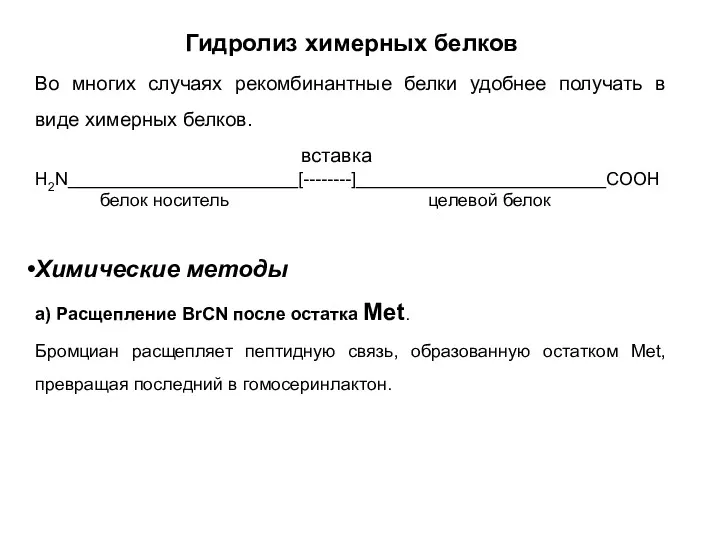
- 4. Гидролиз химерных белков Во многих случаях рекомбинантные белки удобнее получать в виде химерных белков. вставка H2N_______________________[--------]_________________________COOH
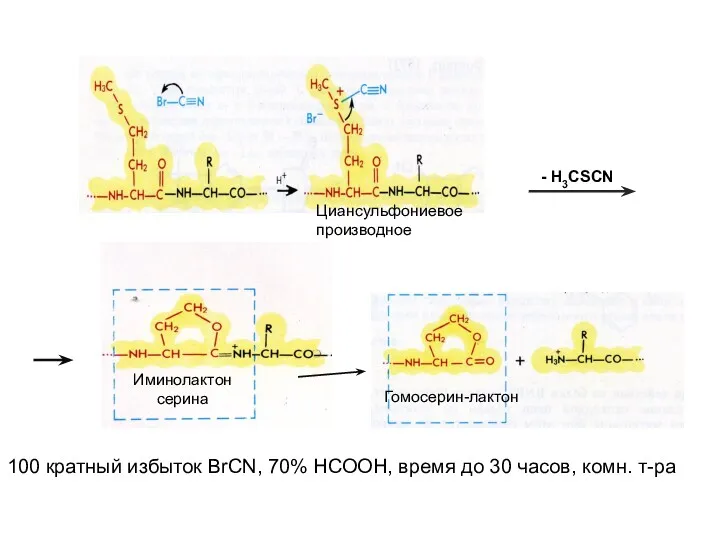
- 5. Циансульфониевое производное - H3CSCN Иминолактон серина Гомосерин-лактон 100 кратный избыток BrCN, 70% НСООН, время до 30
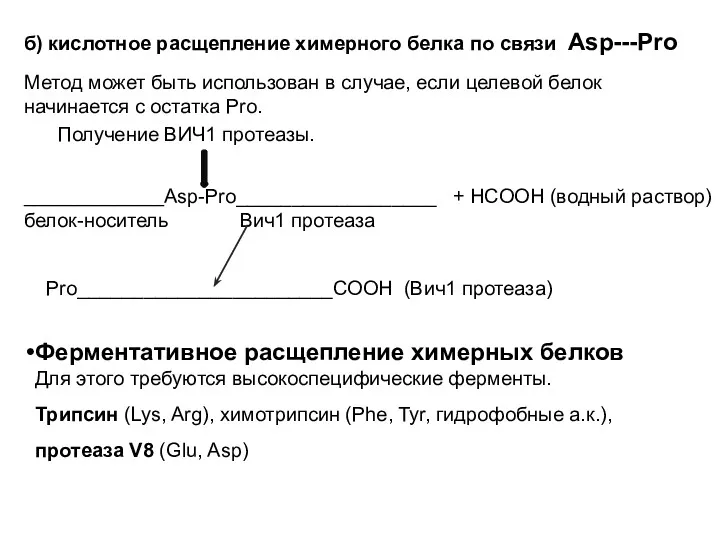
- 6. б) кислотное расщепление химерного белка по связи Asp---Pro Метод может быть использован в случае, если целевой
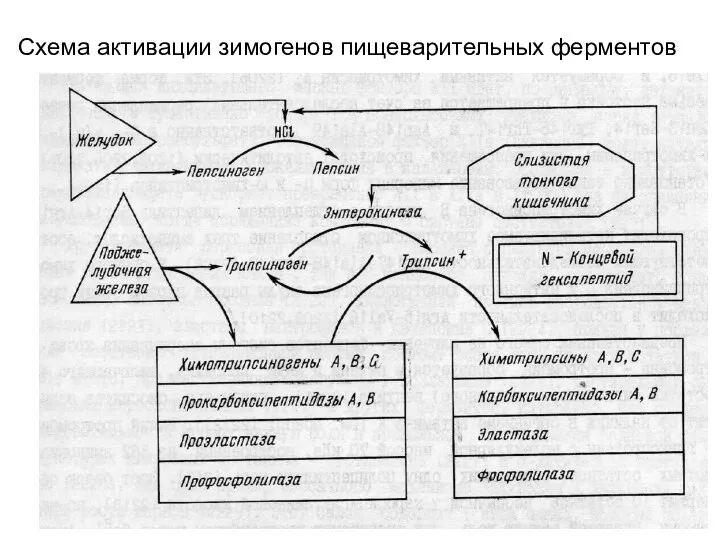
- 7. Схема активации зимогенов пищеварительных ферментов
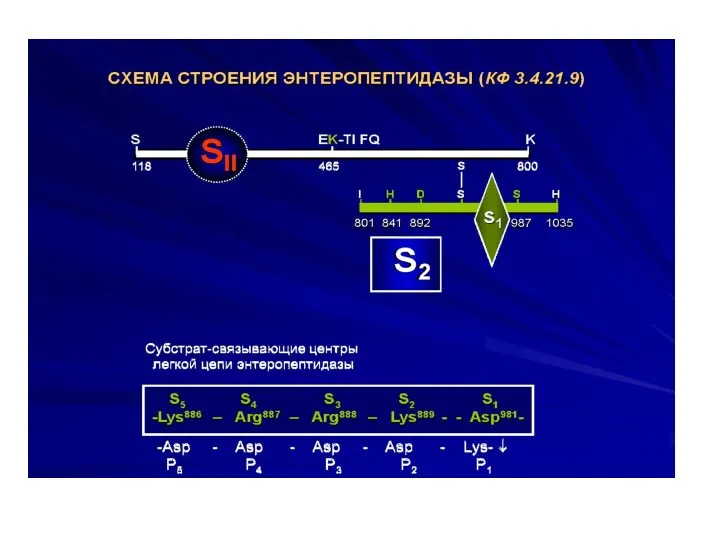
- 8. а) энтеропептидаза Выделяется из слизистой тонкого кишечника. Ее роль – активация каскада пищеварительных ферментов (зимогенов).
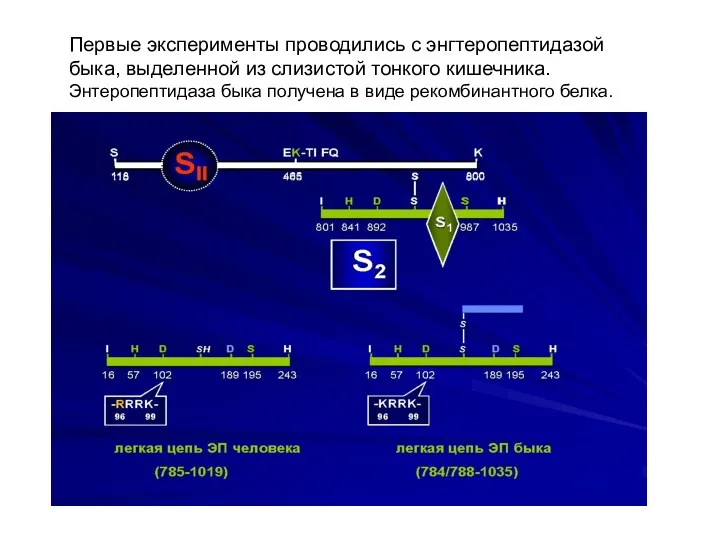
- 10. Первые эксперименты проводились с энгтеропептидазой быка, выделенной из слизистой тонкого кишечника. Энтеропептидаза быка получена в виде
- 11. Легкая цепь используется для гидролиза химерных белков. H2N_________________COOH целевой белок б) тромбин Расщепляет пептидные связи в
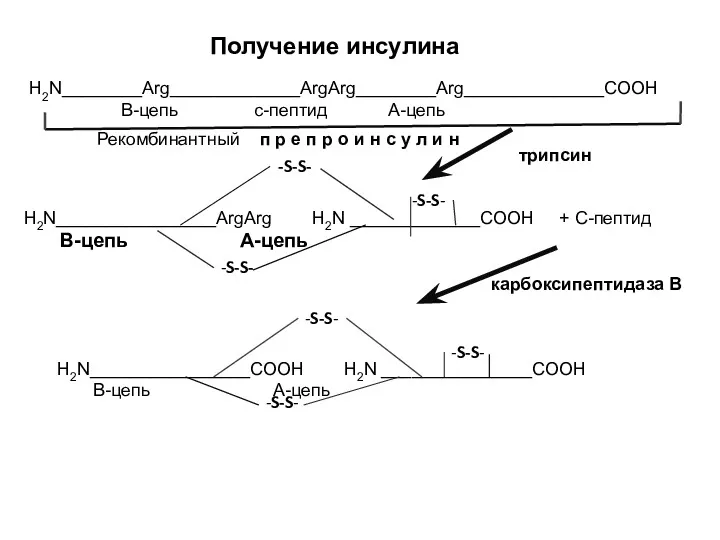
- 12. Получение инсулина H2N________Arg_____________ArgArg________Arg______________COOH В-цепь с-пептид А-цепь H2N________________ArgArg H2N _____________COOH + С-пептид В-цепь А-цепь H2N________________СООН H2N _______________COOH
- 13. ПОЛУЧЕНИЕ АМИДОВ ПЕПТИДОВ Многие биологически активные пептиды являются амидами по С-концевой карбоксильной группе. Tyr-D-Ala-Phe-Gly-Tyr-Pro-Ser-NH2 - дерморфин
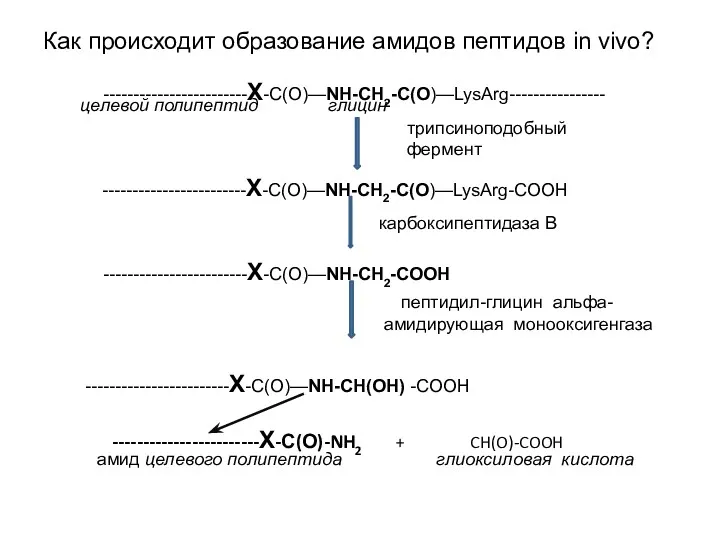
- 14. Как происходит образование амидов пептидов in vivo? ------------------------Х-С(О)—NH-CH2-C(O)—LysArg---------------- целевой полипептид глицин трипсиноподобный фермент ------------------------Х-С(О)—NH-CH2-C(O)—LysArg-СOOH карбоксипептидаза В
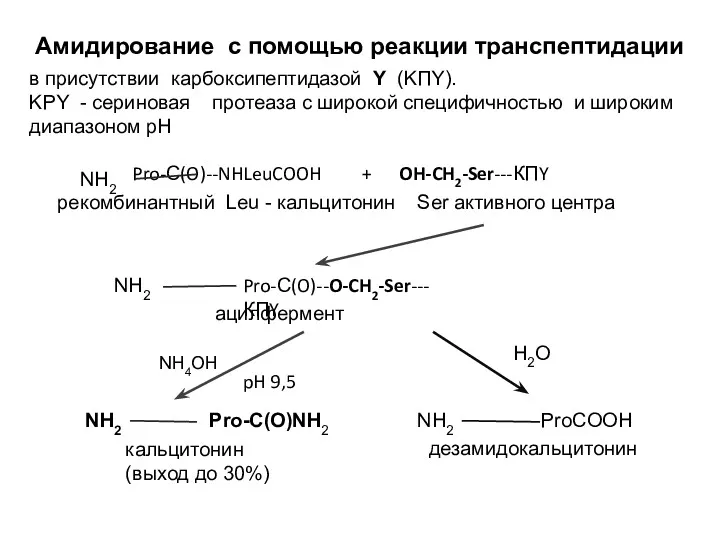
- 15. Амидирование с помощью реакции транспептидации в присутствии карбоксипептидазой Y (KПY). KPY - сериновая протеаза с широкой
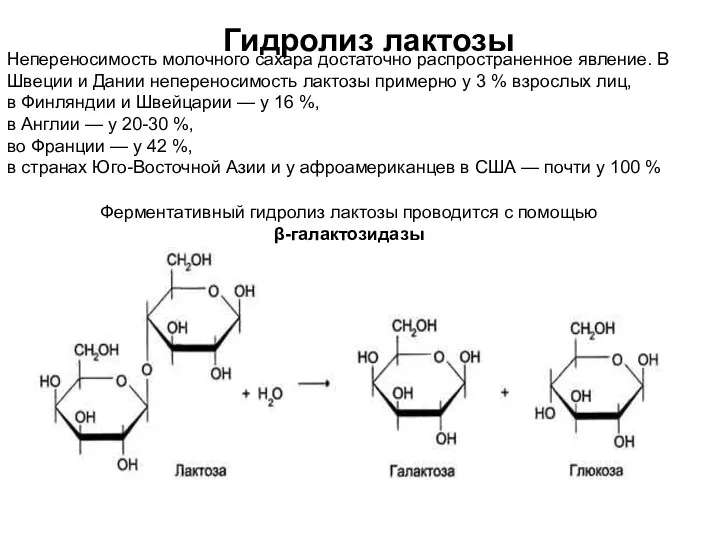
- 16. Гидролиз лактозы Непереносимость молочного сахара достаточно распространенное явление. В Швеции и Дании непереносимость лактозы примерно у
- 17. МОЛОКОСВЕРТЫВАЮЩИЕ ФЕРМЕНТЫ ХИМОЗИН (реннин, сычужный фермент), фермент класса гидролаз, катализирующий гидролиз пептидных связей по остаткам гидрофобных
- 18. казеин КАЗЕИН (от лат. caseus - сыр), основная. белковая фракция молока; относится к запасным белкам. Представляет
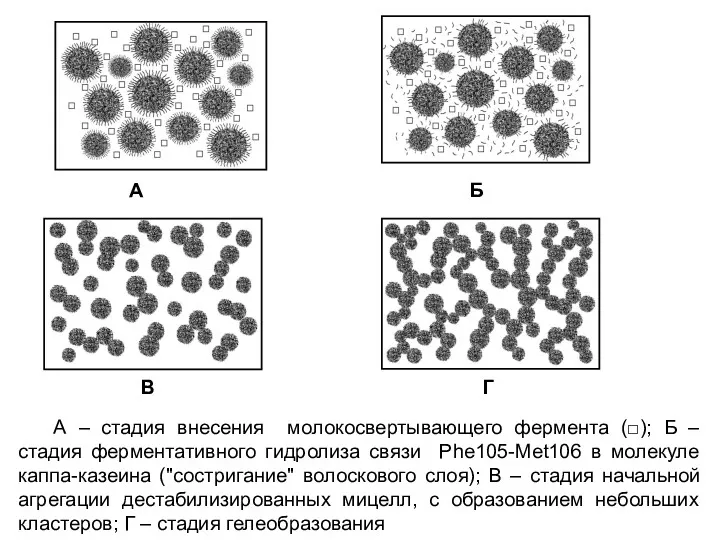
- 19. А Б В Г А – стадия внесения молокосвертывающего фермента (□); Б – стадия ферментативного гидролиза
- 20. Ферменты в пептидном синтезе R1-COOH + NH2R2 R1CO—NHR2 H2O равновесие реакции сдвинуто в сторону гидролиза Как
- 21. Малярия вызывается простейшими паразитами рода Plasmodium (80—90 % случаев — Plasmodium falciparum). Ингибиторы ферментов – лекарственные
- 22. Ингибирование плазмепсина II (pH 4.4) и катепсина D человека (pH 3.5) при гидролизе субстрата CS; [S]
- 23. На сегодняшний день менингиты являются частой патологией в структуре нейроинфекций, причем бактериальные менингиты являются наиболее распространенными
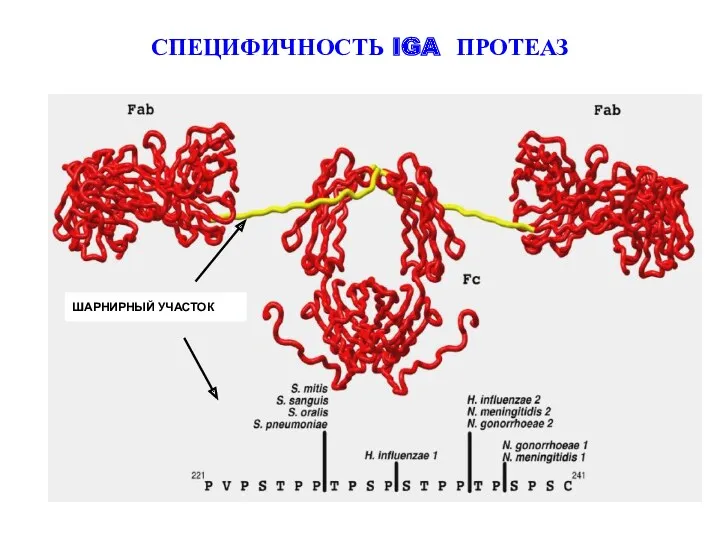
- 24. СПЕЦИФИЧНОСТЬ IGA ПРОТЕАЗ ШАРНИРНЫЙ УЧАСТОК
- 25. IgA1 протеазы способствуют колонизации бактериями слизистой оболочки и проникновению их во внутреннюю среду организма вследствие расщепления
- 27. Скачать презентацию










 Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Атомы и молекулы. Простые и сложные вещества (8 класс)
Атомы и молекулы. Простые и сложные вещества (8 класс) Углерод. Элемент IV группы
Углерод. Элемент IV группы Оксиды
Оксиды Алены. Строение, изомерия, номенклатура
Алены. Строение, изомерия, номенклатура ПРОСТЫЕ ВЕЩЕСТВА -НЕМЕТАЛЛЫ
ПРОСТЫЕ ВЕЩЕСТВА -НЕМЕТАЛЛЫ Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Трифенилметановые красители
Трифенилметановые красители Оксиды. 8 класс
Оксиды. 8 класс AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Галогены
Галогены Методы восстановления и окисления
Методы восстановления и окисления Современные представления о катализе. Общие закономерности гетерогенного катализа
Современные представления о катализе. Общие закономерности гетерогенного катализа Железо и его сплавы
Железо и его сплавы КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Влияние моющих средств на организм человека
Влияние моющих средств на организм человека Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Физические методы стабилизации масел
Физические методы стабилизации масел Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие р-элементы V группы (пниктогены) N, P, As, Sb, Bi
р-элементы V группы (пниктогены) N, P, As, Sb, Bi Аналитическая химия
Аналитическая химия Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Трансмиссионные масла
Трансмиссионные масла Простые вещества
Простые вещества