Содержание
- 2. ОКСИДЫ - сложные вещества, состоящие из 2-х химических элементов, один из которых кислород со степенью окисления
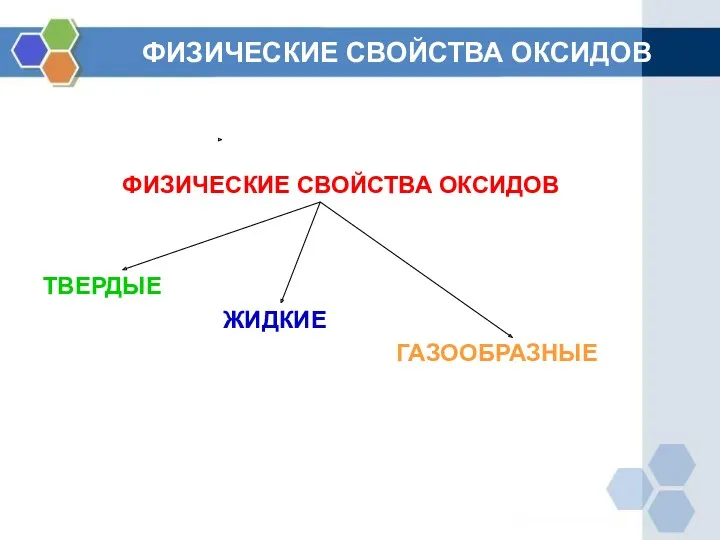
- 3. ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ТВЕРДЫЕ ЖИДКИЕ ГАЗООБРАЗНЫЕ
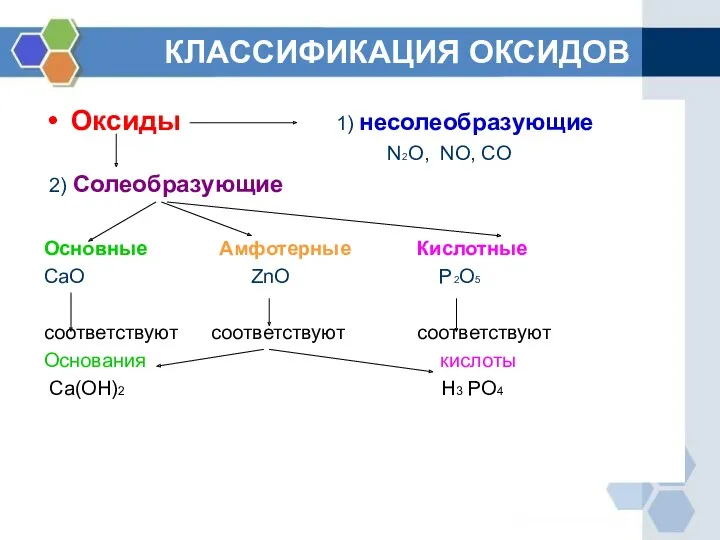
- 5. КЛАССИФИКАЦИЯ ОКСИДОВ Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5
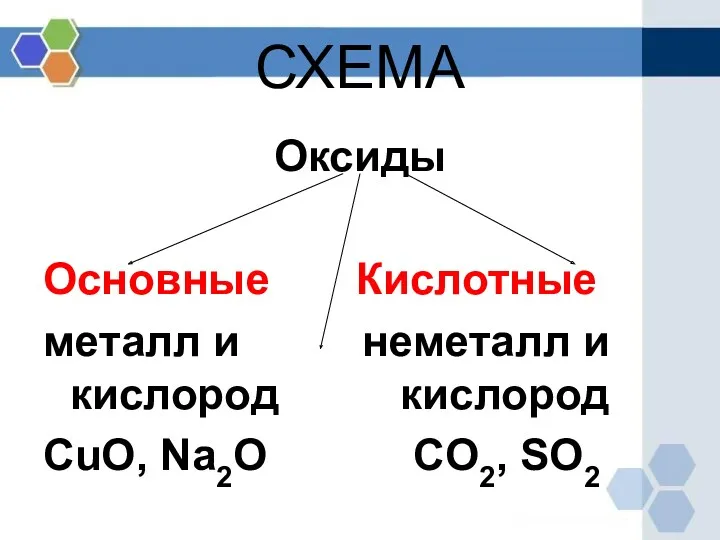
- 6. СХЕМА Оксиды Основные Кислотные металл и неметалл и кислород кислород CuO, Na2O CO2, SO2
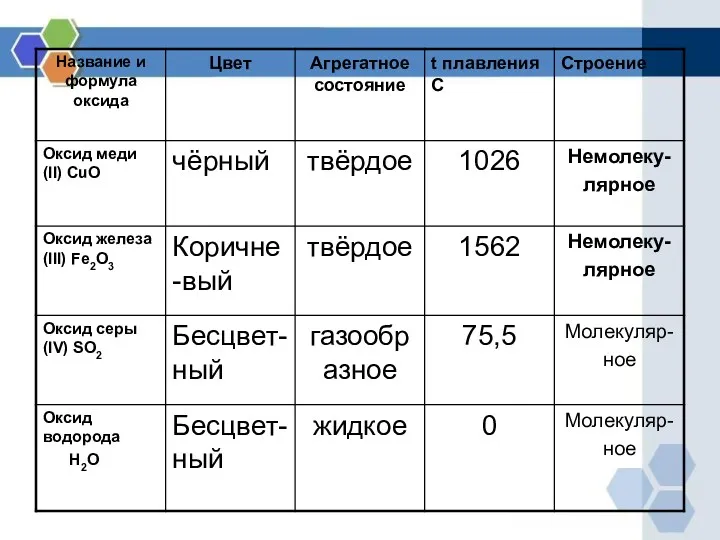
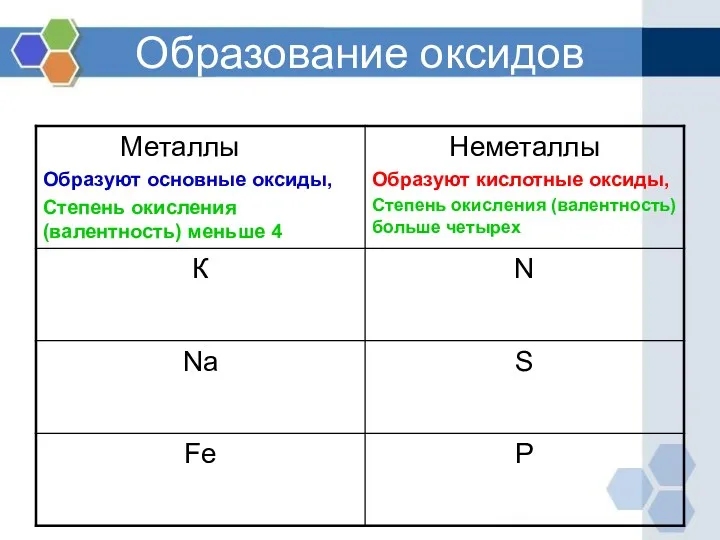
- 7. Образование оксидов
- 8. ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ Основными называются оксиды, которым соответствуют основания. Кислотными называются оксиды, которым соответствуют кислоты. Амфотерными
- 9. ФОРМУЛЫ ОКСИДОВ 1)Оксид серы(IV) 2)Оксид азота(V) 3)Оксид калия (I)- основной оксид 4)Оксид железа(II) – основной оксид
- 10. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода CaO + H2 SO4
- 11. Химические свойства кислотных оксидов (К.О.) 1) К.О. + основание = соль + вода SO3 + NaOH
- 12. Получение оксидов: Горение простых веществ Горение сложных веществ Разложение нерастворимых оснований Разложение солей
- 13. Составьте уравнения реакций, с помощью которых можно получить следующие оксиды: CO2 , Al2O3 , Li2 O
- 14. Выпишите только формулы кислотных, основных, амфотерных оксидов K2CO3 ; Li2O ; H2S ; Cr2 O3 ;
- 15. Напишите уравнения возможных реакций: а) оксид натрия + вода = б) оксид лития + серная кислота
- 17. Скачать презентацию









 Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева Силикатное производство
Силикатное производство Кислород и его применение
Кислород и его применение Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары Относительная атомная масса химических элементов. Знаки химических элементов
Относительная атомная масса химических элементов. Знаки химических элементов Типы химических реакций
Типы химических реакций Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Чистые вещества и смеси
Чистые вещества и смеси Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Алюминий и его соединения
Алюминий и его соединения Электрохимические процессы
Электрохимические процессы Мартенситное превращение
Мартенситное превращение Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс Основания. Названия оснований
Основания. Названия оснований Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Чистые вещества и смеси
Чистые вещества и смеси Связующие для полимерных композиционных материалов. (Тема 2)
Связующие для полимерных композиционных материалов. (Тема 2) Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Кислоты. Определение и классификация
Кислоты. Определение и классификация Оценка химической обстановки при авариях на химически опасных объектах. Расчет
Оценка химической обстановки при авариях на химически опасных объектах. Расчет Теория сплавов
Теория сплавов Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Biomass Feedstocks
Biomass Feedstocks Алотропні форми Карбону
Алотропні форми Карбону Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність