Содержание
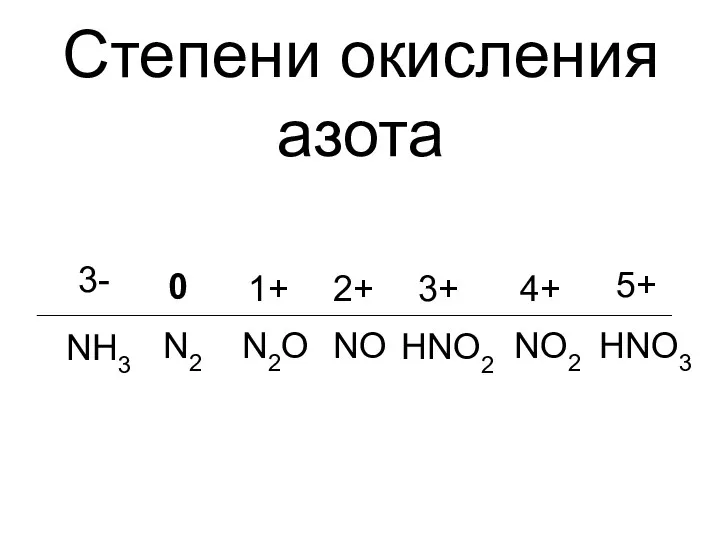
- 2. N 2e 5e – – Азот может принимать степени окисления: –3, +1, +2, +3, +4, +5
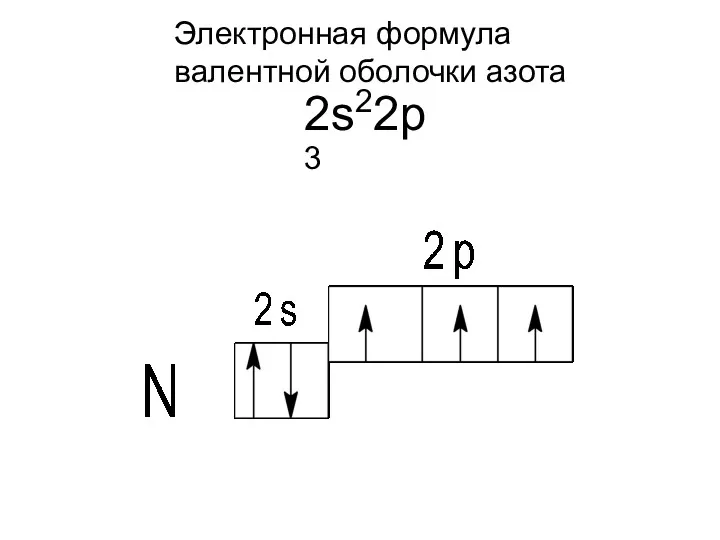
- 3. Электронная формула валентной оболочки азота 2s22p3
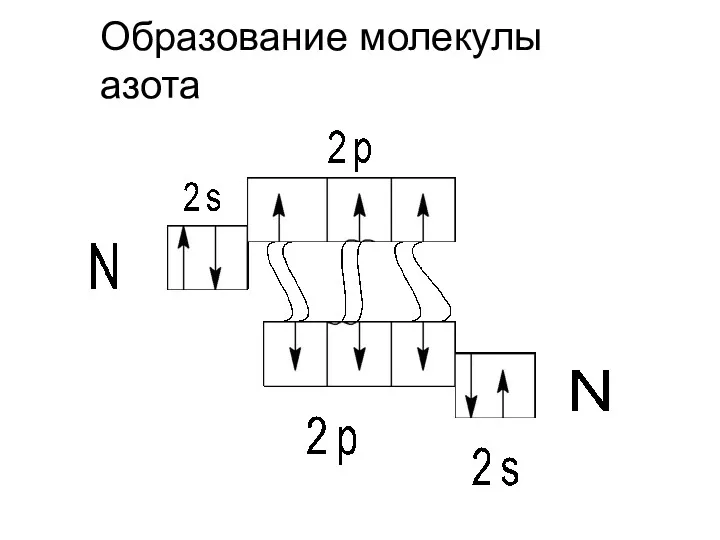
- 4. Образование молекулы азота
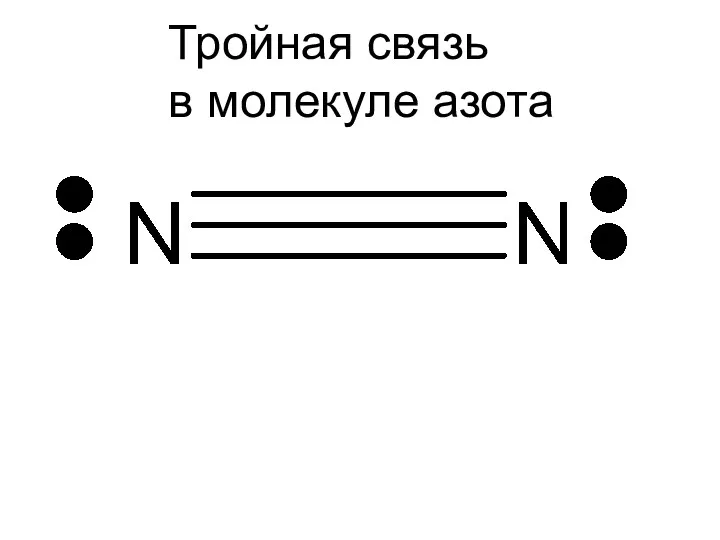
- 5. Тройная связь в молекуле азота
- 6. Азот David.Monniaux N N N2 Физические свойства Азот – газ без цвета, запаха и вкуса, немного
- 7. Д. Резерфорд 1749–1819 гг. К. Шееле 1742–1786гг. Впервые газ, который не поддерживает дыхание и горение, получили
- 8. А. Лавуазье 1778–1825 гг. В 1787 году этот же газ обнаружил в воздухе А. Лавуазье, который
- 9. Степени окисления азота 0 N2 1+ N2O 3+ NO 2+ HNO3 4+ 5+ HNO2 NO2 3-
- 10. Чилийская селитра (NaNO3)
- 11. Химические свойства При взаимодействии с металлами и водородом азот является окислителем. 6Li + N2 = 2Li3N
- 12. Азот взаимодействует с водородом при высоких температурах, наличии катализатора и высоком давлении с образованием аммиака. Азот
- 13. N2 + O2 = 2NO – Q При взаимодействии с кислородом азот является восстановителем.
- 14. В природе азот содержится в основном в атмосфере — 78% по объёму или 75,5% по массе.
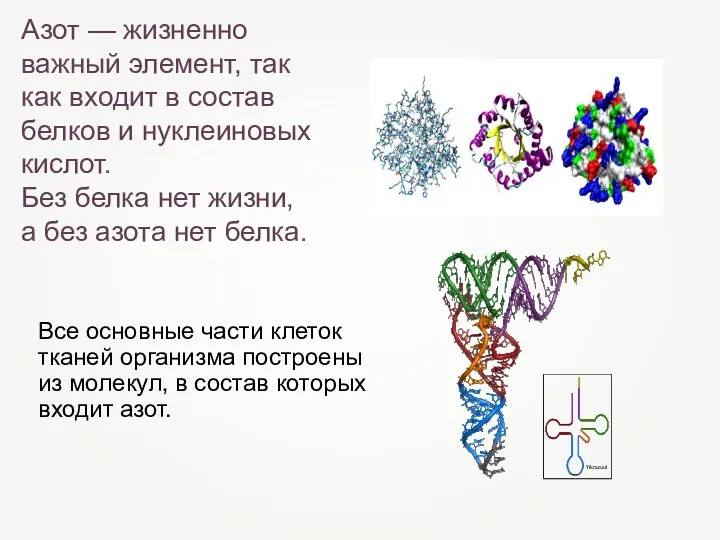
- 15. Азот — жизненно важный элемент, так как входит в состав белков и нуклеиновых кислот. Без белка
- 16. Организм животного содержит 1–10% азота от общей массы тела, больше всего азота содержится в шерсти, волосах,
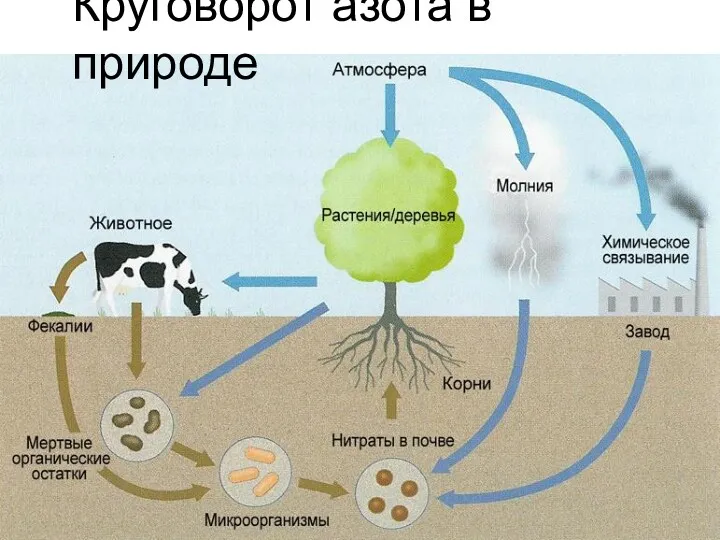
- 17. Круговорот азота в природе
- 18. В производстве азот получают из воздуха, переведённого в жидкое состояние.
- 19. Получение азота В лабораториях его можно получать 1. По реакции разложения нитрита аммония: NH4NO2 → N2↑
- 20. Применение азота Производство аммиака и производство азотной кислоты Холодильные установки, производство удобрений, в медицине, в быту
- 21. Аммиак Физические свойства Аммиа́к — NH3, нитрид водорода — бесцветный газ с резким характерным запахом (запах
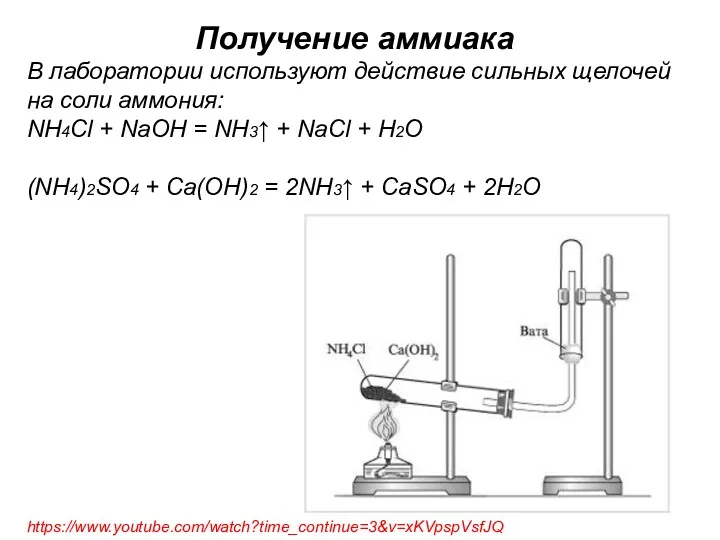
- 22. Получение аммиака В лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑
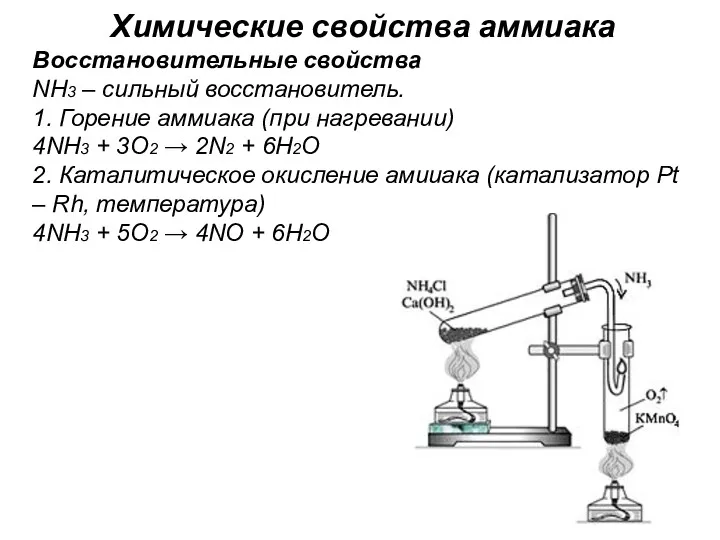
- 23. Химические свойства аммиака Восстановительные свойства NH3 – сильный восстановитель. 1. Горение аммиака (при нагревании) 4NH3 +
- 24. Взаимодействие с водой и кислотами NH3 + Н2О ↔ NН4 ОН NH3 + HCl = NH4Cl
- 25. Соли аммония 1. Вступают в обменную реакцию с кислотами и солями: (NH4)2SO4 + Ba(NO3)2 → BaSO4
- 26. Азотная кислота
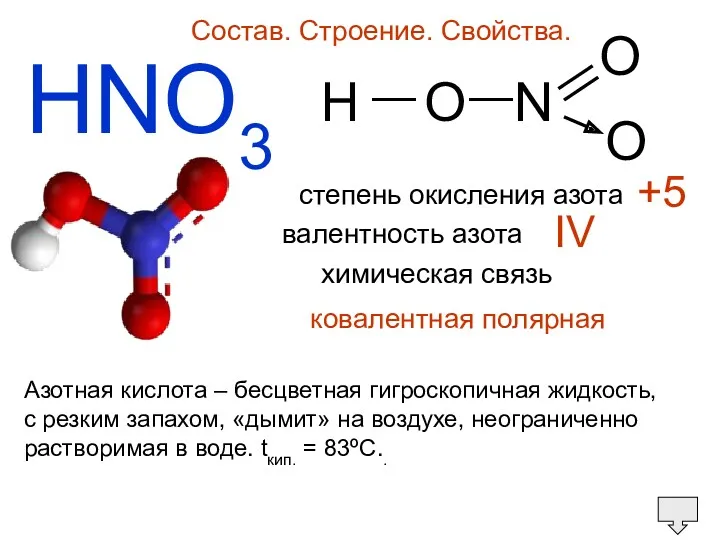
- 27. HNO3 Состав. Строение. Свойства. H O N O O — — степень окисления азота валентность азота
- 28. Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
- 29. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет: 4HNO3
- 30. Химические свойства азотной кислоты Азотная кислота проявляет все типичные свойства кислот. Кислоты взаимодействуют с основными и
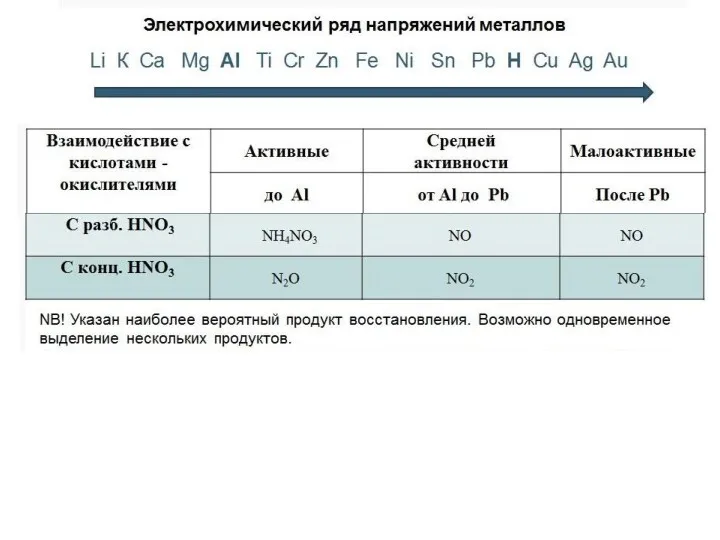
- 31. Особенности взаимодействия азотной кислоты с металлами: 1. Водород не выделяется. . Выделяются разнообразные соединения азота: N+4O2,
- 33. Применение азотной кислоты 1 5 4 6 2 3 Производство азотных и комплексных удобрений. Производство взрывчатых
- 34. Соли азотной кислоты Как называются соли азотной кислоты? нитраты Нитраты K, Na, NH4+ называют селитрами Составьте
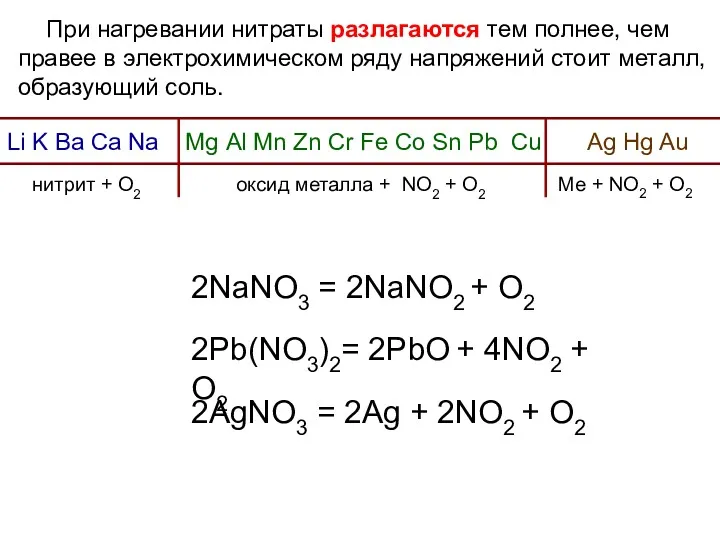
- 35. При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль.
- 36. Нитрат калия (калиевая селитра) Бесцветные кристаллы Значительно менее гигроскопична по сравнению с натриевой, поэтому широко применя-ется
- 37. Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение
- 38. СПАСИБО ЗА ВНИМАНИЕ!
- 40. Скачать презентацию


























 топ през
топ през Благородные металлы
Благородные металлы Полимеры, бумага
Полимеры, бумага Анализ раствора кальция хлорида 5%-200 мл
Анализ раствора кальция хлорида 5%-200 мл Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Магний и кальций
Магний и кальций Вода. 8 класс
Вода. 8 класс Гидролиз солей. Лекция №9
Гидролиз солей. Лекция №9 Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Переходные элементы
Переходные элементы Деструктивные процессы переработки нефти
Деструктивные процессы переработки нефти Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу Законы химии
Законы химии Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Циклоалканы. 10 класс
Циклоалканы. 10 класс Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Сера и ее соединения
Сера и ее соединения Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Реакции SR в ряду алканов
Реакции SR в ряду алканов Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Оксиды. 8 класс
Оксиды. 8 класс Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение)