Содержание
- 2. Дәріс жоспары Су әмбебап еріткіш ретінде. Ағза тіршілігінде ерітінділердің маңызы Ерітінділердің коллигативтік қасиеттері және осмостық шиеленіс
- 3. Тірі ағзада судың атқаратын ролі: ағзада зат алмасу процестеріне белсене қатыса отырып қоректік заттардың тасымалдануы мен
- 4. Ерітінді Аса қанық ерітінді - концентрациясы каныққан ерітіндінің концентрациясынан жоғары болатын, термодинамикалық тұрақсыз ерітінді. Қаныққан ерітінді
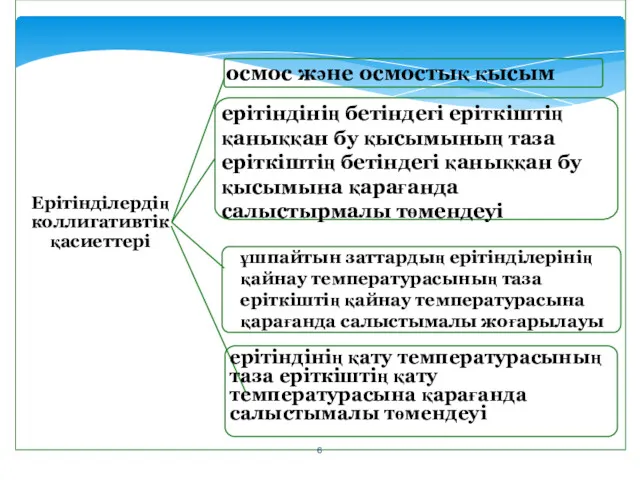
- 5. Ерітінділердің коллигативтік қасиеттері - салыстырмалы сипаттамалары еріген заттың табиғатына тәуелсіз, тек бөлшектерінің санына ғана тәуелді қасиеттері
- 6. ерітіндінің қату температурасының таза еріткіштің қату температурасына қарағанда салыстымалы төмендеуі ерітіндінің бетіндегі еріткіштің қаныққан бу қысымының
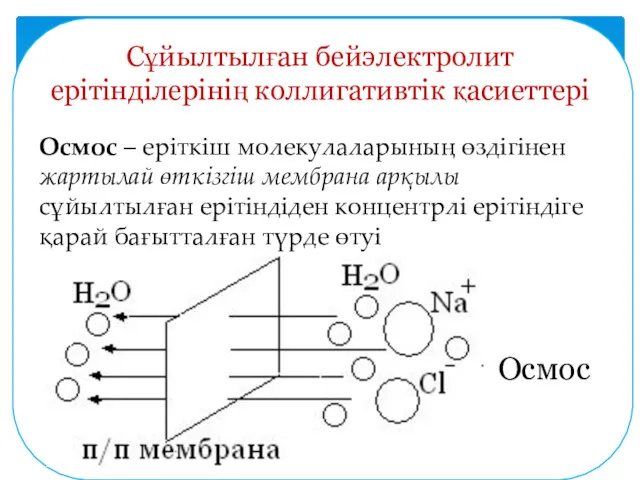
- 7. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері Осмос – еріткіш молекулаларының өздігінен жартылай өткізгіш мембрана арқылы сұйылтылған ерітіндіден
- 8. Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері Осмостық қысым (π) – осмосты тоқтату үшін ерітіндіге қажет қысым, яғни,
- 9. Росм (адам қанының) = const және 370С-та 740 – 780 кПа-ға немесе 7,4-7,8 атм –ға тең
- 10. Рауль заңы: Сұйылтылған бейэлектролит ерітіндісінің бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың табиғатына тәуелсіз және
- 11. Рауль заңынан туындайтын бірінші салдар: Ерітіндінің қату температурасының еріткіштің қату температурасына қарағанда салыстырмалы төмендеуі еріген заттың
- 12. Рауль заңынан туындайтын екінші салдар: Ерітіндінің қайнау температурасының еріткіштің қайнау температурасына қарағанда салыстырмалы жоғарылауы еріген заттың
- 13. Р осм. =СМRT – Вант-Гофф заңы: Берілген температурада сұйылтылған ерітіндінің осмостық қысымы еріген заттың молярлық концентрациясына
- 14. www.themegallery.com Физиологиялық ерітінділер Бұл қан плазмасына изотонды ерітінділер 0,9 % NaCl 4,5 – 5 % глюкоза
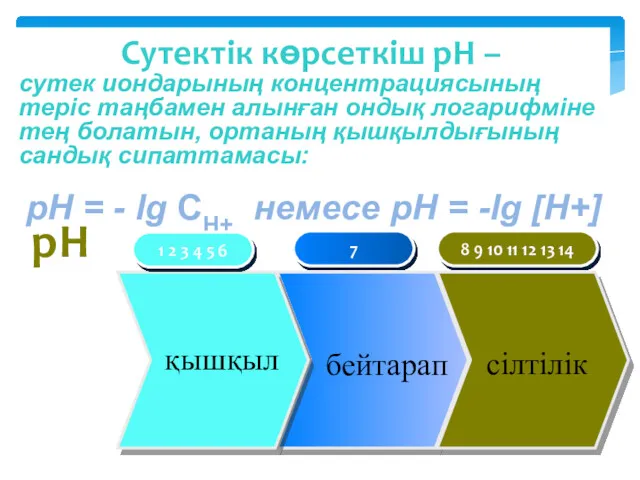
- 15. Сутектік көрсеткіш рН – сутек иондарының концентрациясының теріс таңбамен алынған ондық логарифміне тең болатын, ортаның қышқылдығының
- 16. БУФЕРЛІК ЖҮЙЕЛЕР Буферлік жүйелер – сырттан әсер болғанда өзінің қандай да бір параметрінің шамасын өзгертпей, тұрақты
- 17. Қанның буферлік жүйелері
- 18. Буферлік ерітінділердің әсер ету механизмі НА ↔ Н+ + А– а/ А– + Н+ → НА
- 19. Гидрокарбонатты буферлік жүйенің әсер ету механизмі Гидрокарбонатты буферлік жүйеге күшті қышқыл немесе сілті қосқанда: Жүйеге күшті
- 20. мұндағы Сa– күшті қышқыл эквивалентінің молярлық концентрациясы, моль/л; Va– қосылған күшті қышқыл көлемі, мл; Vб –
- 21. Механизм действия гидрокарбонатной буферной системы Действие гидрокарбонатного буфера при попадании в него сильной кислоты или щелочи
- 22. Тотығу-тотықсыздану электроды – редокс жүйемен үйлескен инертті металл, бұл электродта пайда болатын потенциал редокс потенциал деп
- 23. Ағзадағы тотығу-тотықсыздану процестердің сипаттамасы: биологиялық тотығу – ағзаның тіршілігіне керекті энергия АТФ-ң макроэргиялық байланыстарында нәтижесінде бөлініп,
- 26. Хлор, озон (суды озондау), сутегі асқын тотығы, йод ерітіндісі тәрізді көптеген тотықтырғыштар микроорганизмдерді жою үшін бактериялық
- 28. Скачать презентацию





















 Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева Силикатное производство
Силикатное производство Кислород и его применение
Кислород и его применение Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары Относительная атомная масса химических элементов. Знаки химических элементов
Относительная атомная масса химических элементов. Знаки химических элементов Типы химических реакций
Типы химических реакций Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Чистые вещества и смеси
Чистые вещества и смеси Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Алюминий и его соединения
Алюминий и его соединения Электрохимические процессы
Электрохимические процессы Мартенситное превращение
Мартенситное превращение Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс Основания. Названия оснований
Основания. Названия оснований Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Чистые вещества и смеси
Чистые вещества и смеси Связующие для полимерных композиционных материалов. (Тема 2)
Связующие для полимерных композиционных материалов. (Тема 2) Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Кислоты. Определение и классификация
Кислоты. Определение и классификация Оценка химической обстановки при авариях на химически опасных объектах. Расчет
Оценка химической обстановки при авариях на химически опасных объектах. Расчет Теория сплавов
Теория сплавов Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Biomass Feedstocks
Biomass Feedstocks Алотропні форми Карбону
Алотропні форми Карбону Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність