Содержание
- 4. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность
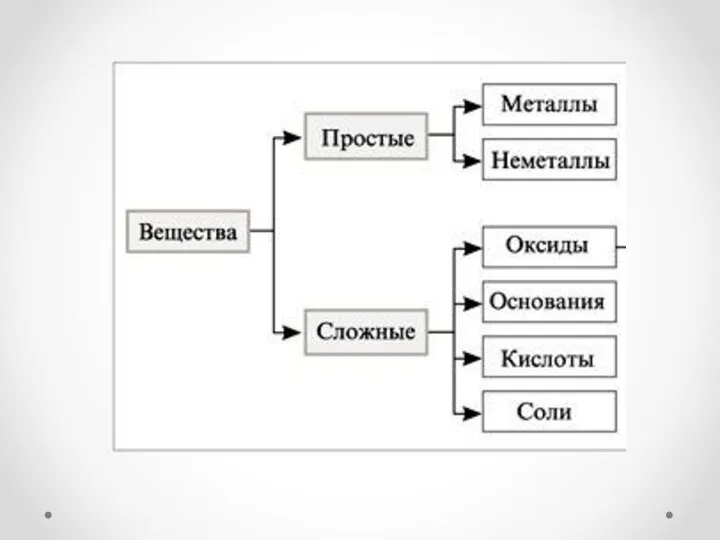
- 6. Классификация оксидов
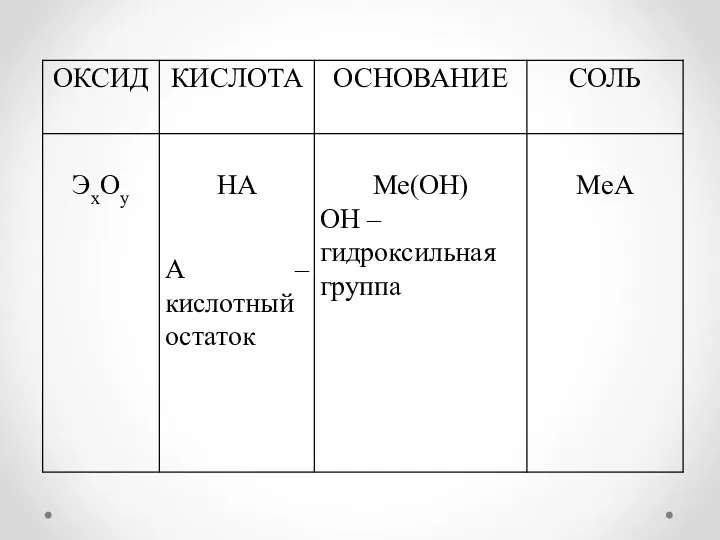
- 8. Классификация оксидов (по растворимости в воде)
- 9. Выполните задания: 1. Выпишите отдельно химические формулы солеобразующих, кислотных и основных оксидов. NaOH, AlCl3, K2O, H2SO4,
- 11. Физические свойства оксидов При комнатной температуре большинство оксидов - твердые вещества (СаО, Fe2O3 и др.), некоторые
- 12. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 1. Основной оксид + Кислотный оксид = Соль (р. соединения) CaO +
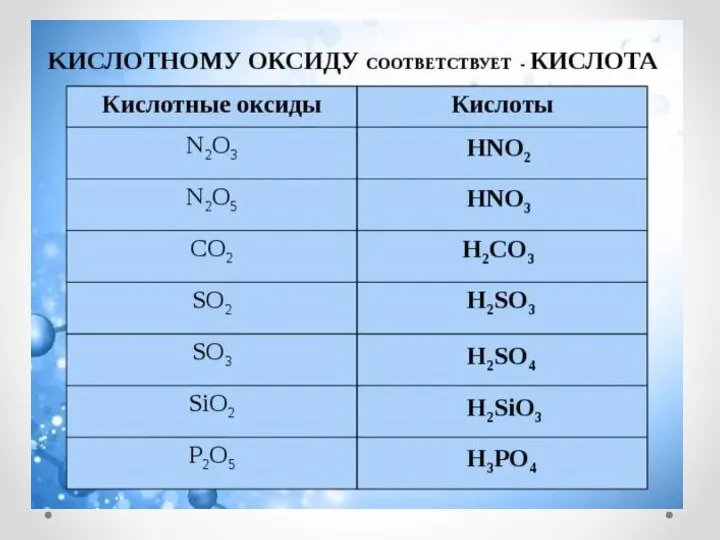
- 13. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид + Вода = Кислота (р. соединения) СO2 + H2O
- 14. ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ Взаимодействуют как с кислотами, так и со щелочами. ZnO + 2 HCl
- 15. Задания для закрепления 1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов. NaOH, AlCl3, K2O,
- 16. 3. Закончите УХР, укажите тип реакции, назовите продукты реакции Na2O + H2O = N2O5 + H2O
- 19. Скачать презентацию













 Серная кислота
Серная кислота Оксиды
Оксиды Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Milk Composition. Proteins - Молоко
Milk Composition. Proteins - Молоко Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Кислород
Кислород Химия. Дисперсные системы. Растворы
Химия. Дисперсные системы. Растворы Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации
Химические свойства оснований, кислот и солей в свете теории электролитической диссоциации Минералы и Близнецы
Минералы и Близнецы Гидролиз солей
Гидролиз солей Алкадиены
Алкадиены Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Установка по переработке углеводородов
Установка по переработке углеводородов Соли. Формулы солей
Соли. Формулы солей d997-13229e5e
d997-13229e5e Структура легированной стали
Структура легированной стали Изучение состава чая
Изучение состава чая Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Оксиды. Химические свойства и получение оксидов
Оксиды. Химические свойства и получение оксидов Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона
Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона Полимеры (10 класс)
Полимеры (10 класс) Полімери. Їх властивості та застосування
Полімери. Їх властивості та застосування Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Электронные конфигурации атомов
Электронные конфигурации атомов Технология оптического стекла
Технология оптического стекла