Содержание
- 2. АЛКЕНЫ это углеводороды, в молекуле которых два атома углерода находятся во втором валентном состоянии и связаны
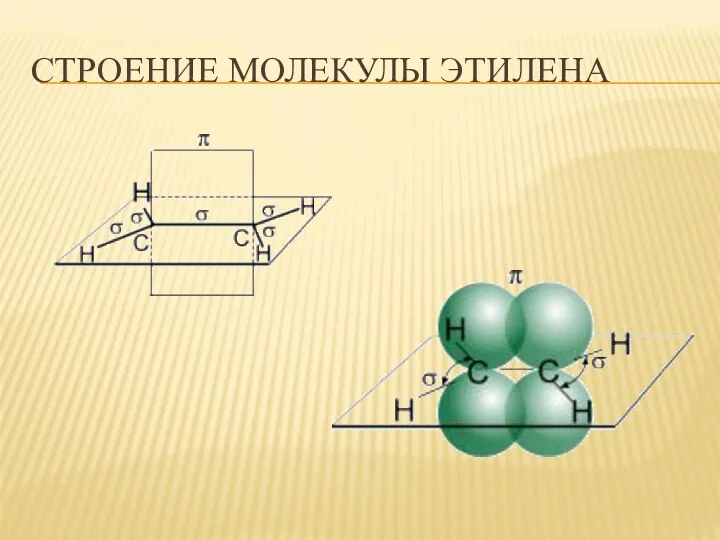
- 3. СТРОЕНИЕ МОЛЕКУЛЫ ЭТИЛЕНА
- 4. ХАРАКТЕРИСТИКА ДВОЙНОЙ СВЯЗИ (С ═ С) Вид гибридизации – sp2 Валентный угол – 1200 Длина связи
- 5. ГОМОЛОГИЧЕСКИЙ РЯД АЛКЕНОВ Общая формула СnН2n
- 6. ИЗОМЕРИЯ : 1. структурная изомерия углеродного скелета положения двойной связи 2. Межклассовая (циклоалканы) 3. Пространственная изомерия
- 7. НОМЕНКЛАТУРА Правила составления названий алкенов по международной номенклатуре. Найти наиболее длинную цепь, которая содержит двойную связь
- 8. УПРАЖНЕНИЯ 3,3-диметилбутен-1; 3,4-лиэтилгексен-2; 3-этил-4-метилгептен-2; 3-метил пентен-2; 4,5-диметилгексен-1; 3,3-диэтилпентен-1; 2-метил-5-этилгептен-3; 3-метилгексен-2 Для последнего вещества составить формулы двух
- 9. ФИЗИЧЕСКИЕ СВОЙСТВА Плохо растворимы в воде, хорошо растворяются в органических растворителях. С2– С4 - газы С5–
- 10. ХИМИЧЕСКИЕ СВОЙСТВА
- 11. РЕАКЦИИ ПРИСОЕДИНЕНИЯ 1. Гидрирование Pt,Ni, t CН2 = СН2 + Н2 → СН3 – СН3 2.
- 12. Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной связи, а атом
- 13. 5. Полимеризация СН2 = СН2 + СН2 = СН2 + СН2 = СН2 + … -СН2
- 14. ОКИСЛЕНИЕ 1. Реакция Вагнера. 3СН2 = СН2 +2КМnО4 + 4Н2О → 3СН2 - СН2 + 2МnО2
- 15. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КРАТНУЮ СВЯЗЬ Обесцвечивание бромной воды. СН2 = СН – СН3 + Вr2 →
- 16. ПОЛУЧЕНИЕ (ЛАБОРАТОРНЫЙ СПОСОБ) Дегидрогалогенирование галогеналкенов (Правило Зайцева) t Н3С ─ СН2─ СНСl ─ СН3 + КОН
- 18. Скачать презентацию














 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості