Слайд 2

Познавательные цели урока:
1. Обеспечить усвоение понятия о диеновых углеводородах и их
видах.
2. Продолжить формирование знаний о классах непредельных углеводородов, их строении, номенклатуре, изомерии, свойствах, получении и применении.
Слайд 3

Воспитательные цели урока:
1. Содействовать формированию идеи объективности и реальности окружающего мира.
2.
Продолжить формирование локальной научной (химической) картины мира.
3. Обеспечить нравственно-эстетическое воспитание.
Слайд 4

Развивающие цели урока:
1. Развивать у учащихся умения выделять главное, существенное в
изучаемом материале; сравнивать, обобщать и систематизировать.
2. Развивать самостоятельность и волю учащихся, используя для этого проблемные ситуации и дискуссии.
Слайд 5

К диеновым углеводородам относятся органические соединения с общей формулой
CnH2n-2, в
молекулах которых имеются две двойные связи.
Слайд 6
В названии появляется суффикс – ДИЕН
Слайд 7

Типы двойных связей в диенах:
1.Изолированные двойные связи разделены в цепи
двумя или более σ-связями:
СН2=СН–СН2–СН=СН2. Диены этого типа проявляют свойства, характерные для алкенов.
Слайд 8

Типы двойных связей в диенах:
2. Кумулированные двойные связи расположены у
одного атома углерода: СН2=С=СН2 (аллен)
Подобные диены (аллены) относятся к довольно редкому и неустойчивому типу соединений.
Слайд 9

Типы двойных связей в диенах:
3.Сопряженные двойные связи разделены одной σ-связью:
СН2=СН–СН=СН2
Сопряженные диены отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода.
Слайд 10

Изомерия диенов
1. Изомерия положения двойных связей:
СН2=СН–СН=СН2
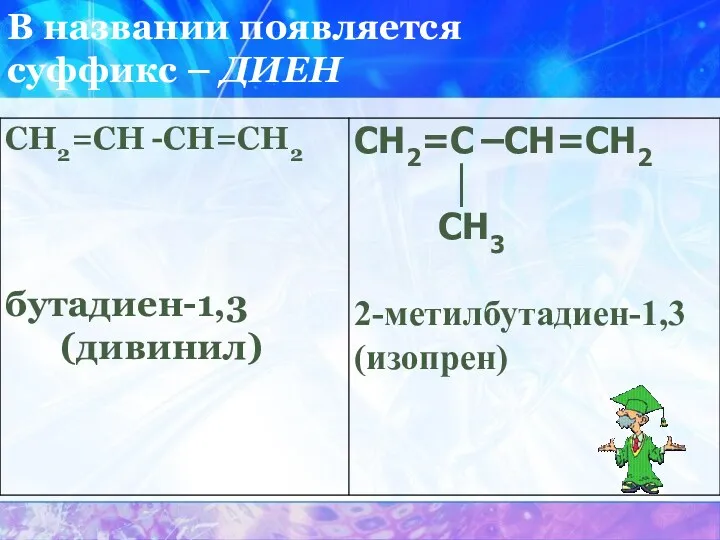
Бутадиен-1,3
СН2=С=СН – СН3
Бутадиен – 1,2
Слайд 11

Изомерия диенов
Изомерия углеродного скелета
СН2=С –СН=СН2
│
СН3
2-метилбутадиен-1,3
(изопрен)
СН2=С Н–СН=СН
│
СН3
пентадиен-1,3
Слайд 12

Изомерия диенов
3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6
соответствуют следующие соединения: бутадиен-1,3, бутин и циклобутен.
Слайд 13

Изомерия диенов
4.Пространственная изомерия -
диены, имеющие различные заместители при углеродных
атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
Слайд 14

Электронное строение диенов.
Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в
sp2-гибридизованном состоянии и имеет плоское строение.
Слайд 15

Электронное строение диенов.
π-электроны двойных связей образуют единое π-электронное облако (сопряженную систему)
и делокализованы между всеми атомами углерода.
Слайд 16

Электронное строение диенов.
Кратность связей (число общих электронных пар) между атомами углерода
имеет промежуточное значение: нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
CH2 – CH – CH – CH2
Слайд 17

Физические свойства:
Бутадиен-1,3 – бесцветный газ с характерным неприятным запахом, при
н.у. сжимается при t=-4,5 С. Горюч, взрывоопасен. В малых концентрациях раздражает слизистые оболочки глаз и дыхательных путей. ПДК = 0,1 мг/л.
Слайд 18

Физические свойства:
2- метилбутадиен-1,3 (изопрен) – бесцветная летучая жидкость, кипящая при t
= 34,1 C, имеет характерный запах, легко воспламеняется, взрывоопасна. В высоких концентрациях действует на нервную систему, угнетает кроветворение; в малых количествах раздражает слизистые оболочки глаз и дыхательных путей. ПДК в воздухе – 0,04 мг/л; в воде – 0,005 мг/л. При превышение ПДК - угнетает рост растений, вызывает гибель подводного мира водоёмов.
Слайд 19

СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов происходит
по электрофильному механизму (как в алкенах).
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная системы из двух двойных связей.
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения).
Слайд 20
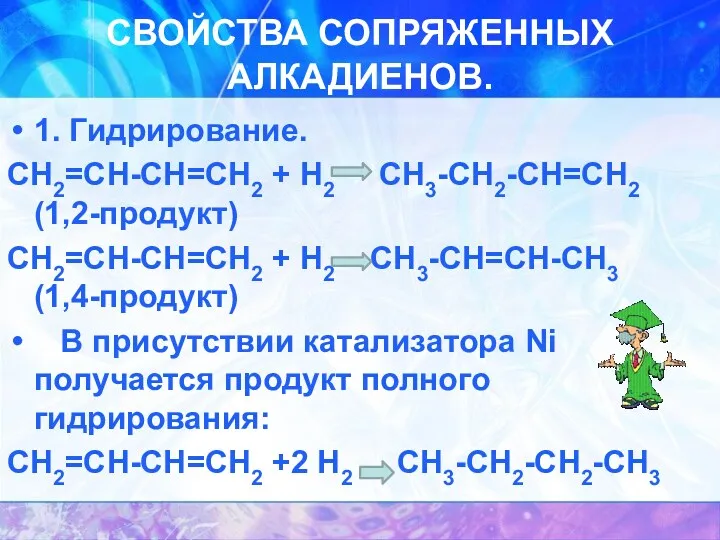
СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
1. Гидрирование.
СН2=СН-СН=СН2 + Н2 CН3-СН2-СН=СН2 (1,2-продукт)
СН2=СН-СН=СН2 + Н2 СН3-СН=СН-СН3
(1,4-продукт)
В присутствии катализатора Ni получается продукт полного гидрирования:
СН2=СН-СН=СН2 +2 Н2 СН3-СН2-СН2-СН3
Слайд 21

СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
2. Галогенирование (1,4-присоединение)
CH2 = CH – CH =
CH2 + Br2
CH2Br – CH = CH- CH2Br
1,4 – дибромбутен-2
При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
Слайд 22

СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
3.Реакция полимеризации.
Реакция протекает преимущественно по 1,4-механизму, при этом образуется
полимер с кратными связями, называемый каучуком:
nCH2=C–CH=CH2 ?( –CH2 –C =CH –CH2 –)n
│ │
CH3 CH3
Слайд 23

СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
Реакции окисления.
Протекают так же, как и в случае
алкенов – мягкое окисление приводит к многоатомному спирту, а жесткое окисление – к смеси различных продуктов, зависящих от строения диена:
СН2=СН –СН=СН2 + KMnO4 + H2O ?
СН2 – СН – СН – СН2 +MnO2 + KOH
│ │ │ │
OH OH OH OH
бутантетраол-1,2,3,4 (многоатомный спирт)
Слайд 24

ПОЛУЧЕНИЕ АЛКАДИЕНОВ.
1. Каталитическое дегидрирование алканов (через стадию образования алкенов). Этим путем
получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах.
kat, t
CH3 – CH(CH3) – CH2 – CH3 CH2 = C(CH3) – CH = CH2 + 2H2
Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен.
Слайд 25
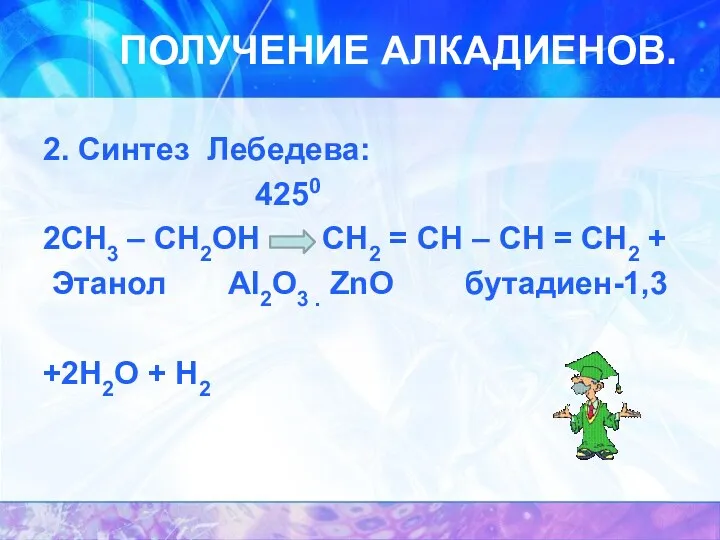
ПОЛУЧЕНИЕ АЛКАДИЕНОВ.
2. Синтез Лебедева:
4250
2CH3 – CH2OH CH2 = CH –
CH = CH2 +
Этанол AI2O3 . ZnO бутадиен-1,3
+2H2O + H2
Слайд 26
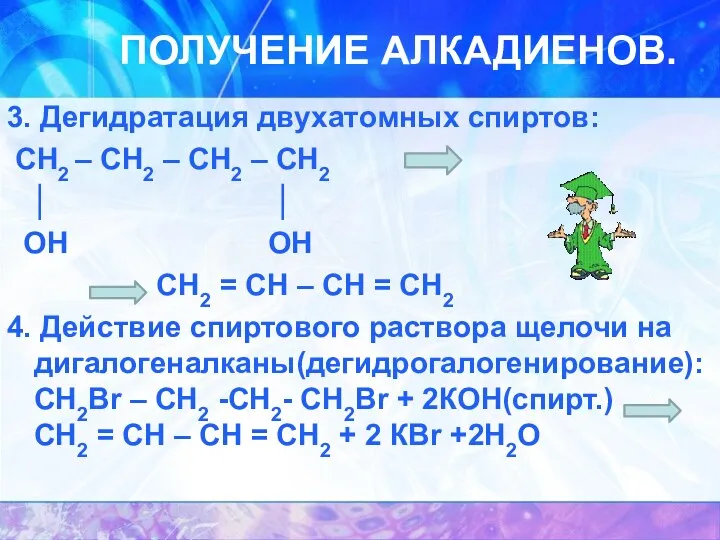
ПОЛУЧЕНИЕ АЛКАДИЕНОВ.
3. Дегидратация двухатомных спиртов:
СН2 – СН2 – СН2
– СН2
│ │
OH OH
CH2 = CH – CH = CH2
4. Действие спиртового раствора щелочи на дигалогеналканы(дегидрогалогенирование): CH2Br – CH2 -CH2- CH2Br + 2КОН(спирт.) CH2 = CH – CH = CH2 + 2 КBr +2H2O
Слайд 27

Применение диенов:
Основной областью применения диеновых углеводородов является получение каучуков различных марок,
а на их основе – получение резин с различными свойствами ( эластичность, бензо- и маслостойкость, стойкость к истиранию, к действию высоких и низких температур, действию кислот и щелочей…)
Слайд 28

Домашнее задание:
Параграф 11.
Подготовить сообщения об истории открытия каучука и о создании
искусственного каучука (можно в форме презентаций).



























 Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6 Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Крахмал. Физические свойства
Крахмал. Физические свойства Типы химических реакций
Типы химических реакций Сплавы и их свойства. Легирующие добавки
Сплавы и их свойства. Легирующие добавки Organic Compounds
Organic Compounds Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Теория электролитической диссоциации
Теория электролитической диссоциации Титриметрический метод анализа
Титриметрический метод анализа Магний (Mg)
Магний (Mg) Катализ кислотами и основаниями. Лекция 3
Катализ кислотами и основаниями. Лекция 3 Теория электролитической диссоциации
Теория электролитической диссоциации Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Периодический закон Д.И. Менделеева. Строение атома. Химическая связь
Периодический закон Д.И. Менделеева. Строение атома. Химическая связь Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Ионы и ионная химическая связь
Ионы и ионная химическая связь Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Неметаллы VIА-подгруппы
Неметаллы VIА-подгруппы Обратимые реакции. Химическое равновесие. Смещение равновесия
Обратимые реакции. Химическое равновесие. Смещение равновесия Игрушка слайм-лизун. Создание собственной игрушки-лизуна в домашних условиях
Игрушка слайм-лизун. Создание собственной игрушки-лизуна в домашних условиях Алкены. Химия
Алкены. Химия